- 322.00 KB
- 2022-07-26 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
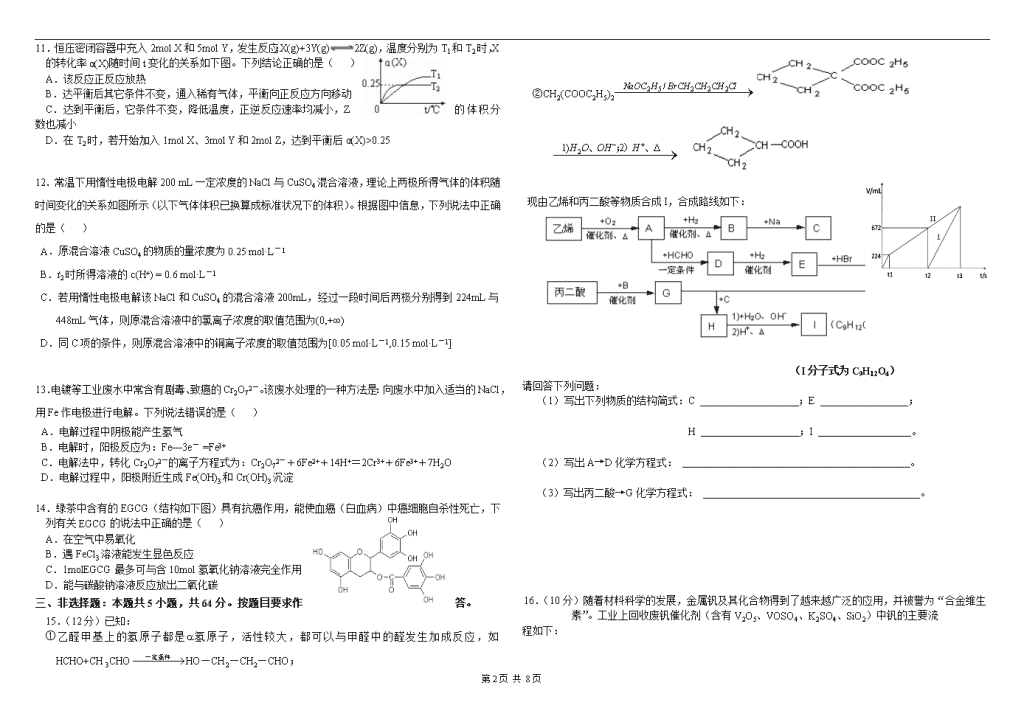
2016年中山市高中化学竞赛试题可能用到的相对原子质量:H—1C—12Na—23O—16 S—32Mg—24V—51一、单项选择题:本题包括10小题,每小题2分,共20分。每小题给出的四个选项中,只有一个选项符合题目要求,选对的得2分,多选、错选或不答的均得0分1.现有X、Y、Z、W四种主族元素。若X的阳离子与Y的阴离子具有相同的电子层结构,W的阳离子的氧化性大于等电荷的X的阳离子的氧化性,Z的阴离子半径大于等电荷的Y的阴离子半径,四种元素的原子序数由大到小的顺序正确的是() A.Z>X>Y>W B.W>X>Y>Z C.X>Z>Y>W D.Z>Y>X>W2.固体NH4I放入真空的密闭容器中,加热至一定温度后恒温,发生下列反应:NH4I(s)NH3(g)+HI(g)2HI(g)H2(g)+I2(g) 平衡时,测得总压为5.00kPa,其中H2的分压为0.50kPa。则下列说法中正确的是() A.固体NH4I一定全部分解 B.若开始放入固体NH4I的量增大一倍,则平衡时总压也会增大一倍 C.平衡时HI的分解率为10% D.平衡时氨的分压为2.50kPa3.在配平的下列反应中,□H3AsO4(aq)+□Zn(s)+□H+(aq)+□H2O(aq)→□AsH3(g)+□Zn(H2O)42+(aq),H2O前面的系数为() A.8 B.12 C.16 D.204.在常温下,发生下列几种反应: ①16H++10Z-+2XO4-→2X2++5Z2+8H2O②2A2++B2→2A3++2B-③2B-+Z2→B2+2Z-根据上述反应,判断下列结论中错误的是() A.溶液中可发生:Z2+2A2+→2A3++2Z- B.Z2在①、③反应中为还原剂 C.氧化性强弱的顺序为:XO4->Z2>B2>A3+ D.X2+是XO4-的还原产物5.已知在pH值为4左右的环境中,Ca2+、Fe2+几乎不水解,而Fe3+几乎完全水解。工业上制CuCl2是将浓盐酸用蒸气加热到80℃左右,再慢慢加入粗氧化铜(含少量杂质FeO),充分搅拌使之溶解。欲除去溶液中的杂质离子,下述方法中可行的是() A.加入纯Cu将Fe2+还原为Fe B.向溶液中通入H2S使Fe2+沉淀 C.向溶液中通入Cl2,再通入NH3,调节pH值为4左右 D.向溶液中通入Cl2,再加入纯净的CuO粉末调节pH值为4左右6.C8H8经多步裂化,最后完全转化为C4H8、C3H6、C2H4、C2H6、CH4五种气体混合物,该混合物的平均相对分子质量可能是() A.28或30 B.30或38 C.38或40 D.30或407.在一个固定容积的密闭容器中,充入2molNO2,一定温度下建立如下平衡:2NO2N2O4。此时平衡混合气中NO2的体积分数为x%,若再充入1molN2O4,在温度不变的情况下,达到新的平衡时,测得NO2的体积分数为y%,则x和y的大小关系正确的是()A.x>yB.x<yC.x=yD.不能确定8.C12H18有多种同分异构体,其中二取代苯的同分异构体(不考虑立体异构)有多少种?()A.45种B.48种C.49种D.以上都不是9.某碱性溶液中只有NH4+、Cl-、H+、OH-四种离子。则下列描述正确的是() A.该溶液可能由pH=12的氨水与pH=2的盐酸等体积混合而成 B.该溶液中一定存在下列关系:c(NH3·H2O)+c(OH-)=c(H+) C.通入适量的HCl,溶液中离子浓度一定存在:c(Cl-)>c(NH4+)>c(H+)>c(OH-)D.加入适量醋酸,c(NH4+)一定大于c(Cl-)、c(CH3COO-)之和10.碱性硼化钒(VB2)—空气电池工作时反应为:4VB2+11O2=4B2O3+2V2O5。用该电池为电源,选用惰性电极电解硫酸铜溶液,实验装置如图所示。当外电路中通过0.04mol电子时,B装置内共收集到0.448L气体(标准状况),则下列说法正确的是()A.VB2电极发生的电极反应为:2VB2+11H2O-22e-=V2O5+2B2O3+22H+B.外电路中电子由c电极流向VB2电极C.电解过程中,c电极表面先有红色物质析出,后有气泡产生D.若B装置内的液体体积为100mL,则CuSO4溶液的物质的量浓度为0.05mol·L-1二、双项选择题:本题包括4小题,每小题4分,共16分。每小题给出的四个选项中,有两个选项符合题目要求。全选对得4分,只选1个且正确得2分,有选错或不选得0分。第4页共8页\n11.恒压密闭容器中充入2molX和5molY,发生反应:X(g)+3Y(g)2Z(g),温度分别为T1和T2时,X的转化率α(X)随时间t变化的关系如下图。下列结论正确的是() A.该反应正反应放热 B.达平衡后其它条件不变,通入稀有气体,平衡向正反应方向移动C.达到平衡后,它条件不变,降低温度,正逆反应速率均减小,Z的体积分数也减小D.在T2时,若开始加入1molX、3molY和2molZ,达到平衡后α(X)>0.2512.常温下用惰性电极电解200 mL 一定浓度的NaCl与CuSO4混合溶液,理论上两极所得气体的体积随时间变化的关系如图所示(以下气体体积已换算成标准状况下的体积)。根据图中信息,下列说法中正确的是()A.原混合溶液CuSO4的物质的量浓度为0.25mol·L-1B.t2时所得溶液的c(H+) = 0.6mol·L-1C.若用惰性电极电解该NaCl和CuSO4的混合溶液200mL,经过一段时间后两极分别得到224mL与448mL气体,则原混合溶液中的氯离子浓度的取值范围为(0,+∞)D.同C项的条件,则原混合溶液中的铜离子浓度的取值范围为[0.05mol·L-1,0.15mol·L-1]13.电镀等工业废水中常含有剧毒、致癌的Cr2O72-。该废水处理的一种方法是:向废水中加入适当的NaCl,用Fe作电极进行电解。下列说法错误的是()A.电解过程中阴极能产生氢气B.电解时,阳极反应为:Fe—3e-=Fe3+C.电解法中,转化Cr2O72-的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2OD.电解过程中,阳极附近生成Fe(OH)3和Cr(OH)3沉淀14.绿茶中含有的EGCG(结构如下图)具有抗癌作用,能使血癌(白血病)中癌细胞自杀性死亡,下列有关EGCG的说法中正确的是() A.在空气中易氧化B.遇FeCl3溶液能发生显色反应 C.1molEGCG最多可与含10mol氢氧化钠溶液完全作用 D.能与碳酸钠溶液反应放出二氧化碳三、非选择题:本题共5小题,共64分。按题目要求作答。15.(12分)已知:①乙醛甲基上的氢原子都是a氢原子,活性较大,都可以与甲醛中的醛发生加成反应,如HCHO+CH3CHOHO—CH2—CH2—CHO;②CH2(COOC2H5)2现由乙烯和丙二酸等物质合成I,合成路线如下:(I分子式为C9H12O4)请回答下列问题:(1)写出下列物质的结构简式:C;E;H;I。(2)写出A→D化学方程式:。(3)写出丙二酸→G化学方程式:。16.(10分)随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金维生素”。工业上回收废钒催化剂(含有V2O5、VOSO4、K2SO4、SiO2)中钒的主要流程如下:第4页共8页\n已知:(1)V2O5和NH4VO3均为难溶物,VOSO4和(VO2)2SO4均为易溶物。(2)2VO2++H2C2O4+2H+ =2VO2+ +2CO2↑+2H2O回答下列问题:(1)步骤①前,粉碎的目的是__________________________________________________。(2)步骤②中发生反应的离子方程式为__________________________。(3)步骤③的变化过程可简化为(HA表示有机萃取剂):VOSO4 (水层)+2HA(有机层)VOA2(有机层)+H2SO4(水层),则步骤④中可选择硫酸作反萃取的原因是___________________________________________________________________________。(4)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定操作⑤后溶液中含钒量的步骤为:取10.0mL0.1mol/LH2C2O4溶液于锥形瓶中,加入指标剂,将待测液盛放在滴定管中,滴定到终点时,消耗待测液的体积为10.0mL,由此可知(VO2)2SO4溶液钒元素的含量为_________g/L。(5)V2O5可用金属(如Ca、Al)热还原法获得钒,则金属铝热还原制得钒的化学方程式为_________________________________________________________________________。17.(16分)乙二醛(OHC—CHO)是一种重要的精细化工产品。Ⅰ.工业生产乙二醛(1)乙醛(CH3CHO)液相硝酸氧化法在Cu(NO3)2催化下,用稀硝酸氧化乙醛制取乙二醛,反应的化学方程式为。该法具有原料易得、反应条件温和等优点,但也存在比较明显的缺点是。(2)乙二醇(HOCH2CH2OH)气相氧化法①已知:OHC—CHO(g)+2H2(g)HOCH2CH2OH(g)△H=−78kJ·mol−1K12H2(g)+O2(g)2H2O(g)△H=−484kJ·mol−1K2乙二醇气相氧化反应HOCH2CH2OH(g)+O2(g)OHC—CHO(g)+2H2O(g)的△H=kJ·mol−1。相同温度下,该反应的化学平衡常数K=(用含K1、K2的代数式表示)。②当原料气中氧醇比为1.35时,乙二醛和副产物CO2的产率与反应温度的关系如图所示。反应温度在450~495℃之间和超过495℃时,乙二醛产率降低的主要原因分别是哪两点:、。Ⅱ.乙二醛电解氧化制备乙醛酸(OHC—COOH)的生产装置如图所示,通电后,阳极产生的Cl2与乙二醛溶液反应生成乙醛酸。(3)阴极反应式为。(4)阳极液中盐酸的作用,除了产生氯气外,还有。(5)保持电流强度为aA,电解tmin,制得乙醛酸mg,列式表示该装置在本次电解中的电流效率η=。(设:法拉第常数为fC•mol−1;η=)18.(12分)测定铵盐中氮含量的经典方法是:将NaOH与NH4+离子作用,产生的氨气通入盐酸溶液中被吸收,当吸收完全后,以0.1%甲基红为指示剂,用标准氢氧化钠溶液滴定剩余的盐酸,从而计算出氮的含量。用上述方法测定氮含量有两点不太理想:第一点是氨溶于盐酸中生成氯化铵,其溶液是无色的,不能直观地看到氨气是否被盐酸吸收;第二点是采用甲基红为指示剂,其pH变色范围较宽(pH=4.4~6.2),判断终点不太灵敏,第4页共8页\n容易带来误差。后改用新的分析方法,即:用硼酸为氨的吸收液,0.1%的亚甲基蓝和0.1%的甲基红的混合液为指示剂(变色范围pH=5.2~5.6,酸性时为红紫色,碱性时为绿色),用标准盐酸滴定上述吸收了氨的混合液,求出氮的含量。根据新的分析方法,回答下列问题:(1)若用如右图的装置使NH4Cl与NaOH反应放出氨气,则a中应放的药品是,b中应放的药品是,c中应放入和。(2)硼酸吸收液从色变到色时表示有氨被吸收。(3)用标准盐酸滴定硼酸吸收液时,是否要再另加指示剂?答:。(4)新方法的主要优点是:。19.(14分)某化学兴趣小组拟用氧化铜(含少量氯化亚铁和不溶于酸的杂质)制取无水氯化铜,并测定样品中氧化铜的质量分数,其实验步聚如下:实验过程中pH值的控制参照表1中的数据;加入的X、Y试剂在表2中选用:表1表2物质沉淀开始时的pH值沉淀完全时的pH值A碱式碳酸铜E双氧水Fe(OH)27.69.6B氢氧化钠F稀硝酸Fe(OH)32.73.7C氨水G高锰酸钾Cu(OH)25.26.4D氧化铜H氯水试回答下列问题:(1)沉淀II的成分是(写化学式)(2)物质X可选用表2中的(填序号)物质Y可选用表2中的(填序号)(3)第⑤步操作需在HCl气流下进行,所需装置如图:按气体流动方向从左到右,各装置的连接顺序(填字母)为。D中所发生反应的化学方程式为。C的作用是。(4)若④步中有80%的氯化铜进入晶体,其余各步的转化都是完全的,则样品中氧化铜的质量分数的计算式是。第4页共8页