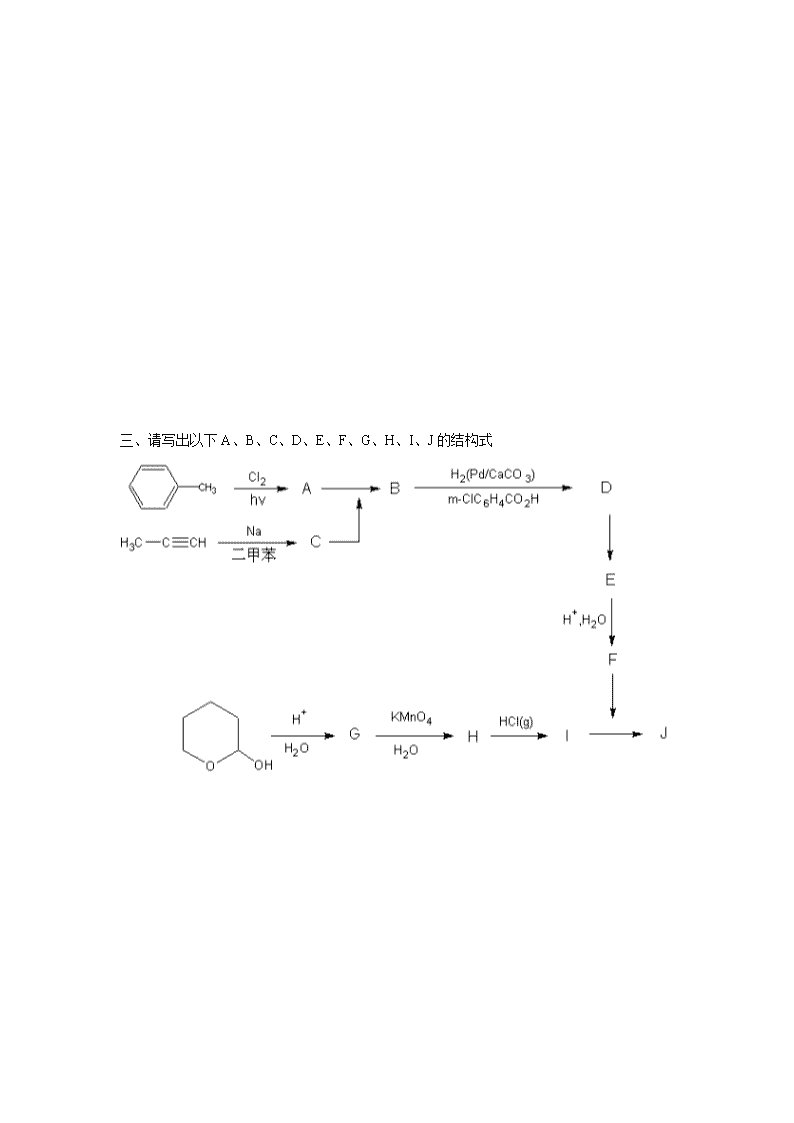- 59.00 KB
- 2022-07-26 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
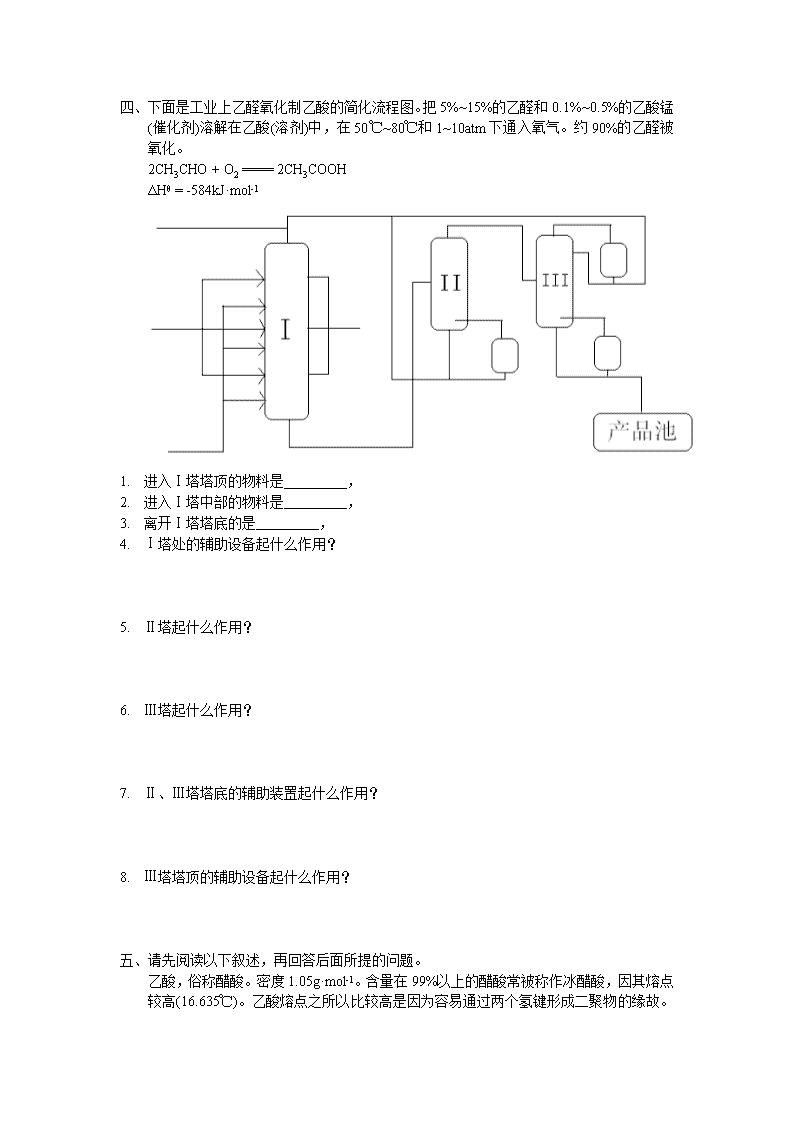
1989全国高中学生化学竞赛决赛试题一、氙和氟作用生成XeF2、XeF4、XeF6,反应的平衡常数分别为:Kp(250℃)Kp(400℃)(a)Xe(g)+F2(g)=XeF2(g)8.80×1043.60×102(b)Xe(g)+2F2(g)=XeF4(g)1.07×1081.98×103(c)Xe(g)+3F2(g)=XeF6(g)1.01×10836.01.现要求制备压力为1atm的XeF2(XeF4含量小于1%)。求在250℃和400℃时,起始物中氙和氟的摩尔比。2.欲制备压力为1atm的XeF6(XeF4含量小于1/10)。问用单质合成XeF6应选取的温度下与分压力为1.0atm的XeF6达平衡的氟的分压有多大?3.由单质合成XeF4时,应把温度保持在250℃还是400℃,或250℃、400℃均可?简述理由。二、称取含有Na2S和Sb2S3的试样0.2000克,溶于浓HCl,加热,生成的H2S被50.00ml浓度为0.01000mol·L-1的酸性碘标准液吸收。此时,H2S被氧化成硫。滴定剩余的碘消耗了0.02000mol·L-1Na2S2O3标准溶液10.00ml。将出去H2S的试液调为弱碱性,用上述碘标准溶液滴定锑[Sb(Ⅲ)→Sb(Ⅴ)],消耗了10.00ml。写出配平了的有关方程式。计算试样中Sb2S3和Na2S的百分含量。(Na2S、Sb2S3的摩尔质量分别为78.04、339.7g/mol)\n一、请写出以下A、B、C、D、E、F、G、H、I、J的结构式\n一、下面是工业上乙醛氧化制乙酸的简化流程图。把5%~15%的乙醛和0.1%~0.5%的乙酸锰(催化剂)溶解在乙酸(溶剂)中,在50℃~80℃和1~10atm下通入氧气。约90%的乙醛被氧化。2CH3CHO+O2====2CH3COOHΔHθ=-584kJ·mol-11.进入Ⅰ塔塔顶的物料是_________,2.进入Ⅰ塔中部的物料是_________,3.离开Ⅰ塔塔底的是_________,4.Ⅰ塔处的辅助设备起什么作用?5.Ⅱ塔起什么作用?6.Ⅲ塔起什么作用?7.Ⅱ、Ⅲ塔塔底的辅助装置起什么作用?8.Ⅲ塔塔顶的辅助设备起什么作用?二、请先阅读以下叙述,再回答后面所提的问题。乙酸,俗称醋酸。密度1.05g·mol-1。含量在99%以上的醋酸常被称作冰醋酸,因其熔点较高(16.635℃\n)。乙酸熔点之所以比较高是因为容易通过两个氢键形成二聚物的缘故。这一反应可以表示为:在0℃,上述反应的平衡常数K=15.8。在高温低压下可解离为单体。在不同压力、不同温度下测得的醋酸蒸汽的“分子量”如图中曲线所示。乙酸分子的缔合是其许多物理性质异常的原因。例如它的沸点为118.1℃,而与它结构类似,只少一个羰基氧的乙醇的沸点只有78.3℃。乙酸的氢键键能为29.7~31.4kJ·mol-1,而乙醇则只有17~21kJ·mol-1。乙酸可以失水变成乙酸酐在常压、80℃下每升纯乙酸中含1.2×10-3mol的乙酸酐。乙酸和各种羧酸有如下解离:羰基中的羟基氧比一般醇中羟基氢容易解离。这是因为羟酸根中的羰基π电子云和羟基氧原子的p电子云互相连接,电子可以均匀分布在两个氧原子之间,形成稳定的酸根。冰醋酸做为溶剂时能促进弱碱(如甲胺)的质子化,在水里的弱碱在冰醋酸里就变成了较强的碱。请回答下列问题:\n1.画出乙酸二聚物的结构。2.计算在0℃,100%乙酸中单分子状态所占的百分数。3.在0.1大气压下的乙酸蒸汽中,乙酸有哪些存在形式?在0.1大气压下,乙酸蒸汽中有1/3是二聚物时的温度等于多少?4.乙酸蒸汽的“分子量”最高限度和最低限度各为多少?并加以解释。5.如何把含水1%的乙酸变成接近100%的乙酸?6.画出羧酸根的电子结构式。在羧酸根中的两个氧原子是相同的,还是不同的?7.对氨基苯酚在冰醋酸中如何解离?它在冰醋酸中的pK1和pK2比它在水中的大还是小?一、向硫酸四氨合铜的水溶液通入二氧化硫至溶液呈微酸性,生成白色沉淀A。元素分析表明A含Cu、N、S、H、O五种元素,而且摩尔比Cu:N:S=1:1:\n1。激光拉曼光谱和红外光谱显示A的晶体里有一种呈三角锥体和一种呈正四面体的离子(或分子)。磁性实验指出A呈逆磁性。1.写出A的化学式。2.写出生成A的配平离子方程式和分子方程式。3.将A和足量的10mol·L-1的硫酸混合微热,生成沉淀B、气体C和溶液D。B是主要产品,尽管它是常见物质,本法制得的呈超细粉末状,有重要用途。写出这个反应式(配平)。4.按3操作得到的B的最大理论产率是多少?5.有人设计了在密闭容器里使A和硫酸反应,结果使B的产率大大超过4的估计。问:在这种设计的操作下,B的最大理论产率多大?试对此做出解释。一、据报道,1986年发现的有高温超导性的钇钡铜氧化物具有与钙钛矿构型相关的一种晶体结构。钙钛矿型的结构属于立方晶系,其立方晶胞中的离子位置可按方式(Ⅰ)描述为:较大的阳离子A处于晶胞的中心(即体心位置),较小的阳离子B处于晶胞的顶角(即晶胞原点位置),而晶胞中所有棱边的中点(即棱心位置)则为阴离子X所占据。试回答如下问题:1.若将同一结构改用另一方式(Ⅱ)来描述,将阳离子A置于晶胞的顶角、阳离子B置于晶胞中心,试问诸阴离子X当处于晶胞中的什么位置?2.晶胞(Ⅰ)和晶胞(Ⅱ)的相互关系是什么?3.晶胞中有A、B、X各几个?答:_________与晶体对应的化学式可以表达为__________4.\nA、B、X的异号离子配位数各是多少?(即A、B各与几个X相邻接?X各与几个A、B相邻接?)1.设以晶胞(Ⅱ)的体对角线为法线,包含晶胞的三条面对角线的面在晶体学中成为(111)面。下面给出通过三条面对角线(111)面上的原子排布图(在纸面上可向上、下、左、右扩展)。试选用代表离子种类的符号A、B、X填入图中圆内以示出该(111)面上原子的相对位置。(附注:与该面平行的面在晶体学中均称为(111)面)2.结构中与每个小阳离子B邻接的X和A的总(配位)数是多少?