- 599.50 KB
- 2022-07-26 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
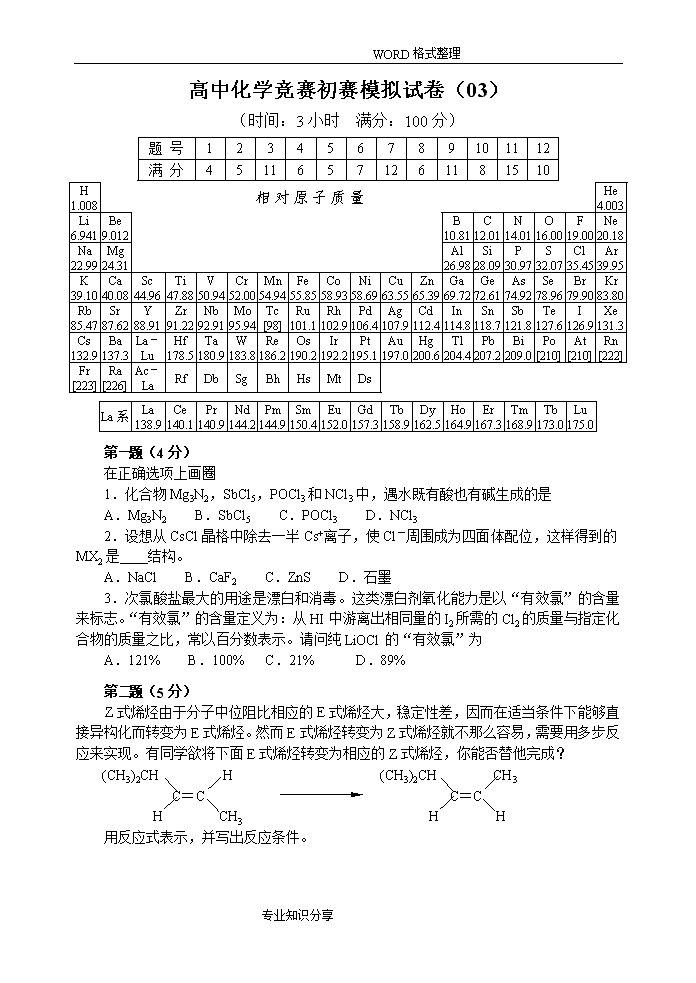
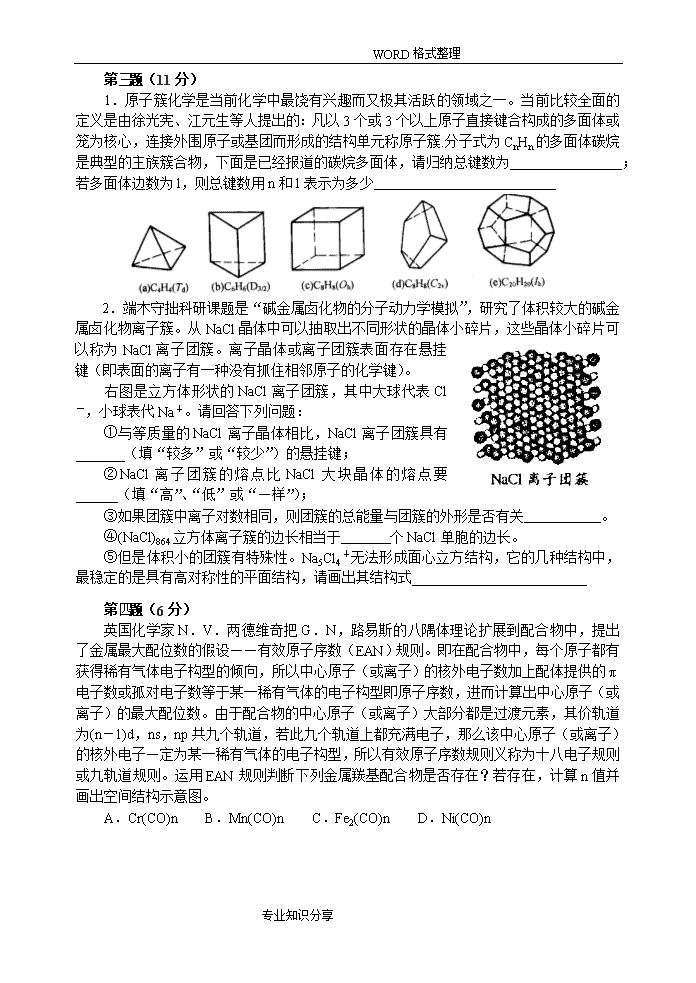
WORD格式整理高中化学竞赛初赛模拟试卷(03)(时间:3小时满分:100分)题号123456789101112满分45116571261181510H1.008相对原子质量He4.003Li6.941Be9.012B10.81C12.01N14.01O16.00F19.00Ne20.18Na22.99Mg24.31Al26.98Si28.09P30.97S32.07Cl35.45Ar39.95K39.10Ca40.08Sc44.96Ti47.88V50.94Cr52.00Mn54.94Fe55.85Co58.93Ni58.69Cu63.55Zn65.39Ga69.72Ge72.61As74.92Se78.96Br79.90Kr83.80Rb85.47Sr87.62Y88.91Zr91.22Nb92.91Mo95.94Tc[98]Ru101.1Rh102.9Pd106.4Ag107.9Cd112.4In114.8Sn118.7Sb121.8Te127.6I126.9Xe131.3Cs132.9Ba137.3La-LuHf178.5Ta180.9W183.8Re186.2Os190.2Ir192.2Pt195.1Au197.0Hg200.6Tl204.4Pb207.2Bi209.0Po[210]At[210]Rn[222]Fr[223]Ra[226]Ac-LaRfDbSgBhHsMtDsLa系La138.9Ce140.1Pr140.9Nd144.2Pm144.9Sm150.4Eu152.0Gd157.3Tb158.9Dy162.5Ho164.9Er167.3Tm168.9Tb173.0Lu175.0第第题(4分)1、D(1分)2、B(1分)3、A(2分)题(4分)在正确选项上画圈1.化合物Mg3N2,SbCl5,POCl3和NCl3中,遇水既有酸也有碱生成的是A.Mg3N2B.SbCl5C.POCl3D.NCl32.设想从CsCl晶格中除去一半Cs+离子,使Cl-周围成为四面体配位,这样得到的MX2是结构。A.NaClB.CaF2C.ZnSD.石墨3.次氯酸盐最大的用途是漂白和消毒。这类漂白剂氧化能力是以“有效氯”的含量来标志。“有效氯”的含量定义为:从HI中游离出相同量的I2所需的Cl2的质量与指定化合物的质量之比,常以百分数表示。请问纯LiOCl的“有效氯”为A.121%B.100%C.21%D.89%第第题(5分)题(5分)Z式烯烃由于分子中位阻比相应的E式烯烃大,稳定性差,因而在适当条件下能够直接异构化而转变为E式烯烃。然而E式烯烃转变为Z式烯烃就不那么容易,需要用多步反应来实现。有同学欲将下面E式烯烃转变为相应的Z式烯烃,你能否替他完成?(CH3)2CHH(CH3)2CHCH3C=CC=CHCH3HH用反应式表示,并写出反应条件。专业知识分享\nWORD格式整理第第题(11分)1.[(3n/2)+n]=5n/2;(4n-l)(4分)2.较多(1分);低(1分);有关(1分);6(2分);(2分)题(11分)1.原子簇化学是当前化学中最饶有兴趣而又极其活跃的领域之一。当前比较全面的定义是由徐光宪、江元生等人提出的:凡以3个或3个以上原子直接键合构成的多面体或笼为核心,连接外围原子或基团而形成的结构单元称原子簇.分子式为CnHn的多面体碳烷是典型的主族簇合物,下面是已经报道的碳烷多面体,请归纳总键数为;若多面体边数为l,则总键数用n和l表示为多少2.端木守拙科研课题是“碱金属卤化物的分子动力学模拟”,研究了体积较大的碱金属卤化物离子簇。从NaCl晶体中可以抽取出不同形状的晶体小碎片,这些晶体小碎片可以称为NaCl离子团簇。离子晶体或离子团簇表面存在悬挂键(即表面的离子有一种没有抓住相邻原子的化学键)。右图是立方体形状的NaCl离子团簇,其中大球代表Cl-,小球表代Na+。请回答下列问题:①与等质量的NaCl离子晶体相比,NaCl离子团簇具有_______(填“较多”或“较少”)的悬挂键;②NaCl离子团簇的熔点比NaCl大块晶体的熔点要______(填“高”、“低”或“—样”);③如果团簇中离子对数相同,则团簇的总能量与团簇的外形是否有关。④(NaCl)864立方体离子簇的边长相当于个NaCl单胞的边长。⑤但是体积小的团簇有特殊性。Na5Cl4+无法形成面心立方结构,它的几种结构中,最稳定的是具有高对称性的平面结构,请画出其结构式第第题(6分)A存在,24+2n=36,n=6,即Cr(CO)6;B不存在,因为Mn的原子序数为25,所以锰的中性羰基化合物为双聚体Mn2(CO)10,Mn与Mn原子之间金属键连接,看作Mn与Mn原子共用一对电子,即25+1+2n=36,解得n=5。C存在,该分子是双聚体,铁原子之间存在金属键,这样就可以少1个CO配体,所以n=9D存在,28+2n=36,n=4,就是Ni(CO)4题(6分)英国化学家N.V.两德维奇把G.N,路易斯的八隅体理论扩展到配合物中,提出了金属最大配位数的假设——有效原子序数(EAN)规则。即在配合物中,每个原子都有获得稀有气体电子构型的倾向,所以中心原子(或离子)的核外电子数加上配体提供的π电子数或孤对电子数等于某一稀有气体的电子构型即原子序数,进而计算出中心原子(或离子)的最大配位数。由于配合物的中心原子(或离子)大部分都是过渡元素,其价轨道为(n-1)d,ns,np共九个轨道,若此九个轨道上都充满电子,那么该中心原子(或离子)的核外电子—定为某一稀有气体的电子构型,所以有效原子序数规则义称为十八电子规则或九轨道规则。运用EAN规则判断下列金属羰基配合物是否存在?若存在,计算n值并画出空间结构示意图。A.Cr(CO)nB.Mn(CO)nC.Fe2(CO)nD.Ni(CO)n专业知识分享\nWORD格式整理第第题(5分)分子间的氢键使晶体的升华热升高。苯无电负性强的原子,所以无氢键生成。后三者分子中氧原子的电负性较大,所以它们在液体和晶体中都能形成分子间氢键,但不能形成分子内氢键,致使它们的升华热增大。苯酚分子有一个氧原子,一般是1个分子生成一个氢键。苯甲酸分子有2个氧原子,对位-羟基苯甲酸分子有3个氧原子,都能形成氢键,它们结构如图。所以,后三者的升华热分别比苯大25kJ·mol-1,48kJ·mol-1,72kJ·mol-1,逐次超过的正好是1摩尔氢键的键能。题(5分)已知苯、苯酚、苯甲酸和对位-羟基苯甲酸的升华热分别为43.9kJ·mol-1,67.4kJ·mol-1,91.2kJ·mol-1,115.9kJ·mol-1。试由晶体中生成氢键的观点讨论这些升华热数据的递变规律。第第题(7分)1.(1分)2.4+4NO2+O24-NO2+2H2O4+4NO2+3O24-O-NO2+2H2O2+O22-OH(3分)3.(2分)2-甲基-2-硝基丙烷(1分)题(7分)据报道一种低温生产硝化烷烃的新方法已经问世。该方法是以N-羟基邻苯二甲酰亚胺为催化剂用NO2和O2在70℃下氧化烷烃。这种烷烃低温硝化的方法的最大优点是产率高,不发生烷烃的断链,并且叔碳原子优先被硝化用该法硝化环己烷得到产率为70%的硝基环己烷和30%的硝酸环己酯及极少量的环己醇。异丁烷用该法硝化得到的产率最高的硝基烷的产率为46%。就以上信息完成下列各题:1.写出该硝化反应的催化剂的结构式。2.写出环己烷发生上述反应的三个化学反应方程式(并配平)。3.写出异丁烷发生上述反应得到产率为46%的产物的结构式并命名。第第题(12分)1.[HOCH2(CHOH)4COO]2Zn(2分)[CH3CH(OH)COO]2Zn·3H2O(1分)2.氨基酸锌是以二价锌阳离子与给电子氨基酸中氨基N原子形成配位键,又与给电子的羰基形成五元或六元环(1分),是一螯合状化合物,因而具有以下特点:①金属与氨基酸形成的环状结构使分子内电荷趋于中性,在体内pH条件下溶解性好,容易被小肠粘膜吸收进入血液供全身细胞需要,不损害肠胃,故生物利用率高,而无机盐中带电荷的金属离子很难通过富负电荷的肠壁内膜细胞;②具有良好的化学稳定性和热稳定性,具有抗干扰、缓解矿物质之间的拮抗竞争作用,不仅能补充锌,又能补充氨基酸;③流动性好,与其它物质易混合且稳定不变,不结块,使用安全,易于贮存;④既含氨基酸,又含锌,锌和氨基酸都具有一定的杀菌作用,具有很好的配伍性(3分,答出3点满分)(1)M→M+++2e-MCl2→M+++Cl2↑+2e-M+++2RCH(NH2)COOH→[RCH(NH2)COO]2M+2H+(各1分)(2)2H++2e-→H2↑M+++2RCH(NH2)COOH+2e-→[RCH(NH2)COO]2M+2H2↑(各1分)题(12分)背景资料:锌是人体中必需的14种微量元素之一,它不但具有重要的生物功能:影响生长发育,改善食欲及消化机能,加速创伤组织的愈合和再生,增强机体免疫功能,参与肝脏及视网膜内维生素A的代谢,保证生殖机能的正常发育,保证胆固醇与高密度脂蛋白的代谢,影响人和动物的行动和情绪,与智力发育密切相关,可防治感冒,与癌症有关,而且与人体中不下200种金属酶有关,参与多种酶的合成与组成,在核酸、蛋白质、糖、脂质代谢及RNA、DNA的合成中发挥着重要作用,与肌体的代谢及某些疾病的发生关系极为密切。因此,锌添加剂的研究一直被人们重视。无机锌盐,如ZnCO3、ZnSO4·7H2O、ZnCl2、ZnAc2等作为最早采用的补锌剂,但是由于它们易吸潮、生物吸收率低、口感不适,对胃肠道具有较大的刺激作用,个别盐甚至会引起胃出血,因而逐渐被淘汰。1.用有机弱酸作配体,比无机锌盐有较好的吸收,但由于其合成复杂,收率低,且含锌较低,不适宜于糖尿病人的补锌,它们也不是最理想的补锌剂。用的有机弱酸锌如甘草酸锌和葡萄糖酸锌等。葡萄糖酸锌常以葡萄糖酸钙、浓H2SO4、ZnO等为原料合成,请写出反应方程式;另外一种有机弱酸配体,请写出结构简式。2.氨基酸作为蛋白质的基本结构单元,在人体中有非常重要的生理作用。氨基酸锌是含有二价锌阳离子的螯合状化合物,该环一般是几元环;正是由于该结构特点,结构决定性质,所以可以预测氨基酸锌的典型优点(意思正确即可);制备氨基酸锌的一种新方法是电解合成法,该法是利用一种可选择阳离子而不渗透阴离子的特殊膜,将电解池分成阳极室和阴极室,氨基酸(RCH(NH2)COOH)作为电解液的主要成分。(1)如果阳极是由纯金属锌构成,那么在阳极室就可以形成螯合物,阳极反应可以表示为;。阴极的电极反应为。(2)氯化锌被加到阳极室,发现阴极、阳极都有气体放出,请写出电极反应为:专业知识分享\nWORD格式整理第第题(6分)A:CS2B:Na2CS3C:H2SD:CCl4E:COCl2F:SOCl2(各1分)题(6分)某液体物质A,结构与性质类似CO2,与Na2S反应生成化合物B,B遇酸能产生恶臭有毒的气体C及物质A,C可使湿醋酸铅试纸变黑。A与Cl2在MnCl2催化下可得一不能燃烧的溶剂物质D;A与氧化二氯作用则生成极毒气体E和透明液体F,试确定从A到F各代表何种物质。第第题(11分)1.Pb3O4+4HAc=2Pb(Ac)2+PbO2+H2OPbO2+3I-+4HAc=Pb(Ac)2+I3-+2H2O+2Ac-I3-+2S2O32-=S4O62-+3I-Pb(Ac)2+EDTA4-=PbEDTA2-+2Ac-(各1分)2.由于HNO3易氧化I-,H2SO4会生成PbSO4沉淀,HCl能与PbO2反应,而HAc既不会被Pb(Ⅳ)所氧化,又不会氧化后来加入的I-,同时还能避免生成PbI2沉淀(PbI2溶于HAc),所以相比之下以选择HAc最为合适。(3分)3.当溶液pH较小时,EDTA酸效应增强,导致EDTA阴离子(Y4-)浓度太小,不利PbY2-的生成,若溶液pH较大,Pb2+离子又会水解。(说明:一般来说,pH大应有利于PbY2-的生成,但当pH为7.2时,Pb2+(起始浓度0.01mol/L)开始水解,再考虑到二甲酚橙指示剂仅限于pH<6.3的溶液使用,因此选择HAc-NaAc为缓冲剂比较适宜。=(2分)4.(2分)题(11分)Pb3O4为红色粉末状固体,该物质为混合价态氧化物,化学式可写成2PbO·PbO2,如果用传统的方法测定其组成,存在很多不足。经过反复实验发现了一种连续测定法,仅用0.5h就足以完成从样品称量、溶解、滴定直至计算实验结果。实验方法如下:准确称取0.0400g~0.0500g干燥好的Pb3O4固体,置于250mL锥形瓶中。加入HAc-NaAc(1︰1)10mL,再加入0.2mol/LKI溶液1~2mL充分溶解,使溶液呈透明橙红色。加0.5mL2%淀粉溶液,用0.01mol/LNa2S2O3标准溶液滴定使溶液由蓝色刚好褪去为止,记下所用去的Na2S2O3标准溶液的体积为V(S2O32-)。再加入二甲酚橙3~4滴,用0.01mol/LEDTA标准液滴定溶液由紫红色变为亮黄色时,即为终点。记下所消耗的EDTA溶液的体积为V(EDTA)。1.请用化学方程式表示上面的化学原理:2.选择适宜的酸溶解Pb3O4是本实验的关键,请分别说明不能使用实验室三种常见无机酸的原因:3.为准确滴定Pb2+离子,选择溶液最佳酸度也是一个重要因素,请分析原因4.列出Pb3O4组成的计算式第第题(8分)1.γ-丁内脂(2分)2.相转移催化剂(1分)3.当ROH为甲醇或乙醇时,中酯基的位阻小,易被OH-皂化(水解),皂化副反应加剧,因而关环产物(3)的收率降低。(2分)4.霍夫曼重排(霍夫曼降解)(1分)5.(2分)题(8分)环丙胺是合成喹喏酮类抗菌药物环丙沙星的重要原料,文献报导的合成方法很多,最近有人提出了下述合成路线:(1)(2)(3)(5)(4)试回答下列问题:1.原料(1)的名称是什么?2.(C4H9)4N+Br-是什么催化剂?3.实验发现由(2)制备(3)时,如果ROH采用甲醇或乙醇,(3)的产率很低,你认为原因是什么?4.由(4)制备(5)涉及一个重要的人名反应,这个人名反应叫什么?5.写出(2)到(3)的反应机理。专业知识分享\nWORD格式整理第第题(15分)1.干法:=0.5941︰1.162︰0.151=1︰1.96︰0.26考虑硫化物的微量吸湿性,所以化学式为RuS2(2分)湿法:=0.4138︰0.6435︰2.076=2︰3.11︰10.03考虑到硫化物的微量吸湿性,所以化学式为Ru2S3·10H2O(2分)2.2H2[RuCl6]+4CH3--NH2+18H2O=Ru2S3·10H2O↓+4CH3COOH+4NH4Cl+S↓+8HCl(2分)3.湿法制得的硫化物含硫结果偏高,这是由于它吸附硫,未完全洗净的缘故(2分)4.干法制得的硫化物对氢作用更稳定(2分)5.有两个脱硫峰说明有两种硫化物,即为RuS·RuS2,所以氢还原过程:第一步,约200℃以前脱去结晶水;第二步,200~360℃RuS+H2→Ru+H2S;第三步,360~550℃,RuS2+2H2→Ru+2H2S(3分)6.湿法制得的硫化物的第一个脱硫峰产生的新生态钌,可能对第二个脱硫峰的脱硫过程具催化作用(2分)题(15分)钌(Ru)的硫化物可用元素合成法(下称干法)和湿法获得。干法用99.9%的纯钌粉和99.99%的硫按化学计量配料,充分混合,置于石英管中,抽真空并加热至800℃反应生成,经X-射线检定为晶态。湿法:可在六氟合钉(Ⅳ)酸溶液中,加硫代乙酰胺CH3--NH2水解沉淀生成,X射线检定为非晶态。制得的两种硫化物,在较高温度下用氢气还原,生成的H2S利用库仑滴定法进行测定,可计算出硫量,还原后得到的金属钌进行称量测定。两种方法制得的硫化物在空气中都有微吸湿性,利用失重法可计算出化合物的含水量。其实验数据如下:试样组成SRuH2O(1)干法37.26%60.06%2.73%(2)湿法20.63%41.84%37.36%1.试推断干法和湿法制得的两种硫化物的化学式。2.写出湿法制备硫化物的反应方程式(要求配平)。3.哪种方法制得的硫化物测定结果偏高?导致结果偏高的原因可能是什么?4.用氢还原钌的硫化物,每升温20℃,保温5分钟,同时库仑滴定这一期间释放的H2S量,直到无H2S逸出,化合物还原为金属钌为止。若以滴定S2-离子的时间(s)为纵坐标,温度(℃)为横坐标作图,得钌硫化物被氢还原的反应速率相对于温度的动力学曲线,如下图:据此,比较两种硫化物对氢作用的稳定性5.图中湿法制得的硫化物有两个脱硫峰,而且由第一个峰测得的硫含量大约为化合物含硫总量的1/3。据此,推测氢还原湿法制得的钌硫化物的过程。6.图中(2)的第二个脱硫峰的温度区间比(1)脱硫峰要低,其可能原因是什么?专业知识分享\nWORD格式整理第第题(10分)1.键强Ssi-O=4/4=1;2;2;八面体(六配位)(4分)2.诸配位键的键价和ΣS=5.08,结合钒配位体的构型可确定产物中的钒为5价。(3分)3.用电价规则说明P的电价数为+5,P的氧原子配位数为4,因此P-O键的键强是5/4,对于公用顶点处的O其键强和为2×(5/4)即2.5,显然超出氧的电价2甚多,因此必然导致P-O为亚稳键(3分)题(10分)在本世纪20年代末,L.Pauling在大量含氧酸盐结构资料的基础上系统总结了关于离子化合物的五个规则。这些结构规则对诸如硅酸盐结构化学规律的总结和研究起了重大的推动作用。电价规则是鲍林五个规则的核心。它可表述为:在一个稳定的离子化合物结构中,每一负离子的电价等于或近似等于从邻近的正离子至该负离子的各静电键强度的总和,即ζ==式中:ζ为负离子的电荷;Si是i种正离子至每一配位负离子的静电键强度;Si定义为ωi/νi;ωi是正离子的电荷数;νi为其配位数。这一规则的物理基础在于:如在结构中正电位较高的位置安放电价较高的负离子时,结构会趋于稳定,而某一正离子至该负离子的静电键的强度ω/ν正是有关正离子在该处所引起正电位的量度。1.化学式为Be3Al2[Si6O18]的绿柱石是含铍的矿物。结构中所有的Si4+均处于氧离子所组成的四面体空隙之中,键强Ssi-O=,根据电价规则,个Si-O键的键强和恰等于氧离子的电价数,决定了O2-可为个硅氧四面体所公用。已知绿柱石中硅氧骨干外的Be2+分别处于O2-(硅氧骨干中的非公用氧离子)所组成的四面体的空隙中。硅氧骨干中每一个非公用的O2-各与一个Si4+、Be2+、Al3+相连,根据电价规则诸静电键强之和恰等于O2-之电价。则Al3+处于O2-(硅氧骨干中的非公用氧离子)所组成的_______体的空隙中。2.以4价钒化合物VOSO4与盐酸羟胺为原料,在水溶液中以KOH调节pH≈4的条件下制得一种七配位的钒化合物[VO·(NH2O)2·(NH3O)·H2O]Cl。由晶体结构分析所得的键长算得诸键的键价如下:键V-O(1)V-O(2)V-N(2)V-O(3)V-N(3)V-O(4)V-OH2S1.8110.6390.5810.7070.5960.5260.220产物中的钒为价3.腺苷三磷酸(ATP)因其分子含有“高能键”(实为亚稳键)而在生物化学代谢过程中起着特别重要的作用。它可以通过水解反应使“高能”(即亚稳)磷酸键解离而起到能量传递的作用。已知正磷酸根PO43-中的P-O链长0.15nm,而ATP中的上述P-O键,已延伸至0.16nm,有力地佐证了此P-O亚稳键的起因。能否通过电价规则计算来证明。专业知识分享\nWORD格式整理参考答案专业知识分享\n\n\n