- 137.00 KB
- 2022-07-26 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
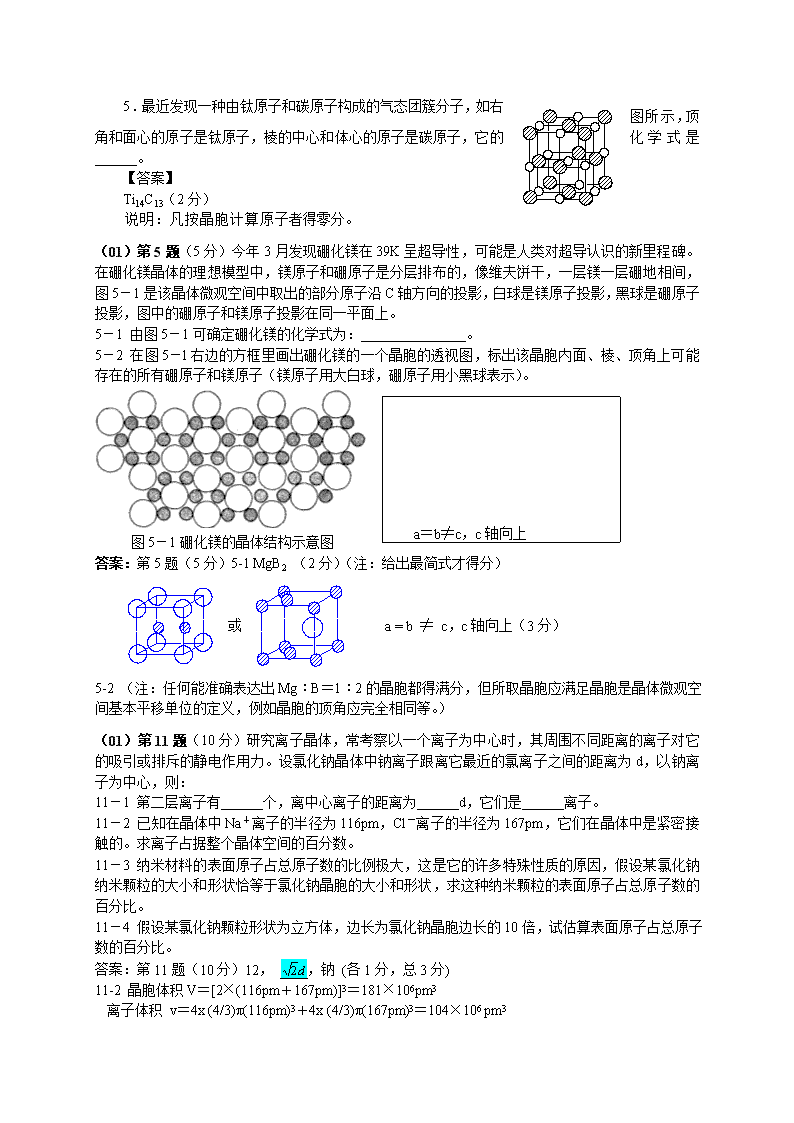
历年全国初赛有关晶体试题精选(98)5.钨酸钠Na2WO4和金属钨在隔绝空气的条件下加热得到一种具有金属光泽的、深色的、有导电性的固体,化学式NaxWO3,用X射线衍射法测得这种固体的立方晶胞的边长a=3.80×10-10m,用比重瓶法测得它的密度为d=7.36g/cm3。已知相对原子质量:W183.85,Na22.99,O16.00,阿伏加德罗常数L=6.022×1023mol-1。求这种固体的组成中的x值(2位有效数字),给出计算过程。(12分)【评析】(1)阿伏加德罗数是中学化学的一个重要概念,几乎出现在历届高考题中。阿伏加德罗数是如何测得的呢?测定已知确切化学组成和晶系的纯净晶体的密度是获得阿伏加德罗数的实验方法之一。关系式是:dVL=ZM,其中d是密度,V是一个晶胞的体积,L是阿伏加德罗数(因奥地利人劳施密特Loschmidt第一个测定了阿伏加德罗数,国际上习惯用劳施密特的第一个字母L作为阿伏加德罗数的符号),如果一个晶胞里的原子数相当于化学式表达的原子数(Z=1),该乘积就等于该物质的摩尔质量M了。如果Z不等于1,乘积dVL当然等于ZM。在这一实验方法中,d,V,M都是测定值,都会影响阿伏加德罗数的准确性。本题是这个重要实验方法的逆运算,而且也是一种获得化学组成的常规实验方法。(2)试题告诉我们NaxWO3(即钨青铜;试题可能有意不给出名称)属于立方晶系,晶胞边长a=3.80×10-10m,这等于就告诉我们晶胞体积Vcell=a3=5.49×10-29m3。试题也给了密度d和阿伏加德罗数L,因而可以得到:dVL=7.36×103kg/m3×5.49×10-29m3×6.022×1023mol-1=243g/mol然而试题并没有告诉我们Z=?,也没有告诉我们NaxWO3中的x=?这就要进行假设。这是解题的关键。命题人认为这体现一种科学方法。试题明确要求计算过程,也就是考察学生能否领悟而且表述出这个科学方法(而且对这一点给了全题1半的分值)。首先,试题告诉我们钨青铜是钨酸钠用钨还原的产物,这就告诉我们x一定大于零,小于2。若先假设为1,又假设Z=1,则得:ZM'=M(W)+3M(O)+M(Na)=254.84g/molZM'与dVL对比,说明Z=1的假设是正确的,因x的取值不会造成成倍的差别。于是就可以用dVL=M(NaxWO3)的关系式求出x,得到x=(243-183.9-48.0)/22.99=0.48(若作连续运算也可能得到0.49,试题要求2位有效数字,得到0.48或者0.49都是正确答案)。(00)4.理想的宏观单一晶体呈规则的多面体外形。多面体的面叫晶面。今有一枚MgO单晶如附图1所示。它有6个八角形晶面和8个正三角形晶面。宏观晶体的晶面是与微观晶胞中一定取向的截面对应的。已知MgO的晶体结构属NaCl型。它的单晶的八角形面对应于它的晶胞的面。请指出排列在正三角形晶面上的原子(用元素符号表示原子,至少画出6个原子,并用直线把这些原子连起,以显示它们的几何关系)。(6分)【答案】;所有原子都是Mg(3分)所有原子都是O(3分)注:画更多原子者仍应有正确几何关系;右图给出了三角形与晶胞的关系,不是答案。\n5.最近发现一种由钛原子和碳原子构成的气态团簇分子,如右图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是______。【答案】Ti14C13(2分)说明:凡按晶胞计算原子者得零分。(01)第5题(5分)今年3月发现硼化镁在39K呈超导性,可能是人类对超导认识的新里程碑。在硼化镁晶体的理想模型中,镁原子和硼原子是分层排布的,像维夫饼干,一层镁一层硼地相间,图5-1是该晶体微观空间中取出的部分原子沿C轴方向的投影,白球是镁原子投影,黑球是硼原子投影,图中的硼原子和镁原子投影在同一平面上。5-1由图5-1可确定硼化镁的化学式为:。5-2在图5-l右边的方框里画出硼化镁的一个晶胞的透视图,标出该晶胞内面、棱、顶角上可能存在的所有硼原子和镁原子(镁原子用大白球,硼原子用小黑球表示)。a=b≠c,c轴向上图5-1硼化镁的晶体结构示意图答案:第5题(5分)5-1MgB2(2分)(注:给出最简式才得分)或a=b≠c,c轴向上(3分)5-2(注:任何能准确表达出Mg︰B=1︰2的晶胞都得满分,但所取晶胞应满足晶胞是晶体微观空间基本平移单位的定义,例如晶胞的顶角应完全相同等。)(01)第11题(10分)研究离子晶体,常考察以一个离子为中心时,其周围不同距离的离子对它的吸引或排斥的静电作用力。设氯化钠晶体中钠离子跟离它最近的氯离子之间的距离为d,以钠离子为中心,则:11-1第二层离子有个,离中心离子的距离为d,它们是离子。11-2已知在晶体中Na+离子的半径为116pm,Cl-离子的半径为167pm,它们在晶体中是紧密接触的。求离子占据整个晶体空间的百分数。11-3纳米材料的表面原子占总原子数的比例极大,这是它的许多特殊性质的原因,假设某氯化钠纳米颗粒的大小和形状恰等于氯化钠晶胞的大小和形状,求这种纳米颗粒的表面原子占总原子数的百分比。11-4假设某氯化钠颗粒形状为立方体,边长为氯化钠晶胞边长的10倍,试估算表面原子占总原子数的百分比。答案:第11题(10分)12,,钠(各1分,总3分)11-2晶胞体积V=[2×(116pm+167pm)]3=181×106pm3离子体积v=4x(4/3)π(116pm)3+4x(4/3)π(167pm)3=104×106pm3\nv/V=57.5%(1分)(有效数字错误扣1分,V和v的计算结果可取4位,其中最后1位为保留数字,不扣分。)11-3表面原子为8(顶角)+6(面心)+12(棱中心)=26 总原子数为8(顶角)+6(面心)+12(棱中心)+1(体心)=27表面原子占总原子数26/27×100%=96%(1分)注:26和27均为整数值,比值26/27是循环小数0.962,取多少位小数需根据实际应用而定,本题未明确应用场合,无论应试者给出多少位数字都应按正确结果论。11-4计算分两个步骤:步骤一:计算表面原子数。可用n=2、3的晶胞聚合体建立模型,得出计算公式,用以计算n=10。例如,计算公式为:[8]+[(n-1)×12]+[n×12]+[(n-1)2×6]+[n2x6]+[(n-1)×n×2×6]顶角棱上棱交点棱上棱心面上棱交点面上面心面上棱心n=10,表面原子总数为2402(2分)步骤二:计算晶胞聚合体总原子数:n3×8+[8]×7/8+[(n-1)×12]×3/4+[n×12]×3/4+[(n-1)2×6]/2+[n2×6]/2+[(n-1)×n×2×6]/2=8000+7+81+90+243+300+540=9261(2分)表面原子占总原子数的百分数:(2402/9261)×100%=26%(1分)(总5分)(注:本题计算较复杂,若应试者用其他方法估算得出的数值在26%左右2个百分点以内可得3分,3个百分点以内可得2分,其估算公式可不同于标准答案,但其运算应无误。本题要求作估算,故标准答案仅取整数,取更多位数不扣分。)(02)第5题(13分)六配位(八面体)单核配合物MA2(NO2)2呈电中性;组成分析结果:M21.68%,N31.04%,C17.74%;配体A含氮不含氧;配体(NO2)x的两个氮氧键不等长。5-1。该配合物中心原子M是什么元素?氧化态多大?给出推论过程。5-2。画出该配合物的结构示意图,给出推理过程。5-3。指出配体(NO2)x在“自由”状态下的几何构型和氮原子的杂化轨道。5-4。除本例外,上述无机配体还可能以什么方式和中心原子配位?用图形回答问题。5-1。nM:nN=21.68/MM:31.04/14=1:(2y+2)MA=19.56x(y+1)y=2(设y为其他自然数均不合题意),得MM=58.7(g/mol)查周期表,M=Ni由配体(NO2)x的两个氮氧键不等长,推断配体为单齿配体,配位原子为O,故配体为NO2-,因此,Ni的氧化数为+2。(4分)(推理过程合理都给分,不合理,即使结果正确也扣2分。)5-2。设配合物中碳原子数为nC,则:nC:nN=17.74/12:31.04/14=0.667已知nN=2x2+2=6,所以,nC=0.677x6=4求出摩尔质量,由于剩余量过小,只能设A是氮氢化合物,由此得氢数,可推得配体A为H2NCH2CH2NH2,配合物的结构示意图为:(4分)(合理推理过程2分,结构图2分)\n5-3。(根据VSEPR理论,可预言)NO2-为角型,夹角略小于120o,N取sp2杂化轨道。(2分)5-4。(注:只要图形中原子的相对位置关系正确即可得分;画出其他合理配位结构也应得分,如氧桥结构、NO2-桥结构等)(3分)