- 145.65 KB
- 2022-07-27 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
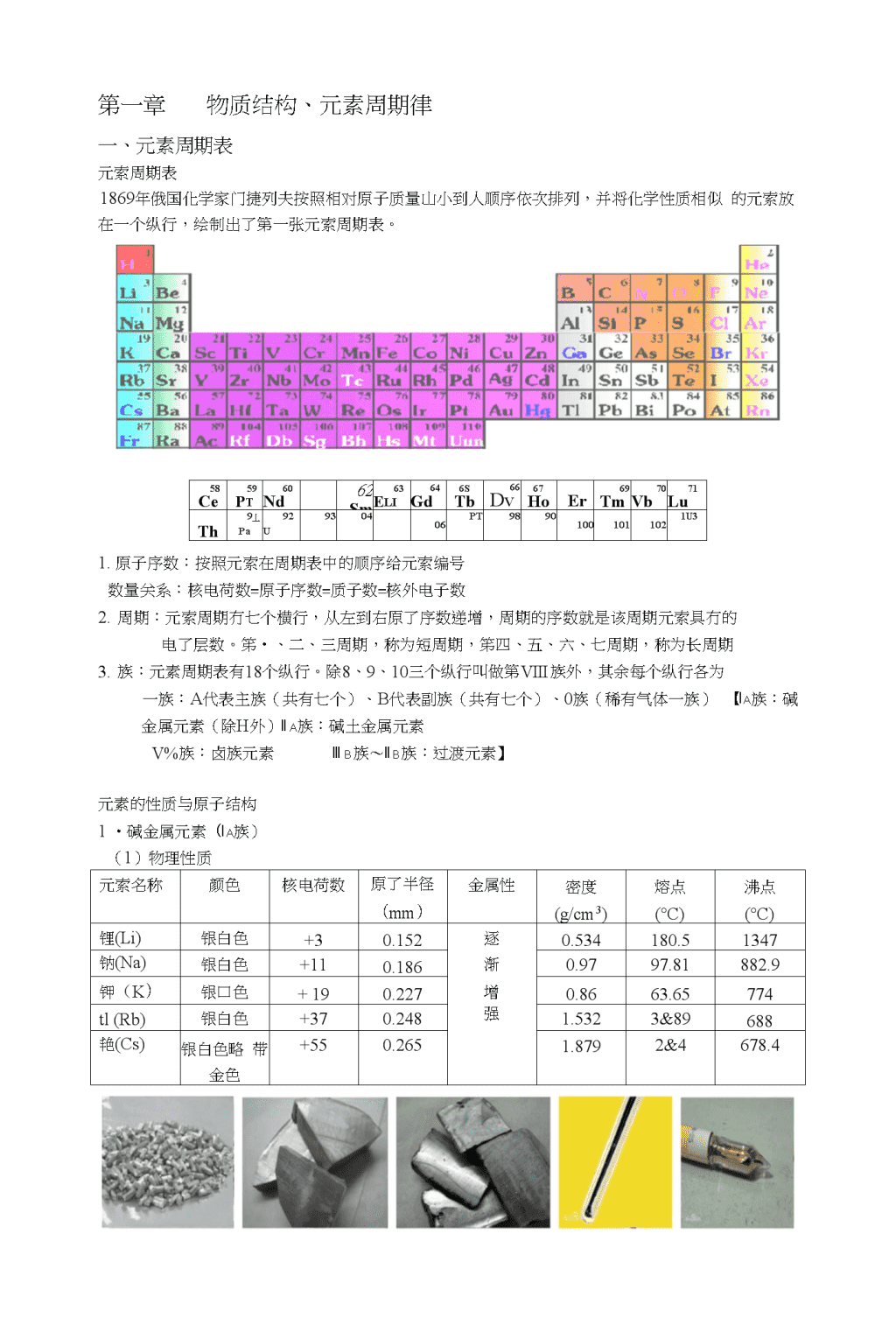
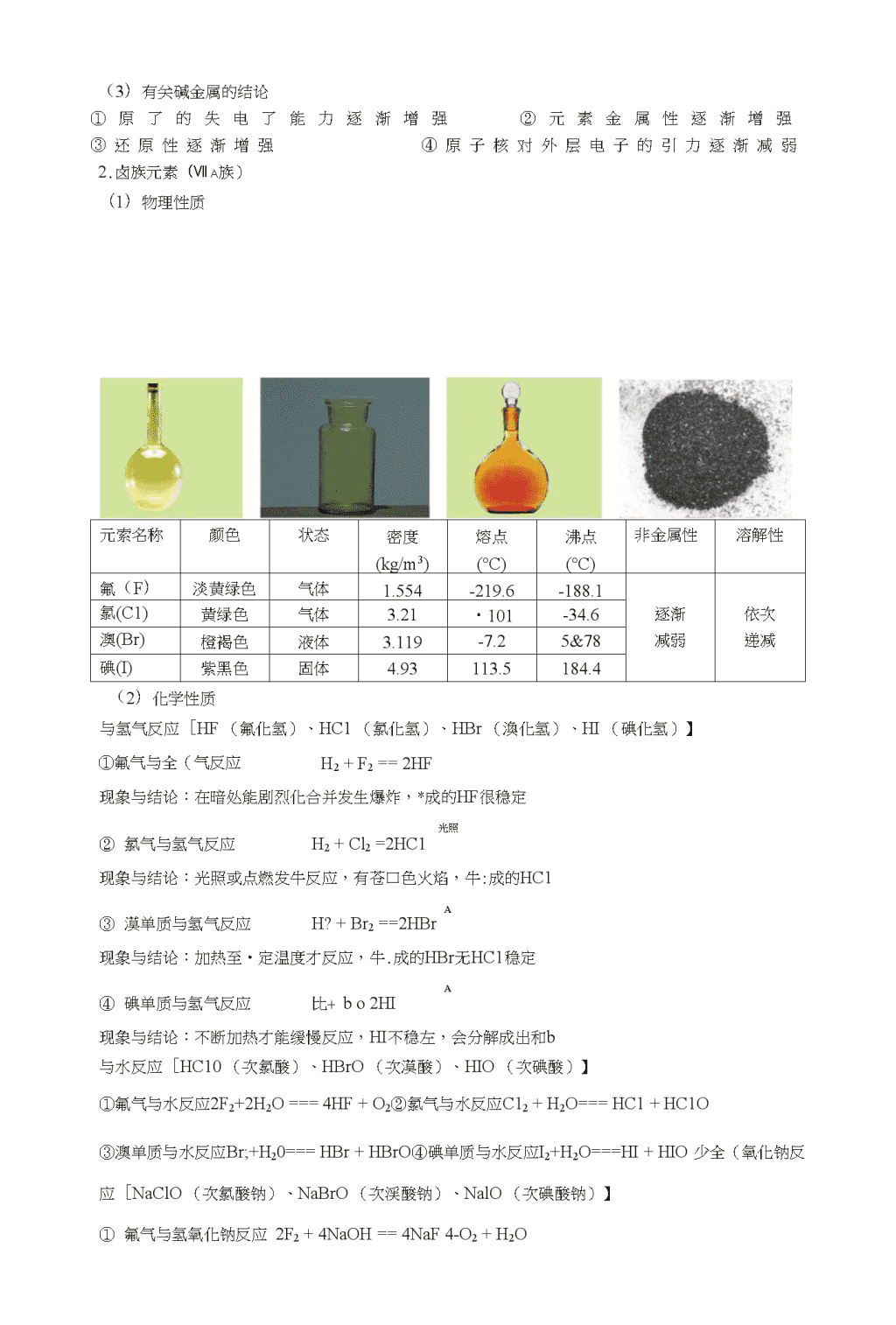
第一章物质结构、元素周期律一、元素周期表元索周期表1869年俄国化学家门捷列夫按照相对原子质量山小到人顺序依次排列,并将化学性质相似的元索放在一个纵行,绘制出了第一张元索周期表。58Ce59Pt60Nd62Sm63Eli64Gd6STb66Dv67HoEr69Tm70Vb71LuTh9丄Pa92U930406PT98901001011021U31.原子序数:按照元索在周期表中的顺序给元索编号数量关系:核电荷数=原子序数=质子数=核外电子数2.周期:元索周期冇七个横行,从左到右原了序数递增,周期的序数就是该周期元索具冇的电了层数。笫•、二、三周期,称为短周期,笫四、五、六、七周期,称为长周期3.族:元素周期表有18个纵行。除8、9、10三个纵行叫做第VIII族外,其余每个纵行各为一族:A代表主族(共有七个)、B代表副族(共有七个)、0族(稀有气体一族)【Ia族:碱金属元素(除H外)IIa族:碱土金属元素V%族:卤族元素IIIb族〜IIb族:过渡元素】元素的性质与原子结构1•碱金属元素(Ia族)(1)物理性质元索名称颜色核电荷数原了半径(mm)金属性密度(g/cm3)熔点(°C)沸点(°C)锂(Li)银白色+30.152逐0.534180.51347钠(Na)银白色+110.186渐0.9797.81882.9钾(K)银口色+190.227增0.8663.65774tl(Rb)银白色+370.248强1.5323&89688艳(Cs)银白色略带金色+550.2651.8792&4678.4\n(2)化学性质与氧气反应(反应牛•成物越來越复杂)①金属锂与氧气反应4Li+0.——2LiQ②金属钠与氧气反应A2Na+O2Na2O2③金属钾与氧气反应K+0,-一一KO.(超氧化钾)K+O3一一KO,(臭氧化钾)与卤族元素反应A.锂(Li):[LiF(氟化锂)、LiCl(氯化锂)、LiBr(漠化锂)、Lil(碘化锂)】①金属锂与氟气反应F2+2Li==2LiF②金属锂与氯气反应Cl2+2Li==2LiClAA③金属锂与漠反应Br2+2Li==2LiBr④金属锂与碘反应I2+2Li=2LiIB.钠(Na):[NaF(氟化钠)、NaCl(氯化钠)、NaBr(浪化钠)、Nal(碘化钠)】①金属钠与氟气反应AF2+2Na一―2NaF②金属钠与氯气反应CL+2Na———2NaCl③金属钠与漠反丿应AABr2+2Na=2NaBr④金属钠与碘反应I2+2Na===2NaIC.钾(K)【KF(氟化钾)、KC1(氯化钾)、浪化钾(KBr)、碘化钾(KI)】①金属钾与氟气反应F2+2K==2KF②金属钾与氯气反应C12+2K==2KC1AA③金属钾与漠反应Br2+2K==2KBr④金属钾与碘反应I?+2K==2KID.辛如【氟化¥如(RbF)、氯化帥(RbCl)、浪化钿(RbBr)、碘化钿(Rbl)]①金属伽与氟气反应F?+2Rb==2RbF②金属帥与氯气反应Cl2+2Rb==2RbClAA③金属锁1与漠反应Br2+2Rb===2RbBr④金属钏与碘反应I2+2Rb===2RbIE.艳【氟化锥(CsF)、氯化艳(CsCl)、浪化艳(CsBr)>碘化艳(CsI)]①金属艳与氟气反应E+2Cs———2CsF②金属艳与氯气反应Ck+2Cs一一2CsClAA③金属锥与漠反应Br2+2Cs==2CsBr④金属艳与碘反应I2+2Cs==2CsI与水反应(2M+2H2O==2MOH+H2f)①金属锂与水反应2Li+2H2O===2LiOH+H2T②金属钠与水反应2Na+2H2O===2NaOH+比T③金属钾与水反应2K+2H2O==2KOH+H2T④金属钏与水反应2Rb+2H2O=2RbOH+H2T⑤金属锥与水反应2Cs+2H2O==2CsOH+H2T(氢氧化链是自然界中最强的碱)\n(3)有关碱金属的结论①原了的失电了能力逐渐增强②元素金属性逐渐增强③还原性逐渐增强④原子核对外层电子的引力逐渐减弱2.卤族元素(VIIa族)(1)物理性质元索名称颜色状态密度(kg/m3)熔点(°C)沸点(°C)非金属性溶解性氟(F)淡黄绿色气体1.554-219.6-188.1氯(C1)黄绿色气体3.21・101-34.6逐渐依次澳(Br)橙褐色液体3.119-7.25&78减弱递减碘(I)紫黑色固体4.93113.5184.4(2)化学性质与氢气反应[HF(氟化氢)、HC1(氯化氢)、HBr(渙化氢)、HI(碘化氢)】①氟气与全(气反应H2+F2==2HF现象与结论:在暗处能剧烈化合并发生爆炸,*成的HF很稳定光照①氯气与氢气反应H2+Cl2=2HC1现象与结论:光照或点燃发牛反应,有苍口色火焰,牛:成的HC1A②漠单质与氢气反应H?+Br2==2HBr现象与结论:加热至•定温度才反应,牛.成的HBr无HC1稳定A③碘单质与氢气反应比+bo2HI现象与结论:不断加热才能缓慢反应,HI不稳左,会分解成出和b与水反应[HC10(次氯酸)、HBrO(次漠酸)、HIO(次碘酸)】①氟气与水反应2F2+2H2O===4HF+O2②氯气与水反应C12+H2O===HC1+HC1O③澳单质与水反应Br;+H20===HBr+HBrO④碘单质与水反应I2+H2O===HI+HIO少全(氧化钠反应[NaClO(次氯酸钠)、NaBrO(次渓酸钠)、NalO(次碘酸钠)】①氟气与氢氧化钠反应2F2+4NaOH==4NaF4-O2+H2O\n①氯气与氢氧化钠反应Cl2+2NaOH===NaCl+NaClO+H20②漠单质与氢氧化钠反应B&+2NaOH==NaBr+NaBrO+H2O③碘单质少氢氧化钠反应I2+2NaOH===Nal+NalO+H2O\n(3)有关卤族元素的结论①最外层有7个电子,电子层数逐渐增加②单质有强氧化性,颜色逐渐加深③非金属性逐渐减弱④生成的酸越来越不稳定,酸性反阳越来越强3.核素(1)把具有一定数目质子和一定数目中子的一种原子【;H;H:H】(各为一种)(2)同位素:质子数相同,屮子数不同的同一•元素的不同原了【;H;H:H】(为H同位素)同位索的川途:有些同位索屮,具有放射性,称为放射性同位索【用于考古的叫C;2]H、\h可以制氢弹】(3)原子核的构成z(质子(Z)个电子数:Z+n或Z・n原了核[质量数(A)=质了数(Z)+屮了数(N)原子1I中子(A・Z)个=相对近似原了质赧核外电子数(Z)个(4)同素界形体:相同的元素,不同的单质【02少。3、C-Uc6o](5)核素表示方法apc+b入da:质量数b:质子数(=核电荷数)c:离子所带的电荷数d:原子个数二、元素周期律核外屯子的排布