- 1.32 MB
- 2022-07-27 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
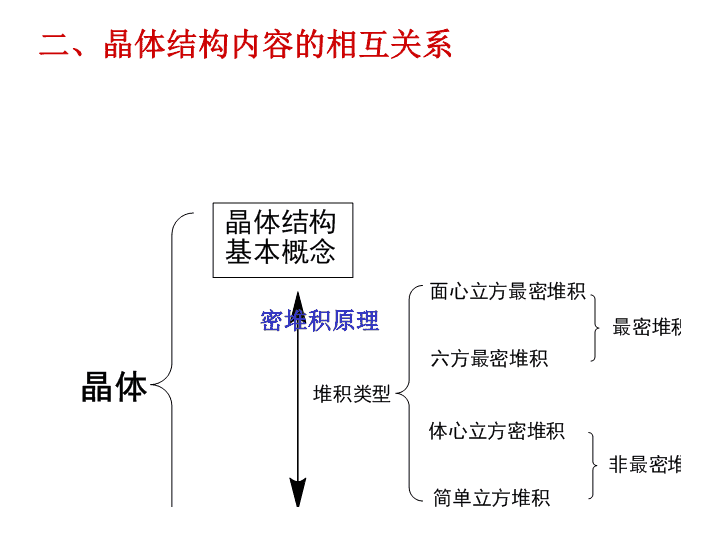
高中化学选修3-晶体单元复习\n二、晶体结构内容的相互关系密堆积原理\n作用形式与空间排布——堆积1、无明确取向的作用(无方向、无次序,球密堆积)金属键—金属晶体。分子间作用力(弱极性分子)—分子晶体。2、有一定取向的作用离子键(无方向、有次序)—离子晶体—球堆积(离子半径制约下的密堆积倾向)。分子间作用力(强极性分子)—分子晶体—有一定作用取向。3、有明确取向的作用(非密堆积)共价键—原子晶体—键取向氢键—分子晶体—作用取向\n图2填充全部四面体空隙\n离子晶体(NaCl)金属氢键晶体(硼酸)共价键晶体(锑化銦)分子晶体(固态氩)混合键晶体(石墨)各种晶体类型示意图\n2.依据组成晶体的粒子和粒子间的作用3.依据晶体的物理性质判断:熔沸点、导电性、硬度、机械性能1.依据物质的组成判断:元素种类三、晶体类型的判断\n1、常温下的状态:熔点:固体>液体沸点:液体>气体2、若晶体类型不同,一般情况下:原子晶体>离子晶体>分子晶体3、若晶体类型相同:构成晶体微粒间的作用越大,则熔沸点高。四、物质熔沸点与晶体类型的关系\n⑴离子晶体:比较离子键的强弱。结构相似时,离子半径越小,离子电荷越高,晶格能越大,离子键就越强,熔点就越高。如熔点:MgO>NaCl⑵金属晶体:比较金属键的强弱。金属离子半径越小,离子电荷越高,金属键就越强,熔沸点就越高。合金的熔沸点比它的各成分金属的熔点低。如:Li、Na、Rb、Cs、Fr,其熔沸点逐渐降低。\n⑶原子晶体:比较共价键的强弱。结构相似时,原子半径越小,共价键键长越短,键能越大,熔点越高。如熔点:金刚石>碳化硅>晶体硅。⑷分子晶体:A、存在氢键时,熔沸点反常的高,HF>HCl,NH3>PH3,H2O>H2Te>H2Se>H2SB、不含氢键时,比较范德华力大小。相对分子质量越大,分子间作用力就越强,熔沸点就越高。HI>HBr>HClC、在烷烃的同分异构体中,一般来说,支链数越多,熔沸点越低。如沸点:正戊烷>异戊烷>新戊烷;D、芳香烃及其衍生物苯环上的同分异构体一般按照“邻位>间位>对位”的顺序依次降低。\n1、下列物质中,化学式能准确表示该物质分子组成的是A.NH4ClB.SiO2C.P4D.Na2SO42、关于晶体的下列说法正确的是()
A.在晶体中只要有阴离子就一定有阳离子B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高 D.分子晶体的熔点一定比金属晶体的低A\n3、HgCl2的稀溶液可用做手术刀的消毒剂,已知HgCl2的熔点是277℃,熔融状态的HgCl2不能导电,且稀溶液有弱的导电能力,则下列叙述中正确的是()A、HgCl2属于共价化合物B、HgCl2属于离子化合物C、HgCl2属于非电解质D、HgCl2属于弱电解质AD4、有关晶体的叙述中正确的是()A、在二氧化硅晶体中,由硅氧原子构成的最小环中共有8个原子B、在12克金刚石中含C—C键的数目为4NAC、干冰晶体熔化只需要克服分子间作用力D、金属晶体是由金属原子直接构成的C\n5、(08全国1)下列化合物,按其晶体的熔点由高到低排列正确的是()A.SiO2、CsCl、CBr4、CF4B.SiO2、CsCl、CF4、CBr4C.CsCl、SiO2、CBr4、CF4D.CF4、CBr4、CsCl、SiO2A\n五、晶体密度计算晶体结构的基本重复单位是晶胞,只要将一个晶胞的结构剖析透彻,整个晶体结构也就掌握了。利用晶胞参数可计算晶胞体积(V),根据相对分子质量(M)、晶胞中分子数(Z)和Avogadro常数NA,可计算晶体的密度:\n1、空间利用率:指构成晶体的微粒在整个晶体空间中所占有的体积百分比。球体积空间利用率=100%晶胞体积六、金属晶体空间利用率的计算(1)计算晶胞中的微粒数(2)计算晶胞的体积2、晶体中原子空间利用率的计算步骤:\n(1)晶格边长a与原子半径r边长为a边长为a斜边长为a\n边长为a斜边长为a=4r边长为a晶格边长a与原子半径r\n(2)晶格边长a与原子半径r边长为a对角边长为a=4r斜边长为a\n\n(一)简单立方:=52.36%空间利用率:4πr3/3微粒数为:8×1/8=1(2r)3\n(二)体心立方(A2-钾型):1个晶胞所含微粒数:8×1/8+1=2\n\n(三)面心立方(A1-铜型):属于1个晶胞微粒数为:8×1/8+6×1/2=4aa4R\naa4R面心\n(四)六方(A3-锌型):属于1个晶胞微粒数为:8×1/8+1×1=2\n在镁型堆积中取出六方晶胞,平行六面体的底是平行四边形,各边长a=2r,则平行四边形的面积先求S\n再求h平行六面体的高:\n\n2Rc/22R30°ac素材\n堆积方式晶胞类型空间利用率配位数实例面心立方最密堆积堆积方式小结简单立方堆积体心立方密堆积六方最密堆积面心立方六方体心立方简单立方74%74%68%52%121286Cu、Ag、AuMg、Zn、TiNa、K、FePo\n在离子晶体中,常见的有四种结构类型:NaCl型CsCl型ZnS型CaF2型岩盐氯化铯闪锌矿萤石七、几何因素对离子晶体结构的影响\n+++++不稳定a)同号阴离子相切,异号离子相离。+---++++-b)同号离子相离,异号离子相切。稳定\nc)同号阴离子相切,异号离子相切。----+++++介稳状态\nr+/r-与配位数从六配位的介稳状态出发,探讨半径比与配位数之间的关系。ABCD+++ADCB+1、NaCl型:下图所示,六配位的介稳状态的中间一层的俯视图。ADBC是正方形。\n∴此时,为介稳状态,如见前面的图。AC=BC=2r-∵∴△ABC是等腰直角三角形∴AB2=AC2+BC2AB=2r++2r-∵+++ADCB+\n如果r+再大些:则出现右图(b)种情况,即离子同号相离,异号相切的稳定状态。+---++++-结论:时,配位数为6,能够存在。\n2、CsCl型理想CsCl型晶体的离子堆积从八配位的介稳状态出发,探讨半径比与配位数之间的关系。\nABCD1若设,AC=BD=1,则有:AB=CD=阳离子与阴离子的半径比为:且AD=BC=CDBA\n当r+继续增加,达到并超过时,即阳离子周围可容纳更多阴离子时,为8配位。结论为0.414——0.732,6配位NaCl型晶体结构。若r+变小,当则出现a)种情况,如右图。阴离子相切阴离子阳离子相离的不稳定状态。配位数将变成4。+++++\n3、ZnS型\n\n0.225—0.4144:4ZnS型晶体结构0.414—0.7326:6NaCl型晶体结构0.732—1.0008:8CsCl型晶体结构总之,配位数与r+/r-之比相关:NaCl型ZnS型CsCl型\n若r+再增大,可达到12配位;r+再减小,则形成3配位。这就是半径比规则,用半径比规则可以判断离子晶体的空间结构类型。\n晶体结构复习\n此课件下载可自行编辑修改,仅供参考!
感谢您的支持,我们努力做得更好!谢谢