- 384.50 KB
- 2022-07-28 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
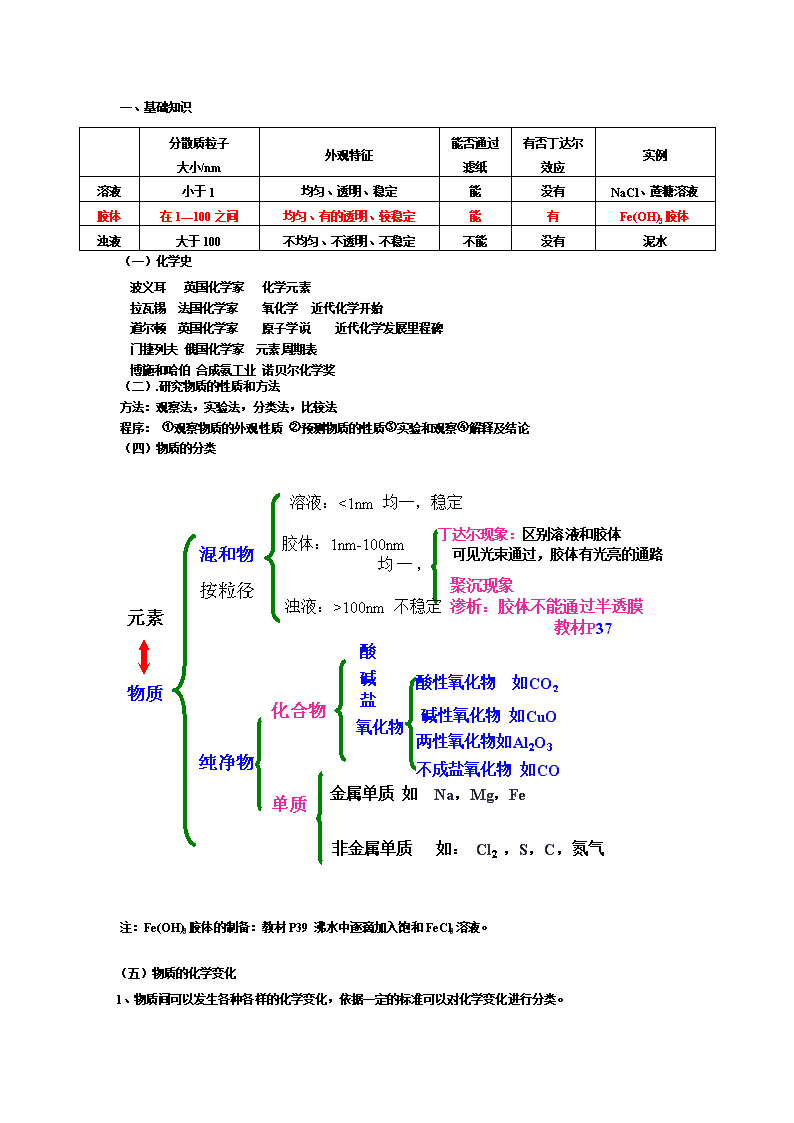
一、基础知识(一)化学史波义耳英国化学家化学元素拉瓦锡法国化学家氧化学近代化学开始道尔顿英国化学家原子学说近代化学发展里程碑门捷列夫俄国化学家元素周期表博施和哈伯合成氨工业诺贝尔化学奖(二).研究物质的性质和方法方法:观察法,实验法,分类法,比较法程序:①观察物质的外观性质②预测物质的性质③实验和观察④解释及结论(四)物质的分类丁达尔现象:区别溶液和胶体可见光束通过,胶体有光亮的通路物质混和物纯净物化合物单质金属单质如Na,Mg,Fe酸碱盐渗析:胶体不能通过半透膜教材P37元素溶液:<1nm均一,稳定胶体:1nm-100nm均一,较稳定浊液:>100nm不稳定按粒径大小聚沉现象非金属单质如:Cl2,S,C,氮气氧化物两性氧化物如Al2O3碱性氧化物如CuO不成盐氧化物如CO酸性氧化物如CO2分散质粒子大小/nm外观特征能否通过滤纸有否丁达尔效应实例溶液小于1均匀、透明、稳定能没有NaCl、蔗糖溶液胶体在1—100之间均匀、有的透明、较稳定能有Fe(OH)3胶体浊液大于100不均匀、不透明、不稳定不能没有泥水注:Fe(OH)3胶体的制备:教材P39沸水中逐滴加入饱和FeCl3溶液。(五)物质的化学变化1、物质间可以发生各种各样的化学变化,依据一定的标准可以对化学变化进行分类。\n(1)根据反应物和生成物的类别以及反应前后物质种类的多少可以分为:A、化合反应(A+B=AB)B、分解反应(AB=A+B)C、置换反应(A+BC=AC+B)D、复分解反应(AB+CD=AD+CB)(2)根据反应中是否有离子参加可将反应分为:A、离子反应:有离子参加的一类反应。主要包括复分解反应和有离子参加的氧化还原反应。B、分子反应(非离子反应)(3)根据反应中是否有电子转移可将反应分为:A、氧化还原反应:反应中有电子转移(得失或偏移)的反应实质:有电子转移(得失或偏移)特征:反应前后元素的化合价有变化B、非氧化还原反应2、离子反应(1)电解质:在水溶液中或熔化状态下能导电的化合物,叫电解质。酸、碱、盐都是电解质。在水溶液中或熔化状态下都不能导电的化合物,叫非电解质。注意:①电解质、非电解质都是化合物,不同之处是在水溶液中或融化状态下能否导电。②电解质的导电是有条件的:电解质必须在水溶液中或熔化状态下才能导电。③能导电的物质并不全部是电解质:如铜、铝、石墨等。④非金属氧化物(SO2、SO3、CO2)、大部分的有机物为非电解质。物质分类的另一种方法:(2)离子方程式:书写方法:写,拆,删,查(3)离子共存问题所谓离子在同一溶液中能大量共存,就是指离子之间不发生任何反应;若离子之间能发生反应,则不能大量共存。A、结合生成难溶物质的离子不能大量共存:如Ba2+和SO42-、Ag+和Cl-、Ca2+和CO32-、Mg2+和OH-等B、结合生成气体或易挥发性物质的离子不能大量共存:如H+和CO32-,HCO3-,SO32-,OH-和NH4+等C、结合生成难电离物质(水)的离子不能大量共存:如H+和OH-、CH3COO-,OH-和HCO3-等。D、发生氧化还原反应、水解反应的离子不能大量共存(如:Fe2+和H+,NO3-)注意:题干中的条件:如无色溶液应排除有色离子:Fe2+、Fe3+、Cu2+、MnO4-等离子,酸性(或碱性)则应考虑所给离子组外,还有大量的H+(或OH-)。(4)离子方程式正误判断(六看)看反应是否符合事实:主要看反应能否进行或反应产物是否正确看能否写出离子方程式:纯固体之间的反应不能写离子方程式看化学用语是否正确:化学式、离子符号、沉淀、气体符号、等号等的书写是否符合事实看离子配比是否正确\n看原子个数、电荷数是否守恒看与量有关的反应表达式是否正确(过量、适量)3、氧化还原反应中概念及其相互关系如下:失去电子——化合价升高——被氧化(发生氧化反应)——是还原剂(有还原性)还原剂,升失氧得到电子——化合价降低——被还原(发生还原反应)——是氧化剂(有氧化性)氧化剂,降得还常见的氧化剂:(1)非金属单质X2、O2、S等;(2)高价金属阳离子Cu2+、Fe3+;高价或较高价含氧化合物H2SO4(浓)、MnO2、HClO、KMnO4、K2Cr2O7、HNO3、HClO3等。常见的还原剂:(1)活泼或较活泼的金属K、Na、Mg、Al、Zn、Fe等;(2)低价金属阳离子Fe2+;(3)非金属阴离子Cl-、Br-、I-、S2-等;(4)含较低价元素的化合物CO、SO2、H2SO3、Na2SO3、NH3等二、化学计算(一)物质的量的单位――摩尔1.物质的量(n)是表示含有一定数目粒子的集体的物理量。2.摩尔(mol):把含有6.02×1023个粒子的任何粒子集体计量为1摩尔。3.阿伏加德罗常数:把6.02X1023mol-1叫作阿伏加德罗常数。4.物质的量=物质所含微粒数目/阿伏加德罗常数n=N/NA5.摩尔质量(M)(1)定义:单位物质的量的物质所具有的质量叫摩尔质量.(2)单位:g/mol或g..mol-1(3)数值:等于该粒子的相对原子质量或相对分子质量.6.物质的量=物质的质量/摩尔质量(n=m/M)(二)气体摩尔体积1.气体摩尔体积(Vm)(1)定义:单位物质的量的气体所占的体积叫做气体摩尔体积.(2)单位:L/mol2.物质的量=气体的体积/气体摩尔体积n=V/Vm3.标准状况下,气体的Vm=22.4L/mol4.阿伏伽德罗定律:在相同的温同和压强下,相同体积何气体都含有相同数目的分子数。推论:对于任何气体在同温同压下气体体积V与物质的量n之间的关系为:V1:V2=n1:n2即体积的比等于物质的量的比例题:期末复习提纲22题(三)物质的量浓度.1定义:以单位体积溶液里所含溶质B的物质的量来表示溶液组成的物理量,叫做溶质B的物质的浓度。2单位:mol/L3物质的量浓度=溶质的物质的量/溶液的体积CB=nB/V\n稀释公式:C1V1=C2V2物质的量浓度与质量分数的互换公式:(四)多步反应的一步计算用含FeS284%的硫铁矿生产硫酸.硫铁矿煅烧时有4%的硫元素损失而混入炉渣,SO2转化为SO3的转化率为95%,SO3的吸收率为98.5%,求2吨硫铁矿可生产98%的浓H2SO4多少吨?解析:SO2的转化率和SO3的吸收率(即转化率)均可累积到FeS2上,硫元素的利用率就是FeS2的转化率,利用下列关系式计算:设生产98%的H2SO4质量为x。FeS2~2H2SO41202×982吨×84%×(1-4%)×95%×98.5%98%x答案:2吨硫铁矿可生产98%的浓H2SO42.52吨。(五)守恒问题1.元素守恒(铜和硝酸反应中的氮守恒)2.得失电子守恒(步步高P127最后一题)三、元素与化合物知识金属(一)钠1.物理性质:钠的物理性质:银白色金属光泽,硬度较小(质软),熔、沸点较低,热和电的良导体,密度比水小2.化学性质:(1)与氧气反应常温:4Na+O2==2Na2O(白色固体,不稳定)加热:2Na+O2===Na2O2(淡黄色固体,较稳定)(2)钠与水反应(浮,熔,游,响,红)2Na+2H2O=2NaOH+H2↑主要实验现象对实验现象的分析 \n(3)钠和酸反应:实际上是钠和H+反应2Na+2HCl=2NaCl+H2↑离子反应方程式:2Na+2H+==2Na++H2↑(4)钠和盐溶液先和水反应,生成的NaOH,再与盐反应钠和硫酸铜反应2Na+2H2O==2NaOH+H2↑2NaOH+CuSO4==Cu(OH)2↓+Na2SO4小结:钠化学性质活泼,具有很强的还原性保存在煤油中氧化钠和过氧化钠的比较名称(二)铁铁矿黄铁矿(主要成分:FeS2)赤铁矿(主要成分:Fe2O3)磁铁矿(主要成分:Fe3O4)1、铁元素的存在形态:游离态:陨铁化合态:铁元素主要以+2价和+3价的化合态存在。在地壳中的质量分数为4.65%,处于第四位,仅次于氧、硅和铝。2、按不同标准给铁及其化合物分类(1)按单质、氧化物、酸、碱、盐给上述物质分类。单质:铁;氧化物:FeO、Fe2O3、Fe3O4;碱:Fe(OH)2、Fe(OH)3;盐:FeCl2、FeCl3、FeSO4、Fe2(SO4)3(2)按铁元素的化合价给上述物质分类。0价:Fe;+2价:FeO、FeCl2、FeSO4、Fe(OH)2;+3价:Fe2O3、FeCl3、Fe2(SO4)3、Fe(OH)33、铁在氧化物——FeO、Fe2O3、Fe3O4性质的比较FeOFe2O3Fe3O4\n俗名——铁红磁性氧化铁色态黑色粉末红棕色粉末黑色晶体水溶性难溶难溶难溶化合价+2+3+2、+3与COFeO+CO==Fe+CO2Fe2O3+3CO==2Fe+3CO2Fe3O4+4CO==3Fe+4CO24.铁的氢氧化物——Fe(OH)2和Fe(OH)3性质的比较(1)氢氧化亚铁:制备:FeCl2+2NaOH=Fe(OH)2↓+2NaCl物理性质:白色难溶的弱碱化学性质:①与强酸反应②还原性:易被氧化剂所氧化。如:4Fe(OH)2+O2+2H2O=4Fe(OH)3思考:实验室在制备Fe(OH)2时,为防止被氧化,可以采取哪些措施?提示:实验室制备氢氧化亚铁时,因氢氧化亚铁在空气中极易与氧气、水反应生成氢氧化铁,更要注意隔绝空气。其方法是:①亚铁盐需新制(用足量铁与稀硫酸反应或还原氯化铁溶液);②将所用氢氧化钠溶液煮沸以赶尽溶于其中的空气(O2);③使用长滴管吸入氢氧化钠溶液后将滴管伸至氯化亚铁溶液的液面以下,慢慢挤压乳胶头使氢氧化钠与氯化亚铁接触。(2)氢氧化铁:制备:FeCl3+3NaOH=Fe(OH)3↓+3NaCl物理性质:红褐色难溶固体化学性质:与强酸反应。Fe(OH)3+3H2SO4=Fe2(SO4)3+3H2O5、探究铁及其化合物的氧化性和还原性预测:铁元素显0价时,只有还原性;显+3价时,只有氧化性;显+2价时,既有氧化性,又有还原性。(1)Fe的还原性:与H+、Cu2+、Fe3+、Cl2等反应Fe+2H+=Fe2++H2↑、Fe+Cu2+=Fe2++Cu、2Fe3++Fe=3Fe2+、2Fe+3Cl22FeCl3(2)Fe3+的氧化性:与Fe、Cu、Zn反应2Fe3++Fe=3Fe2+、2Fe3++Cu=2Fe2++Cu2+、3Zn+2Fe3+=3Zn2++2Fe(3)Fe2+的氧化性:与锌反应Zn+Fe2+=Zn2++Fe(4)Fe2+的还原性:与氯水等反应2Fe2++Cl2=2Fe3+=2Cl-(5)铁及其化合物的相互转化示意图Fe2+与Fe3+的鉴别\n(1)直接观察颜色:Fe2+的溶液呈浅绿色,Fe3+的溶液呈棕黄色。(2)利用显色反应:Fe2+的溶液+KSCN溶液,溶液不呈红色;Fe3+的溶液+KSCN溶液,溶液呈血红色。有关离子方程式:Fe3++3SCN-=Fe(SCN)3(3)利用铁化合物沉淀的颜色:Fe2+的溶液+NaOH溶液,出现白色沉淀,迅速变为灰绿色,最后变为红褐色;Fe3+的溶液+NaOH溶液,出现红褐色沉淀。有关反应式:Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+2H2O+O2=4Fe(OH)3;Fe3++3OH-=Fe(OH)3↓(4)利用Fe3+的氧化性:①Fe2+的溶液+Cu片,无明显现象;Fe3+的溶液+Cu片,铜被腐蚀,溶液变为蓝绿色。有关离子方程式:2Fe3++Cu=2Fe2+=Cu2+②Fe2+的溶液+淀粉KI试纸,试纸不变蓝;Fe3+的溶液+淀粉KI试纸,试纸变蓝。有关离子方程式:2Fe3++2I-=2Fe2++I2(5)利用Fe2+的还原性:①Fe2+的溶液+酸性KMnO4溶液,KMnO4溶液紫色褪去;Fe3+的溶液+酸性KMnO4溶液,KMnO4溶液紫色不褪。②Fe2+的溶液+氯水,溶液变为棕黄色;Fe3+的溶液+氯水,无明显现象。有关离子反应式:2Fe2++Cl2=2Fe3++2Cl-(三)镁1海水提镁的方法:①碱的制取:CaCO3CaO+CO2↑;CaO+H2O=Ca(OH)2(使用贝壳,提供碱)②Mg2+的浓缩:Mg2++2OH-=Mg(OH)2↓;Mg(OH)2+2H+=Mg2++2H2O③Mg的制取:MgCl2Mg+Cl2↑(2)镁的性质①物理性质:镁是一种银白色金属,密度小于水,熔点较低,硬度较小,有良好的导电、导热性和延展性,与其他金属易构成性能优良的合金。②化学性质与非金属单质反应:2Mg+O22MgO、3Mg+N2Mg3N2、Mg+Cl2MgCl2与酸反应:与非氧化性酸反应:Mg+2H+=Mg2++H2↑与氧化性酸反应,但不生成氢气:Mg+2H2SO4(浓)=MgSO4+SO2↑+2H2O与某些氧化物反应:2Mg+CO22MgO+C非金属(一)氯气,溴和碘氯气1、Cl2的物理性质在通常情况下,氯气为黄绿色气体,有刺激性气味的有毒气体.易液化,能溶于水(1∶2),氯水颜色呈淡黄色。闻Cl2时:应距Cl2一尺左右,用手轻轻扇一下集气瓶口上方空气,让少量的Cl2进入鼻孔。\n2、Cl2的化学性质(1)与金属反应2Na+Cl22NaCl(白烟);Cu+Cl2CuCl2(棕黄色烟,加少量水显绿色,冲稀后变蓝色);2Fe+3Cl22FeCl3(棕红色烟,加少量水显棕黄色)(2)与非金属反应H2+Cl22HCl(仓白色火焰,白雾)。纯净的H2可在Cl2中燃烧,发出苍白色火焰。HCl(溶解度1∶500)溶于水成为盐酸.(3)与水反应:Cl2+H2O=HCl+HClO说明:氯气的水溶液称为氯水,由于氯气不是简单的溶于水,而是与水反应,氯水的成分和性质较为复杂。氯水的主要成分有氯气、盐酸、次氯酸等,氯水也兼具有这几种物质的性质。如次氯酸具有漂白性,氯水也具有漂白性。(4)与碱反应:Cl2+2NaOH=NaClO+NaCl+H2O(该反应可用于Cl2的尾气处理);工业上用Cl2与石灰乳作用制漂白粉:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O漂白粉就是利用氯气与氢氧化钙反应制成的。漂白粉的主要成分是CaCl2和Ca(ClO)2,有效成分是Ca(ClO)2漂白粉的漂白原理:Ca(ClO)2+H2O+CO2=CaCO3↓+2HClO;起漂白杀菌作用的是HClO。该反应也说明了碳酸(CO2+H2O)的酸性强于次氯酸,反应原理是强酸制取弱酸。次氯酸的性质:(5)与盐溶液的置换反应:Cl2+2NaI=2NaCl+I2(该反应常用作Cl2的检验);Cl2+2NaBr=2NaCl+Br2氯水性质实验实验内容实验现象结论 氯水中滴入AgNO3溶液 生成白色沉淀不溶于稀硝酸 氯水中存在Cl- 氯水中加入石蕊溶液 溶液先变红后褪色 溶液呈酸性,同时溶液存在具有漂白性 氯气漂白性实验 干燥的红纸条不褪色,湿润的红纸条褪色。 漂白作用是由于氯气与水生成的HClO氯水、久置氯水、液氯成分比较: 新制氯水久置氯水液氯类别 混合物 混合物 纯净物微粒 H2O、Cl2HClO、H+、Cl—、ClO—、OH- H2O、H+Cl—,OH- Cl2主要性质 呈浅黄绿色,具有酸性,有氧化性、漂白性,酸性 无色,有酸性 黄绿色,具有氧化性保存 棕色瓶盛放于阴暗处,不宜久置 (6)氯碱工业(1)概念:工业上用电解饱和食盐水的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业。(2)原料:饱和食盐水\n(3)原理:2NaCl+2H2O2NaOH+Cl2↑+H2↑溴和碘(1)溴称为海洋元素(2)溴单质和碘单质的物理性质溴在常温下为红棕色液体(惟一的液态非金属单质),极易挥发产生红棕色有毒的溴蒸气;碘是紫黑色固体,具有金属光泽,易升华(常用于分离提纯碘)。二者在水中溶解度都较小,都易溶于酒精等有机溶剂。物理性质溴单质碘单质颜色深红棕色紫黑色状态液体固体溶解性和溶液颜色水中可溶;橙黄色难溶;黄褐色酒精中易溶;橙红色易溶;褐色四氯化碳中易溶;橙红色易溶;紫红色②萃取:利用混合物中一种溶质在互不相溶的溶剂里溶解度的不同,用一种溶剂把溶质从它与另一溶剂所组成的溶液中提取出来的分离方法叫萃取,萃取所用的仪器是分液漏斗。(3)氯、溴、碘单质氧化性的强弱:氯、溴、碘的氧化性:Cl2>Br2>I2;还原性:Cl-Br2>I2;还原性:Cl-