- 638.98 KB
- 2022-07-28 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
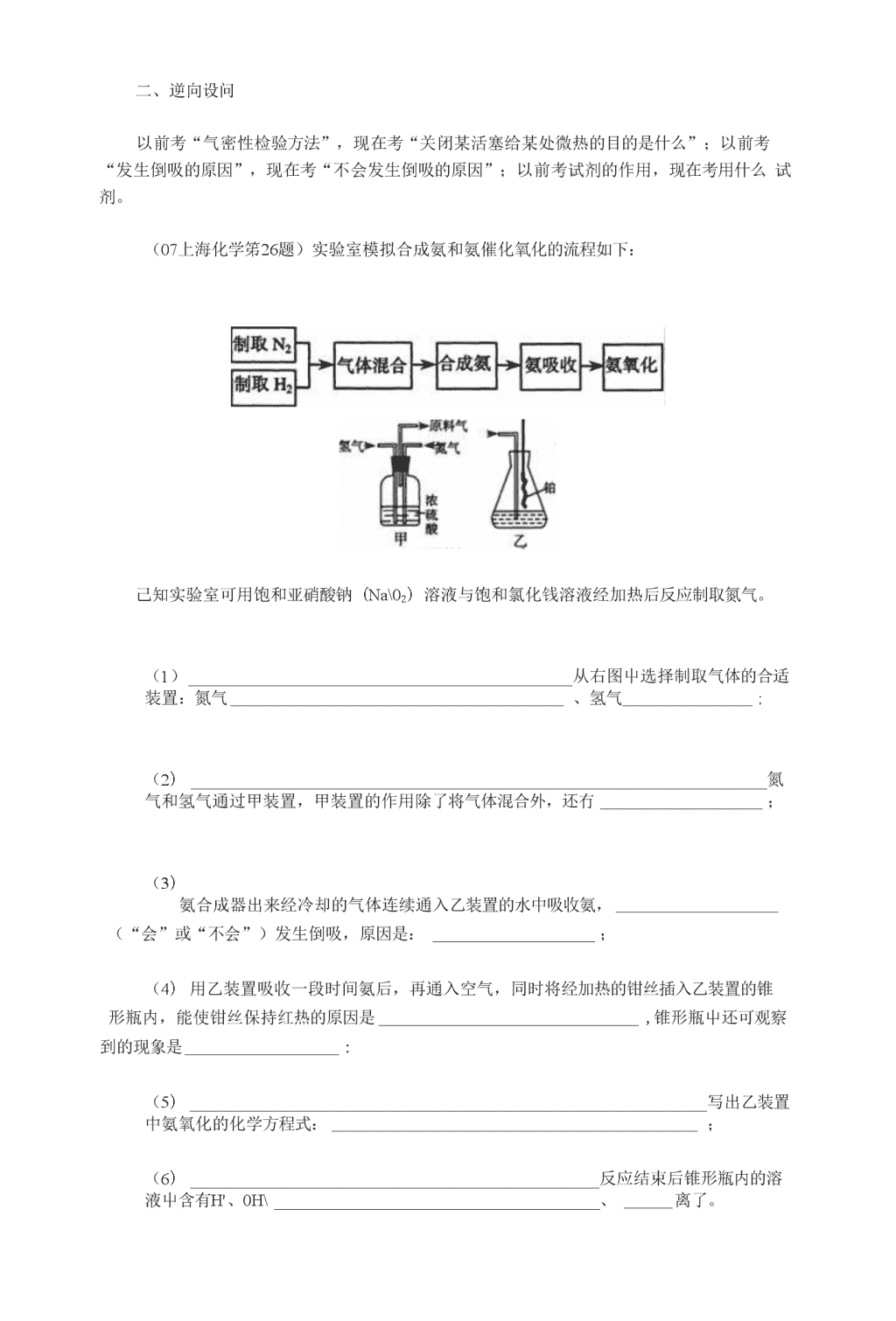
高中化学复习资料和对策高考化学实验题分析及2009年实验复习对策(湖南省城步一中夏淸国肖双刚)仔细分析2007年高考化学实验题的特点,研究2008年高考复习的对策,预测2008年高考化学实验题的趋势,对2008年的高考无疑是冇好处的,笔者就冇关07年化学实验题的特点和08年的复习对策综述如下,以期抛砖引玉。一、从书本实验取材,注重对课本实验的延伸、拓展、综合等改造方案反应物Cu、浓IIKQ乙Cu、稀叽丙Clk0:八稀HNOs实验,以探究化学实验的绿色化。a(07重庆理综笫27题)某兴趣小组设计出右图所示装置來改进教材中“铜与硝酸反应”Cr(1)实验前,关闭活塞b,试管d中加水至浸没长导管口,塞紧试管C和d的胶塞,加热C。其目的是o(2)在d中加适量NaOH溶液,c中放一小块铜片,由分液漏斗a向c中加入2mL浓硝酸。c中反应的化学方程式是。再由a向c中加2mL蒸啊水,c中的实验现象是o(3)上表是制取硝酸铜的三种方案,能体现绿色化学理念的最佳方案是o理由是。(4)该小组还用上述装置进行实验证明氧化性KMnO?>Cl2>Br2o操作步骤为实验现象为:但此实验的不足之处是」答案:(1)检查装迸气密性。(2)Cu+4HNO3(浓)二Cu(N03)2+2N(M+2也0,反应变缓,气体颜色变淡。(3)丙;耗酸量最少,无污染。(4)向d中加入KBr溶液,c中加入固体KMnOi,由a向c中加入浓盐酸;c中有黄绿色气体产生,d屮溶液变为黄棕色;没有处理尾气。\n二、逆向设问以前考“气密性检验方法”,现在考“关闭某活塞给某处微热的目的是什么”;以前考“发生倒吸的原因”,现在考“不会发生倒吸的原因”;以前考试剂的作用,现在考用什么试剂。(07上海化学笫26题)实验室模拟合成氨和氨催化氧化的流程如下:己知实验室可用饱和亚硝酸钠(Na\02)溶液与饱和氯化钱溶液经加热后反应制取氮气。(1)从右图屮选择制取气体的合适装置:氮气、氢气;(2)氮气和氢气通过甲装置,甲装置的作用除了将气体混合外,还冇;(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,(“会”或“不会”)发生倒吸,原因是:;(4)用乙装置吸收一段时间氨后,再通入空气,同时将经加热的钳丝插入乙装置的锥形瓶内,能使钳丝保持红热的原因是,锥形瓶屮还可观察到的现象是:(5)写出乙装置中氨氧化的化学方程式:;(6)反应结束后锥形瓶内的溶液屮含有H'、0H\、离了。\n答案:(1)a、b(2)干燥气体控制氢气和氮气的流速(3)不会因为混合气体中含有大量难溶于水的氮、氢两种气体\n(4)说明氨的氧化反应是一个放热反应有红棕色气体产生(5)4NH3十502—4N0+6II20(6)NH广、N03~三、关注实验细节和边角知识这样可以将“亲手做过实验”的学牛与“没做过实验”的学牛区分开來。2007年广东化学10题“排滴定管气泡的方法”、“取分液漏斗上层液体的方法”:2007±海考“泥三角”、“萃取后物质的分离”。化学是一门实验科学,科学教育耍提高学生的科学素养,科学素养要求学生不仅在学校中动脑动手,更要在牛活中用心用眼去观察。学校化学实验虽然不断被冠以“重视”、“加强”的词语,但高屮实验教学始终停留在多动眼、多动耳、多动嘴、少动手的“学”实验和机械动手不动脑的做“实验作业”状态,始终落后于高考实验命题的改革。四、学会读懂图表信息(江苏07冇三道大题是以表格数据的形式给出信息)(07海南化学第17题)下表是稀硫酸与某金属反应的实验数据:实验序号金属质量/g金属状态6'(H2SOt)/mol•L'K(H,SO,)/mL溶液温度/°c金属消失的时间/s反应前反应后10.10丝0.550203450020.10粉末0.55020355030.10丝0.750203625040.10丝0.850203520050.10粉末0.85020362560.10丝1.0502035125\n70.10丝1.05035505080.10丝1.150203410090.10丝1.150204440分析上述数据,M答下列问题:(1)实验4和5表明,对反应速率冇影响,反应速率越快,能表明同一规律的实验还有(填实验序号);(2)仅表明反应物浓度对反应速率产生影响的实验有(填实验序号);(3)本实验中影响反应速率的其他因素还冇,其实验序号是;(4)实验中的所有反应,反应前后溶液的温度变化值(约15°C)相近,推测其原因。答案:(1)固体反应物的表而积表而积越大,1和2;(2)1、3、4、6、8;2、5(3)反应温度;6和7;8和9;(4)因为所有反应中,金属质量和硫酸溶液体积均相等,门硫酸过量,产生热量相等,所以溶液温度变化值相近。五、充分利用题干信息与已学知识的衔接(06江苏18)(10分)苯甲醛在医药、染料、香料等行业有着广泛的应用。实验室通过下图所示的流程由甲苯氧化制备苯甲醛。\nSftasoi-_蝕甜卓殂1咖—神軽试回答下列问题:\n(DMn203氧化甲苯的反应需要不断搅拌,搅拌的作用是o⑵甲苯经氧化后得到的混合物通过结晶、过滤进行分离。该过程屮需将混合物冷却,其H的是—o⑶实验过程中,可循环使用的物质分别为、。⑷实验中分离甲苯和苯甲醛采用的操作I是,其原理是o⑸实验中发现,反应时间不同苯甲醛的产率也不同(数据见下表)。反应时间/h12345苯甲醛产率/%76o087o583o672o564o8请结合苯甲醛的结构,分析当反应时间过长时,苯甲醛产率下降的原因。答案:⑴使反应物充分接触,增人反应速率⑵降低MnSO”的溶解度(3)稀硫酸甲苯(4)蒸帑利用甲苯和苯甲醛的沸点差异使二者分离(5)部分苯甲醛被氧化成苯甲酸六、有意回避“3+2”时的热点以前的高考题较多地围绕氯、氮、硫、铁等元素命题,而近几年,碳化钙、硅似乎更受关注。(06天津理综28)(19分)晶体硅是一种重耍的非金属材料。制备纯硅的主要步骤如①髙温下用碳还原二氧化硅制得粗硅②粗硅与干燥HC1气体反应制得SiCh:Si+3HC1厘些=SiCh+H2③SiCb与过量H2在1000〜1100°C反应制得纯硅,已知SiCb能与也0强烈反应,在空气中易自燃o\n请冋答下列问题:(1)第①步制备粗硅的化学反应方程式为。(2)粗硅与1IC1反应完全后,经冷凝得到的SiCls(沸点33.0°C)中含有少量SiCU(沸点57.6°C)和HC1(沸点一84.7°C),提纯SiCl3采用的方法为o(3)用SiCL与过量H2反应制备纯硅的装置如下(热源及夹持装置略去):①装置B中的试剂是,装置C中的烧瓶需要加热,其H的是o②反应一段吋间后,装置D中观察到的现象是_,装置D不能采用普通玻璃管的原因是—,装置D中发生反应的化学方程式为。③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性,控制好反应温度以及—。④为鉴定产品硅屮是否含微最铁单质,将试样用稀盐酸溶解,取上层清液后需再加入的试剂(填写字母代号)是a.碘水b.氯水c.NaOH溶液d.KSCN溶液e.N/SiO::溶液答案:(1)SiO2+2C=Si+2C0t(2)分徭(或蒸馆)(3)①浓硫酸使滴入烧瓶屮的SiHCI3气化②有固体物质生成在反应温度下,普通玻璃会软化SiHCl3+H2==Si+3HCl③排尽装置中的空气④bdAB水七、实验题得不到高分的原因\n审不清题意和题冃要求、化学用语使用不规范、化学方程式不配平、实验步骤不完整、语言表达不不到位等等问题儿乎是每年高考试卷中学住均暴露出的问题。这些问题的岀现不能简单的归咎为学牛的浮躁、紧张、粗心和习惯不好,也不应完全归咎为教学任务重、复习吋间紧、髙考评分标准严格等原因。这些问题的出现归根结底还是学生学科素养差,教学中未将教材当作“白然科学的基木事实、基木原理、基木规律”进行探究,没有重视学生接受、吸收、整合化学信息能力的培养,没有树立学科思想,没有形成学科知识体系。显然不从根本上改变“落后的教学”,就无法卓有成效的改变“丑陋的试卷”!八、再做实验实验题是学生不易得分的地方,甚至有学生对实验题心存恐惧,建议教师在总复习过程中,安排学生亲手重做中学阶段重要的、有代表性的儿个课本实验,如:⑴粗盐提纯、萃取与分液、中和滴定(含标准液配制)、蒸饰石油等操作实验⑵氨气、氢气、氯气、乙烯、乙酸乙酯等制取实验⑶化学反应速率与化学平衡;同周期、同主族元素性质递变的理论实验⑷氯气、硫酸、硝酸、铝和铁及其化合物、乙醛等物质的性质实验当然,重做这些实验并不是简单重复地做一遍,而是要求用新视角重新观察、审视已做过的这些实验。具体地说,就是要求対每个重做的实验做到〃一个了解、五个学会“。即了解实验冃的、步骤和原理;学会控制条件、学会使用仪器、学会观察分析、学会解释结果得出相应结论以及学会设计简单的实验方案。同时还要培养七种意识,B|J:①动手操作意识;②安全意识;③规范化意识;④环保意识;⑤质虽意识;⑥定虽意识;⑦创新、质疑意识。高一化学实验专题复习贵州省黔西第一中学史光源基础部分1、下列仪器不能用于加热的是()(A)容量瓶(B)鬪底烧瓶(C)试管(D)烧杯2、下列气体不能用浓比SO彳干燥的是()(A)C02(B)CO(C)NH:i(D)S023、要除去混在CO2气体中少量SO2,最好让气体通过()\n(A)N&C0:3溶液(B)漠水(C)NaOH溶液(D)饱和NaHCO3溶液4、下列实验操作小,正确的是()(A)稀释浓硫酸可先在量筒中加入一定体积水,再在不断搅拌下沿量筒壁慢慢加入浓硫酸(B)过滤时,漏斗里的滤液应低于滤纸的边缘(C)燃着的酒粘:灯不慎打翻,应立即用水灭火(D)测定溶液的pH值时,应用玻棒蘸取待测液,直接滴在干燥的pH试纸上5、某学生要提纯混冇泥沙的食盐,他设计的主要操作有:溶解、过滤、蒸发。在这些操作中都需要使用的仪器是()(A)烧杯(B)漏斗(C)玻璃棒(D)酒精灯6、下列试纸在使用时不宜用水湿润的是()(D)红色石蕊试纸(A)蓝色石蕊试纸(B)淀粉碘化钾试纸(C)pH试纸7、不能用浓硫酸而只用碱石灰干燥的气体是()(A)H2(B)H2S(C)Cl2(D)NH38、下列物质在空气中久置,不会变质的是()(D)氢SOf(A)Ca(OII)2(B)漂白粉(C)氯化钾9、下列仪器中,“0”刻度在上端的是()(A)量筒(B)滴定管(C)温度计(D)容量瓶10、在用氢氧化钠固体配制250ml0.lmol/LNaOH溶液的过程中不需要的仪器是(A)250ml容量瓶(B)托盘天平(C)胶头滴管(D)烧瓶11、右图是化学实验常用装置乙一,若气体从右管进入,可用来收集的气体是()\n(A)N0(B)NO,(C)CO(D)S0212、实验室进行NaCl液蒸发时,一般侑以下操作过程①固定铁圈位置②放置酒精灯③放上石棉网④放上蒸发皿①加热搅拌⑥停止加热、余热蒸干其,正确的操作顺序为()(A)①②③④⑤⑥(B)②①③④⑤⑥(C)②①④⑤⑥(D)②①®®⑤13、对下列仪器回答问题:①容量瓶②蒸懈烧瓶③滴定管④量筒⑤烧杯⑥蒸发皿⑦分液漏斗(1)对允许加热的仪器,加热吋必须垫石棉网的有(填序号)(2)使用时必须检查是否漏水的有(填序号)(3)标有“0”刻度的有(填序号)14、如图装置中,若关闭活塞,则品红溶液无变化,石蕊试液变红,石灰水变浑浊.若打开活塞,则品红溶液褪色,石蕊试液变红,石灰水变浑浊.据此判断气体和广口瓶中盛放的物质是()品红石蕊石荻水(A)ILS和浓H2SO;(B)S02和NaHCOs溶液(C)CL和NallCOa溶液(D)CL和氯水15、(1)下列实验操作中,正确的是o\nA、称量固体药品时,将约品直接放在天平托盘上。B、实验室用氯酸钾制氧气结束时,先从水槽中移出导气管,再熄灭酒精灯\nC、先将pH试纸用蒸帑水润湿后,再测定溶液的pHD、在量筒中稀释浓硫酸E、金属锂保存在煤油中F、金属钠不慎燃烧立即用沙了覆盖G、用lOOmL量筒量取2.5OmL盐酸16、右图是实验室制取气体的一种装査。(1)这种制气装置在加入反应物前,应首先进行的实验操作是O(2)该装直可制取的气体o(写出物质的化学式)。(3)若用上述装置制取02,除了可选择二氧化镒和(填物质名称),还能选择(填物质的化学式)和水。(4)若用排空气法收集H2,可选择下图中的A装置,收集时气体应从口进气。(填“a”或“b”)。若用排水法收集出,可选择同时使用下图中的A和B两套装置,其操作是:在A中加满水,盖紧瓶塞,o干燥的氯气氯气尾气综合部分17、(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有潮湿有色布条的广口瓶,可观察到的现彖是0(2)为防止氯气尾气污染空气,根据氯水显酸性的性质,可用溶液吸收多余的氯气,原理是(用化学方程式表示)o\n根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的冇效成分是(填化学式),长期露置于空气中的漂口粉,加稀盐酸后产牛的气体是(用字母代号填)。(3)据“北方网”报道,2004年4月15日至16日,位于重庆市江北区的天原化工总厂相继发牛氯气泄漏和爆炸事故。截至记者发稿时,己有9人在事故小失踪死亡,3人受伤,15万人被紧急疏散。当人们逃离爆炸现场时,可以用浸有一定浓度的某种物质的水溶液的毛巾捂住鼻子,最适宜采用的该物质是oA.NaOHB.NaClC.KBrD・Na2CO318、有一瓶澄清的溶液,其中可能含有NHf、K、Na+、Mg2\Ba2+、Al34、Fe3\Cl、I">N03\CO/一、S2_、SO?、A102-、SO产、Mn0「,取该溶液进行以下实验:(1)、取PH试纸检验,溶液呈强酸性,町以排除离子的存在。(2)、取出部分溶液,加入少量CC1..及数滴新制氯水,经振荡后CCL层呈紫红色,可以排除离子的存在。(3)、另取出部分溶液逐渐加入Na()H溶液,使溶液从酸性逐渐变为碱性,在滴加过程中和滴加完毕后,溶液均无沉淀产生,则又町以排除离了的存在。(1)、取出部分上述碱性溶液加Na2CO3溶液后,有白色沉淀生成,证明离子存在,乂可排除离子的存在。(2)、将(3)得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。根据上述实验事实确定:该溶液中肯定存在的离子是肯定不存在的离子是还不能确定是否存在的离了是19、选用如下实验装置组合后完成用浓盐酸、二氧化猛共热制C12,并用C12和Ca(0H)2反应制少量漂口粉的实验。\n己知反应2Cl2+2Ca(OH)2=Ca(ClO^+CaChmO+Q温度稍高即发生副反应6Cl2+6Ca(OH)2==5CaCl2+Ca(C103)2+6H2O0\n(1)选用各装置的接口顺序为⑵各装置所起的作用⑶实验中若用12mol•L-1的浓盐酸100ml与足量的反应,最终生成Ca(C10)2的物质的量总是小于0.15niol,其可能的主要原因是。(假定各步反应均无反应物损耗且无副反应发生)20、冇一种由CO、CO?、出、水蒸气四种气体组成的混合气体,要证明其中含冇C0和H2,可选用的仪器及药品如2(1)实验时,连接装置的顺序是;导管接口的顺序是。(2)装置①内发牛:反应的化学方程式是①②③◎◎\n(3)证明混合气体中含有氢气的实验现彖是o参考答案:1.A2.C3.D4.BD5.C6.C7.D&C9.B10.D11.BD12.B13.⑴②⑤⑵①⑦⑶③④14.B15.BF16.(1)检查装置的气密性(2)CO2、NO、NO2选填两个,其他合理答案也给分(如NH:;、HC1、H2S>SO2、Cl2)(3)双氧水(或过氧化氢水溶液)NaQ(4)a用胶管连接b和c接口,山a导入出气体,(水通过b和c排入B中)。17.(1)潮湿有色布条褪色而干燥有色布条不褪色(2)氢氧化钠(NaOH);2NaOH+C12=NaC10+NaC1+H,0;Ca(C10)2;C(3)D18.(1).CO32_>S2_、AlOo-、SO3I(2).Fe'+、NOJ、MnO4-(3).Mg\Al3*(4).Ba2+;SO产(5).I"、NH;、Ba2+;Al3+、FetN0:「、CO32~>S2_、SO产、A102、SO3—、MnO4■:K、Na\Cl19.(l)adig(2)A制备C4D制漂白粉F尾气处理⑶随着反应进行浓盐酸浓度下降,到一定程度反应就不能进行20.(1)③②①⑤④,fedcabjihg(2)CO+CuO—Cu+CO2;H2+CuO—Cu+H,>0⑶⑤中的无水硫酸铜变蓝高中化学易错知识点梳理(湖南城步一中夏淸国)1、疑基就是氢氧根看上去都是0H组成的一个整体,其实,轻基是一个基团,它只是物质结构的一部分,不会电离出來。而氢氧根是一个原子团,是一个阴离子,它或强或弱都能电离出來。所以,\n耗基不等于氢氧根。例如:C2H5OH中的OH是径基,不会电离出来;硫酸中有两个0H也是疑基,众所周知,硫酸不可能电离出0H「的。而在NaOH.Mg(OH)2.Fe(0H)3、Cu2(OH)2C03+的OH就是离子,能电离出来,因此这里叫氢氧根。2、离子是黄色的众所周知,FeCl3溶液是黄色的,但是不是意味着F/就是黄色的呢?不思F/对应的碱Fe(OH)3是弱碱,它和强酸根离子结合成的盐类将会水解产生红棕色的Fe(OH)3。因此浓的FcCL溶液是红棕色的,一般浓度就显黄色,归根结底就是水解生成的Fc(0H)3导致的。真止F/离了是淡紫色的而不是黄色的。将Ff溶液加入过量的酸來抑制水解,黄色将褪去。3、AgOH遇水分解我发现不少人都这么说,其实看溶解性表中AgOH-格为“一”就认为是遇水分解,其实不是的。而是AgOIl的热稳定性极差,室温就能分解,所以在复分解时得到AgOIl后就马上分解,因而AgOH常温下不存在。和水是没有关系的。如果在低温下进行这个操作,是可以得到AgOH这个白色沉淀的。4、多元含氧酸具体是几元酸看酸中H的个数多元酸究竟能电离多少个H',是要看它结构中有多少个疑基,非疑基的氛是不能电离出来的。如亚磷酸(HfOQ,看上去它有三个H,好像是三元酸,但是它的结构屮,是有一个H和一个0分别和中心原子直接相连的,而不构成疑基。构成疑基的0和H只有两个。因此H:FOs是二元酸。当然,有的还要考虑别的因素,如路易斯酸比B0,就不能由此來解释。5、酸式盐溶液呈酸性表面上看,“酸”式盐溶液当然呈酸性啦,其实不然。到底酸式盐呈什么性,耍分情况讨论。如果这是强酸的酸式盐,因为它电离出了大量的/而且阴离子不水解,所以强酸的酸式盐溶液一定呈酸性。而弱酸的酸式盐,则要比较它电离岀『的能力和阴离了水解的程度To如果阴离子的水解程度较大(如NaHCOQ,贝U溶液呈碱性;反过來,如果阴离子电离出HYI勺能力较强(如NaHfOJ,则溶液呈酸性。6、H2SO4有强氧化性就这么说就不对,只要在前边加一个“浓”字就对了。浓HzSOi以分子形式存在,它的氧化性体现在整体的分子上,H$0.冲的节易得到电子,所以它有强氧化性。而稀出SO」(或so?-)的氧化性几乎没有(连昭也氧化不了),比H2SO3(或SO”)的氧化性还弱得多。这也体现了低价态非金属的含氧酸根的氧化性比高价态的强,和HC1O与HC1O"的酸性强弱比较一样。所以说H2SO(冇强氧化性时必须严谨,前面加上“浓”字。\n7、盐酸是氯化氢的俗称看上去,两者的化学式都相同,nJ能会产生误会,盐酸就是氯化氢的俗称。其实盐酸是混合物,是氯化氮和水的混合物;而氯化氮是纯净物,两者根木不同的。氯化氢溶于水叫做氢氯酸,氢氯酸的俗称就是盐酸了。8、易溶于水的碱都是强碱,难溶于水的碱都是弱碱从常见的强碱NaOH.KOH、Ca(0H)2和常见的弱碱Fe(0H)3.Cu(0H)2来看,似乎易溶于水的碱都是强碱,难溶于水的碱都是弱碱。其实碱的碱性强弱和溶解度无关,其屮,易溶于水的碱町别忘了氨水,氨水也是一弱碱。难溶于水的也不一定是弱碱,学过高一元素周期率这一节的都知道,钱和热水反应后滴酚欣变红的,证明Mg(OH)2不是弱碱,而是中强碱,但Mg(0H)2是难溶的。还有AgOH,看Ag的金属活动性这么弱,想必AgOH—定为很弱的碱。其实不然,通过测定AgNOs溶液的pH值近中性,也可得知AgOH也是一中强碱。9、写离子方程式时,强电解质一定拆,弱电解质一定不拆在水溶液中,的确,强电解质(难溶的除外)在水屮完全电离,所以肯定拆;而弱电解质不能完全电离,因此不拆。但是在非水溶液中进行时,或反应休系中水很少时,那就耍看情况了。在固相反应时,无论是强电解质还是弱电解质,无论这反应的实质是否离子交换实加热现的,都不能拆。如:2NH}C1+Ca伽)2CaCl2+2NH3t+2H20,这条方程式全部都不能拆,因此不能写成离子方程式。有的方程式要看具体的反应实质,如浓HzSOi和Cu反应,尽管浓HQ)•,的浓度为98%,还有少最水,有部分分子还可以完全电离成F和SO产,但是这条反应主要利用了浓出SO,的强氧化性,能体现强氧化性的是H2SO,分子,所以实质上参加反应的是H2SO1分子,所以这条反应中比SO#不能拆。同样,生成的CuSO,因水很少,也主要以分了形式存在,所以也不能拆。弱电解质也冇拆的时候,因为弱电解质只是相对于水是弱而以,在其他某些溶剂中,也许它就变成了强电解质。如CH3COOH在水中为弱电解质,但在液氨中却为强电解质。在液氨做溶剂时,CHsCOOH参加的离子反应,CHsCOOH就可以拆。10、王水能溶解金是因为有比浓硝酸更强的氧化性旧的说法就是,浓硝酸和浓盐酸反应生成了N0C1和Cb能氧化金。现在研究表明,王水Z所以溶解金,是因为浓盐酸中存在高浓度的C1,能Au配位生成[AuClJ从而降低了Au的电极电势,提高了Au的还原性,使得Au能被浓硝酸所氧化。所以,王水能溶解金不是因为王水的氧化性强,而是它能捉高金的还原性。高考化学知识复习重点知识(湖南城步一•中夏清国)作为基础学科知识内容考查的依据,以下所列的知识点在近10年來的化学高考命题屮呈现率达90%以上希望同学们在临考的复习中能一一对照來巩固相应的基础,如果某些点的认识不够,建议重温相应的教材和教辅资料,确保该内容的高得分率。1、氧化还原相关概念和应用\n(1)借用熟悉的&还原CuO来认识5对相应概念。(2)氧化性、述原性的相互比较。(3)氧化还原方程式的书写及配平。(4)同种元素变价的氧化还原反应(歧化、归中反应)。(5)一些特殊价态的微粒如H、Cu、Cl、Fe、的氧化还原反应。(6)电化学中的氧化还原反应。2、物质结构、元素周期表的认识(1)主族元素的阴离了、阳离了、核外电了排布。(2)同周期、同主族原子的半径大小比较。(3)电子式的正确书写、化学键存在。(4)建议能画出短周期元素周期表的草表。3、阿氏常数与阿氏推论(1)利用克拉伯龙方程推导“阿氏4推论”,(P、V、T)条件下对“物质的量、摩尔质量、微粒数、体积比、密度比”。(2)利用克拉伯龙方程计算不同温度或压强下的体积。(3)熟悉佩常考查的微粒数冃中固体、得失电了、中了数等内容。4、化学能量(1)今年该内容被独立地罗列于考试说明中,请多加注意。(2)热化学方程式的正确表达(状态、计量数、能量关系)。(3)化学变化中的能量交换关系。5、离子的鉴别、离子共存(1)离了因结合生成沉淀而不能人最共存。(2)因能反应牛成气体而不能人量共存。\n(3)因能生成难电离的弱电解质。(4)因相互发生氧化还原而不能大量共存。(5)因双水解、生成络合物而不能大最共存。(6)弱酸的酸式酸根离子不能与强酸、强碱大量共存。(7)题设中的“酸碱性、颜色”等。6、溶液浓度、离子浓度的比较及计算(1)善川微粒的守恒判断。(2)电荷守怛屮的多价态离子处理。(3)物料守恒中离子与水解产物的综合考虑。(4)浓度的计算请遵循定义(公式)规范表达。7、pH值的计算(1)遵循定义(公式)规范自己的计算过程。(2)理清题设所问的是“离子”还是“溶液”的浓度。(3)酸过量或碱过量时pH的计算(酸时以H浓度计算,碱时以0H计算再换算)。8、化学反应速度、化学平衡(1)能计算反应速率、理解各物质计量数与反应速率的关系。(2)以“高则快”,“低则慢”來理解条件刈•反应速率的影响。(3)理顺“反应速率”的“改变”与“平衡移动”的“辩证关系”。(4)遵循反应方程式规范自己的“化学平衡”相关计算过程。(5)平衡移动屮的“等效平衡”理解(难点)。9、电化学知识\n(1)以家庭里的干电池为参照物理顺“电极名称”。(2)能止确表明“原电池、电解电镀池”及变形装置的电极位置。(3)能写出各电极的电极反应方程式。(4)了解常见离子的电化学放电顺序。(5)能准确利用“得失电子守恒”原则计算电化学中的定量关系。10、盐类的水解(1)盐类能发生水解的原因。(2)不同类型之盐类发生水解的后杲(酸碱性、浓度大小等)。(3)盐类水解的应用或防I上(胶体、水净化、溶液制备)。(4)对能发牛•水解的盐类溶液加热蒸干、灼烧的后呆。(5)能发生完全双水解的离子反应方程式。11、Cl、S、N、X、P、Na、Mg、Al、Fe等元素的单质及化合物(1)总体上借助价态变化的转化反应来认识。(2)容易在无机推断题中出现,注意上述元索的特征反应。(3)注意N中的硝酸与物质的反应,其体现的酸性、氧化性“两作为”是考查的重点。(4)有关A1的化合物中则熟悉其两性反应(定性、定量关系)。(5)有关Fe的化合物则理解F疋和之间的转化、Ff的强氧化性。12、有机物的聚合及单体的推断(1)根据高分了的链节特点准确判断加聚反应或缩聚反应归属。(2)熟悉含C二C双键物质的加聚反应或缩聚反应归属。(3)熟悉含(-COOH、-OH)、(-COOH、-NHJ、酚醛之间的缩聚反应。\n13、同分异构体的书写(1)该内容的作答并不难,相信自己能很好地完成。(2)请按官能团的位置异构、类别异构和条件限制异构顺序一个不漏的找齐。(3)本内容最应该做的是作答后,能主动进行一•定的检验。14、有机物的燃烧(1)能写出有机物燃烧的通式。(2)燃烧最可能获得的是C和H关系。15、完成有机反应的化学方程式(1)有机化学推断题屮,往往要求完成相互转化的方程式。(2)注意方程式中要求表示物质的结构简式、表明反应条件、配平方程式。16、有机物化学推断的解答(1)一般出现以醇为中心,酯为结尾的推断关系,所以复习时就熟悉有关“醇”和“酯”的性质反应(包括一些含其他官能团的醇类和酯)。(2)反应条件体现了有机化学的特点,请同学们回顾有机化学的一般条件,从中归纳相应信息,可作为推断有机反应的有利证据。(3)从物质发牛反应前后的官能团差别,推导相关物质的结构。17、化学计算(1)近年來,混合物的计算所占的比例很大(90%),务必熟悉冇关混合物计算的一般方式(含讨论的切入点)。(2)回顾近儿次综合考试的计算题,感受“守恒法”在计算题干中的暗示和具体计算时的优势。化学中的120个关键知识点正误判断(湖南城步一中夏淸国)A“元素化合物”知识模块\n1、碱金属元素原子半径越大,熔点也越高,单质的活泼性越大2、硫与白磷皆易溶于二硫化碳、四氯化碳等冇机溶剂,冇机酸则较难溶于水3、在硫酸铜饱和溶液屮加入足最浓硫酸产生白色固体4、能与冷水反应放出气体单质的只有是活泼的金属音质或活泼的非金属单质5、将空气液化,然后逐渐升温,先制得氧气,余下氮气6、把生铁冶炼成碳素钢要解决的主要问题是除去生铁中除Fe以外各种元素,把生铁提纯7、虽然自然界含钾特制均易溶于水,但土壤中K%不高,故需施钾肥满足8、制取漂白粉、配制波尔多液以及改良酸性土壤时,都要用到熟石灰9、二氧化硅是酸性氧化物,它不溶于酸溶液10、铁屑溶于过最盐酸,再加入氯水或漠水或碘水或硝酸锌,皆会产生Fe”11、常温下,浓硝酸可以用铝罐贮存,说明铝与浓硝酸不反应12、NaA102>Na2SiO3>N/COs、Ca(C10)2>NaOH、C^lkCOONa、CeHsONa等饱和溶液中通入CO?出现白色沉淀,继续通入C0?至过量,白色沉淀仍不消失13、大气小人量二氧化硫來源于煤和石汕的燃烧以及金属矿石的冶炼14、某澄清溶液由NHX1.AgNOs.NaOH三种物质混合而成,若加入足量硝酸必产牛.口色沉淀15、为了充公分利用原料,硫酸工业屮的尾气必须经净化、回收处理16、用1molAl与足量NaOH溶液反应,共有3mol电子发生转移17、硫化钠既不能与烧碱溶液反应,也不能与氢硫酸反应18、在含冇较高浓度的Fe'+的溶液中,SCN、I、A10?、S2\CO产、HC(h等不能大量共19、活性炭、二氧化硫、氯水等都能使品红裡色,但反应本质有所不同20、乙酸乙酯、三漠苯酚、乙酸钠、液漠、玻璃、重晶石、重钙等都与烧碱反应\n21、在FeBn溶液中通入一定量8可得FeBm、FeCl2>Br222、在NaA102>Na2SiO3>Na2C03^Ca(C10)2>NaOH>G^COOHa、CeHsONa等饱和溶液中通入CO,气体,出现白色沉淀,继续通入C0?至过量,白色沉淀仍不消失23、在次氯酸钠溶液屮通入少量二氧化硫可得亚硫酸钠与次氯钠24、有5.6g诜与足量酸反应转移电子数目为0.2抠25、含有最高价元素的化合物不一定具有强氧化性26、单质的还原性越弱、贝康氧化性越强27、下列物质与水反应能产生可燃性气体:电石、硫化铝、红热的炭、过氧化钠等28、单质X能从盐的溶液中逍换出单质Y,贝小单质X与Y的物质属性可以是:(1)金属和金属;(2)非金属和非金属;(3)金属和非金属;(4)非金属和金属29、H?S、Hl、FeCl2>浓H2SO4>NaSO3>苯酚等溶液在空气中久置因发生氧化还原反应而变质30、浓硝酸、浓硫酸在常温下都能与铜、铁等发生反应B“基本概念基础理论”知识模块1、与水反应可牛成酸的氧化物都是酸性氧化物2、分子中键能越大,分子化学性质越稳定3、金属活动性顺序表中排在氢前面的金属都能从酸溶液中置换出氢4、既能与酸反应又能与碱反应的物质是两性氧化物或两性红氧化物5、原子核外最外层JW2的一定是金属原子;目前金属原子核外最外层电子数可为1/2/3/4/5/6/76、非金属元素原了氧化性弱,其阴离子的还原性则较强7、质子总数相同、核外电子总数也相同的两种粒子可以是:(1)原子和原子;(2)原子和分子;(3)分子和分子;(4)原子和离子;(5)分子和离子;\n(6)阴离了和阳离了;(7)阳离了和阳离了8、盐和碱反应一定生成新盐和新碱;酸和碱反应一定只生成盐和水9、pH=2和pH二4的两种酸混合,其混合后溶液的pH值一定在2与4Z间10、强电解质在离子方程式中要写成离子的形式11、电离出阳离子只有川的化合物一定能使紫色石蕊变红12、甲酸电离方程式为:hcooh=h4+cooh13、离子晶体都是离子化合物,分子晶体都是共价化合物14、一般说來,金属氧化物,金属氢氧化物的胶体微粒带正电荷15、元素周期表中,每一周期所具有的元素种数满足2『(n是自然数)16、强电解质的饱和溶液与弱电解质的浓溶液的导电性都比鮫强17、标准状况下,22.41.以任意比例混合的CO与C02中所含碳原了总数约为瓜18、同温同压,同质量的两种气体体积之比等于两种气体密度的反比19、纳米材料小超细粉末粒子的直径(1-100mm)与胶体微粒的直径在同--数量级20、1mol0H在电解过程中完全放电时电路中通过了加个电子21、同体积同物质的量浓度的Na2SO3.Na2S.NaHSOs.H2SO3溶液中离子数H依次减小22、碳-12的相对原子质量为12,碳-12的摩尔质量为12g/mol23、电解、电泳、电离、电化腐蚀均需在通电条件下才能进行,均为化学变化24、汕脂、淀粉、蛋白质、硝化甘油、苯酚钠、乙烯、明矶、Al:、MgN、CaC2等一定条件下皆能发生水解反应25、氯化钾晶体中存在片与Cl「;过氧化钠中存在Na♦与0「为1:1;石英中只存在Si,0原子26、将加个NO?气体分子处于标准状况下,其体积约为22.4L27、常温常压下,32g氧气中含有廐\n28、构成分子晶体的微粒中一定含有共价键29、胶体能产生电泳现彖,帮胶体带有电荷30、溶液的pll值越小,则其中所含的氢离了数就越多31、只有在离子化合物中才存在阴离子32、原子晶体熔化需要破坏圾性键或非极性键33、液氨、液氯、液态二氧化硫等皆为非电解质34、分子晶体的熔点不一定比金属晶体低35、同一主族元素的音质的熔沸点从上到下不一定升高,但其氢化纳的熔沸点一定升高36、电解硫酸铜溶液或硝酸银溶解后,溶液的酸性必定增强37、氯化钠晶体中,每个钠离了周围距离最近冃•相等的钠离了冇6个38、用1L、1mol/L、FeCl3溶液完全水解制胶体,生成侃个胶体微粒39、在HF、PCh、匕、CO?、SF6等分子中,所有原子都满足最外层8J结构40、最外层电子数较少的金属元索,一定比最外层电子数较它多的金属元素活泼性强C、“有机化学”知识模块1、症基官能团可能发生反应类型:取代、消去、酯化、氧化、缩聚、中和反应2、最简式为CH4的有机物:甲酸甲酯、麦芽糖、纤维素3、分了式为CM2O2的二元醇,主链碳原了冇3个的结构冇2种4、常温下,pH二11的溶液中水电离产生的c(H4)的10"倍5、甲浣与氯气在紫外线照射下的反应产物有4种6、伯醇在一定条件下均能氧化生成醛,醛类在一定条件下均能氧化生成竣酸\n7、CMO与GILO在浓硫酸作用下脱水,最多可得到7种冇机产物8、分子组成为CM。的烯坯,其可能结构有「5种9、分子式为GHM2,且结构中含有六元碳环的酯类物质共有7种10、等质量甲烷、乙烯、乙烘充分燃烧时,所耗用的氧气的量由多到少11、棉花和人造丝的主要成分都是纤维素12、聚四氟乙烯的化学稳定性綾好,其单体是不饱和坯,性质比较活泼13、酯的水解产物可能是酸和醉也可能是酸和酚;|川苯甲烷的一•硝基取代物冇3种14、甲酸脱水可得CO,CO在一•定条件下与NaOH反应得HCOONa,故CO是酸酊15、应用水解、収代、加成、还原、氧化等反应类型型均可能在有机物分子中引入疑基16、由天然橡胶单体(2-甲基-1,3-丁二烯)与等物质的量澳单质加成反应,有三种可能生成物17、苯中混有已烯,可在加入适量漠水后分液除去18、由2-丙醇与澳化钠、硫酸混合加热,可制得丙烯19、混在浪乙烷中的乙醇可加入适量氢浪酸除去20、应用干懈方法对将煤焦油中的苯等芳香族化合物分离出来21、廿氨酸与谷氨酸、苯与蔡、丙烯酸与油酸、葡萄糖与麦芽糖皆不互为同系物22、裂化汽汕、裂解气、活性炭、粗氨气、石炭酸、CCLk焦炉气等都能使漠水褪色23、苯酚既能与烧碱反应,也能与硝酸反应24、常温下,乙醇、乙二醇、丙三醇、苯酚都能以任意比例与水互溶25、利用硝酸发生硝化反应的性质,可制得硝基苯、硝化口•油、硝酸纤维26、分子式CM©的有-机物X,水解生成两种不含支链的肓•链产物,则符合题意的X有7种27、1,2一-二氯乙烷、1,1一二氯内•烷,一氯苯在NaOH醇溶液中加热分别分别生成\n乙炊、丙炊、苯烘28、甲醛加聚生成聚甲醛,乙二醇消去生成坏氧以瞇,甲基丙烯酸甲酯缩聚生成有机玻璃29、甲醛、乙醛、甲酸、甲酸酯、甲酸盐、葡萄糖、果糖、麦芽糖、蔗糖都能生成银镜反应30、乙规、聚乙烘、乙烯、聚乙烯、甲苯、乙醛、甲酸、乙酸都能使心皿(H+)(ap)褪色D、“化学实验”知识模块1、银氨溶液、氢氧化铜悬浊液、氢硫酸等试剂不宜长期存放,应现配现用2、实验室抽収氧气完毕后,应先取岀集气瓶,再取出导管,后停止加热3、品红试纸、醋酸铅试纸、pH试纸、石蕊试纸在使用前必须先用蒸馆水润湿4、川标准盐酸滴定未知NaOIl溶液时,所川锥形瓶不能川未知NaOIl溶液润洗5、为防止挥发,浓氨气、氢氟酸、漂白粉、液浪、汽汕、乙酸乙酯等均需密封保存6、浓比S0.[沾到皮肤上,应立即用水冲洗,再用干燥布擦净,最后涂上NaHCOs溶液7、一支25M1的滴定管中液面所在刻度为12.00,则其中所盛液体体积大于13.00mL8、准确量取25.00mL的KMnCh溶液,可用50mL碱式确定管9、分液吋,分液漏斗中下层液体从下口放出,上层液体从上口倒出10、蒸馆时,应使温度计水银球靠近蒸镉烧瓶支管口。分析下列实验温度计水银位置(测定溶解度、制乙烯、硝基苯、苯磺酸、酚酚醛树脂、乙酸乙酯制备与水解、糖水解)11、滴定吋,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼晴注视滴定管中的液面下降的速度12、称量时,称量物放在称量纸上,査于托盘天平的右盘,祛码放在托盘天平的左盘小13、试管小注入某无色溶液密封,加热试管,溶液变红色,冷却后乂变无色。确定溶液成分\n14、一种试剂可以鉴别甲苯、氯仿、已烯、酒精、苯酚水溶液、纯碱溶液15、氢氧化钠溶液滴定醋酸时,通常选择甲基橙作指示剂,终点颜色由橙变黄16、除去蛋口质溶液中的可溶性盐可通过盐析的方法17、配制硫酸亚铁溶液所用的蒸馅水应预先煮沸,以除去溶解在水中的氧气18、试管、蒸发皿、邨曙锥形瓶等仪器均可直接在酒精灯火焰上加热19、所谓硅胶,即硅酸胶体。硅胶变色为物理变化[C()C12・H?0(蓝色)C0C12・6H?0(红色)]20、饱和纯碱溶液町除去乙酸乙酯中的乙酸;盐析法分离油脂皂化所得的混合液答案A“元素化合物”知识1、错。熔点递减2.错。低级有机酸易溶于水3•对。浓硫酸吸水性4•错。Na202+H20->02t5.错。先制得氮气余下液氧6.错,降C%7.错。白然界钾元素含最不低,但以复杂硅酸盐形式存在不溶于水8.对。9.错。溶于HF溶液10.错。碘水生成Feb11.错。钝化是化学性质12.错°Ca(C10)2中继续通入CO2至过量,白色沉淀消失13.对。14.对oNH.Cl+AgNOa+NaOH->Ag(NH3)2Cl,+HNO3:NH4NO汁AgClI2H2017.错Na2S»II2S=2NaHS1&对。Fe3++SCN(络合反应)、s2/r(氧化还原反应)、aio27co327hco3-(双水解反应)19.对。活性炭(吸附,物理变化)、二氧化硫(可逆、不稳定、化学反应)、氯水(氧化还原、不可逆)20.错。重晶石不反21.错。还原性:Fe2,>Br,FeCl2+Br2不共存22.错。Ca(C10)2.溶液中通入CO2气体,白色沉淀,继续通入C0?气体,口色沉淀,继续通入CO?至过量,口色沉淀消失23.错。NaClO+SO2+H2O=H2SO4+NaCl24.错。1molFe+HN03等氧化性酸失去3mole;1molFe+HCl等非氧化性酸失去2mole-25.对。如:HCLOk稀硫酸不具有强氧化性26.错。稀有气体单质不符合27.错。水+过氧化钠一0宾助燃,不可燃2&错。(4)非金属和金属不可能29.错。浓H2SO勺不发生氧化还原反应30•错。浓硫酸在常温和铜不发生反应。B“基本概念基础理论”知识模块1•错。N022.对。如2、HF等3.错。金属活动性顺序表中排在氢前面的金属,金属性弱的反应不明显。氧化性酸也不能4•错。如SiCh+NaOH/HF都能反应。5.错。原子核外最外层eW2的可以是Ho、H等非金属元素原子;目询金属原子核外最外层电子数可为1/2/3/4/5/6。最外层7e■的117好金属元素明确没分析6.对。7.错。这几组不行。(4)原子和离子;(5)分子和离子;(6)阴离子和阳离子;(7)阳离子和阳离子;8•错。NaHSO.i+NaHCO3=NaSO4+CO2f+出0;10HN03+3Fe(OH)2=3Fe(N03)3+N0t+8H209.错。2H2S+H2SO尸3SI+3H20;HCIO+H2SO3二HCI+H2SO410.错。不溶于水的强电解质、浓\nH2SO4等不写成离子的形式11.错。H2012•错。可逆电离、甲酸根离子HCOO13.错。分子晶体许多是单质14•对。15.对。注意n不是周期序数16.错。强电解质溶解度小的饱和溶液、与弱电解质的浓溶液由于电离不完全导电性都较弱17.对。1&错。V=m・P同温同压,同质量的两种气体体积Z比等于两种气体密度的正比19.对。20.对。40H「一4"2出0+02f21.对。从电荷守恒角度理解较好22.对。注意对彖:“碳-12”23.错。电解、电泳需在通电条件下才能进行,电泳为物理变化;电离不需通电、物理变化;电化腐蚀产生电流24.错。乙烯不水解25.错。过氧化钠中阳与0产为2:1,在石英中存在Si、0原子还有杂质元素26•错。降温,NO向NQ方向移动27.错。SiO?中没有分子28.错。稀有气体晶体中的微粒没有共价建29.错。胶粒带有电荷30.错。体积不知。31.错。电解质水溶液中也有32.对。33.错。液氯不是非电解质34.对。如金属汞熔点很低35.错。氢化物的熔沸点也一定升高,考虑氢键36.错。以铜作阳极,溶液的酸性要减弱37.错。12个38.错。生成胶体微料大大小于佩个39•错。HF、SFe中,所冇原子不都满足最外层弘一结构40.错。过渡金属元素原子最外层都是1-2JC“有机化学”知识模块1.对。取代(醇、酚、竣酸)、消去(醇)、酯化(醉、竣酸)、氧化(醉、酚)缩聚(醇、酚、竣酸)、中和反应(竣酸、粉)2.错。麦芽糖、纤维素不符合3.对。4•错。10“5.错。四中有机物+HC1共五种产物6.错。醇类在一定条件下不一•定能氧化住成醛,醛类在一定条件下均能氧化生成竣酸7.对。六种醛一种烯&对。9.对。注:g-CH3和00CH六元碳环上取代有4种10.对。N(H)/n(0)比值决定耗氧量11.对。棉花、人造丝、人造棉、玻璃纸都是纤维素12.错。单体是不饱和卤代坯13.错。酯的水解产物也可能是酸和酚。14.错。甲酸酎(HC0L015.对。水解、取代(酯、卤代烧到醇)、力口成、述原(醛到醇)、氧化(醛到酸)16.对。1,2;1,4;3;4三种加成17.错。苯溶剂溶解二漠代己烷18.错。2-漠丙烷19.对。取代反应20•错。分憎21.错。只冇丙烯酸与油酸为同系物22.对。裂化汽油、裂解气、焦炉气(加成)活性灰(吸附)、粗氨水(碱反应)、石炭酸(取代)、CCh(萃取)23.对。24.错。苯酚常温不溶于水25.错。酯化反应制得硝代甘汕、硝酸纤维26.对。酸+醇的碳数等于酯的碳数27.错。没有苯烘2&错乙二醇取代生成环氧以瞇,甲基内烯酸甲脂加聚生成有机玻璃29.错。蔗糖不能反应30.错。聚乙烯、乙酸不能便酸性高镒酸钾溶液褪色。D“化学实验”知识模块1.对。2.对。3.错。pH试纸事先不润湿。4.对。5.错。漂白粉不会挥发,但要密封保存6.错。先干燥布拭去再用水冲洗7.对。8.错。酸式滴定管9•对。10.対。测定溶解度(试管水)、制乙烯(反应液)、硝基苯(水浴)、苯磺酸(水浴)、酚醛树脂(沸水浴)、乙酸乙酯制备(肓接加热)、水解(水浴)、糖水解(水浴)11•错。眼睛注视锥形瓶屮指示颜色变化12.错。左物右码13.S0>+品红溶液14.对。浓澳水15.错。酚蚊16.错。渗析17.对。18.错。锥形瓶隔石棉网微热19.错。硅胶:nS102・血20硅胶变色化学变化。20.错。盐析。备战高考:化学高考的16条优先原理(湖南城步一中夏淸国)1.优先放电原理\n电解电解质水溶液时,阳极放电顺序为:活泼金属阳极(Au、Pt除外)〉萨>1>Br>C1>0H>含氧酸根离子和产。即位于前边的还原性强的微粒优先失去电子。只要有水,含氧酸根离子和F-就不能失去电子。阴极:Ag+>Hg2>>Fe3+>Cu2+>H*>Pb2>Sn2+>Fe2">Zn2'>Al3+>Mg2+>Na+>Ca2+>K+即位于而边的氧化性强的微粒优先得到电子。只要有水,一般H后而的离子不能得到电子。例1•用铀电极电解含物质的量浓度相同的F『、Fe3\FT的混合溶液时,优先在阴极上还原的是()oA・Cu2+B.Fe2+C・Fe3+D.H*(选C)1.优先氧化原理若某一溶液中同吋含有多种还原性物质,则加入一种氧化剂吋,优先氧化还原性强的物质。例2.向100mL含0.005mol/LK1和0.005mol/LKBr的混合溶液中通入标准状况下的CL56mL,生成物为()。A.KC1和Br2B.KC1和I2C.KC1和B“、I2D.Br2解:因为还原性r>Br_,所以优先氧化「,刀(「)二0.005X0.1二0.005mol,/7(C12)=56/22400=0.00025mol,由2厂+C12=L+2C「知匸和CL刚好反应完。BF末反应,选B。2.优先还原原理若某一溶液中同吋含有多种氧化性物质,则加入一种还原剂吋,优先还原氧化性强的物质。例3.在含有Cu(NO3)2>Zn(N03)2、陀(池)3、AgNO;i各0.01mol的酸性混合溶液中加入0.01mol铁粉,经搅拌后发生的变化应是()。A.铁溶解;析出0.01molAg和0.005molCuB.铁溶解,析tB0.01molAg并放出H2C.铁溶解,析出0.01molAg,溶液中不再有F*D.铁溶解,析出O.OlmolAg,溶液中不再有Cu2\\n解:因为氧化性Ag*>Fe3+>Cu2+>H\所以先发生:2Ag'+Fe=2Ag+Fe2'再发生:2Fe"十Fe=3Fe210.Olmol0.005mol0.01mol0.005mol0.Olmol故选C。1.优先沉淀原理若某一溶液中同时存在儿种能与所加试剂形成沉淀的离子,则溶解度(严格讲应为溶度积)小的物质优先沉淀。例4.向KC1、NaBr、KI混合溶液中逐渐加入AgNO3溶液时,先析出Agl,其次为AgBr,最后为AgClo2.优先吸附原理任何固体都有吸附气体和液体的特性。但不同的固体物质对不同的气体或液体吸附能力不同,吸附能力大者优先吸附。例5.将活性炭粉末投入到枪和02的混合气体中,活性炭会优先吸附N0?,而留下02,因为活性炭对有色气体和有色物质吸附能力很强,制糖工业中常用活性炭使糖浆脱色。又如金属tE(Pd)对出的吸附能力就很强,常温卜T体积锂能吸收700体积以上的H2o3.优先吸收原理用干燥剂干燥气体或用液体净化气体时,优先吸收溶解度大的气体或易被吸收的气体。例6.实验室制CL时,C12中常混有少量HC1,为除去IIC1,常把C12和HC1的混合气体通入饱和食盐水,因为HCI在水中溶解度大,所以优先被吸收,CL只有少量损耗。又如实验室制得的乙酸乙醋蒸气屮常混侑少最乙酸和乙醉,将混合气体通入到饱和Na2C0;i溶液中,乙酸和乙醇优先被吸收。4.优先中和原理若某一溶液中同时含有儿种酸性物质(或碱性物质),当加入一种碱(或酸)时,酸性(或碱性)强的物质优先被中和。例7.给NaOH>Nazg的混合溶液中加入盐酸时,先发生:NaOH十HCl=NaCl+H20\n再发牛:N/COs十HCI二NaHCOs十NaCl最后发生:NaHCOs+HCl二NaCl十CO2十H20化学上常利用此原理和酚瞅、甲基橙双指示剂测定烧碱的纯度。当第一•和第二个反应完成时酚猷变色,第三个反应完成时甲基橙变色。1.优先排布原理在多电子原子里,电子的能量不相同。离核愈近,能量愈低。电子排布吋,优先排布在能最较低的轨道上,待能量低的轨道排满之麻,再依次排布到能最较高的轨道上去。例&20号元索钙的电子排布:(1)电子排布式:20Cals22s22p63s23p64s2(2)轨道表示式:2.优先挥发原理当蒸发沸点不同的物质的混合物时:低沸点的物质优先挥发(有时亦可形成共沸物)。例9.将100g36%的盐酸蒸发掉10g水后关于盐酸浓度的叙述正确的是()。A.增大B.变为40%C.变小D.不变・解析:因为HC1的沸点比水低,当水被蒸发时,HC1已蒸发掉了,所以选C。再如,石油的分憾,先挥发出來的是沸点最低的汽油,其次是煤油、柴油、润滑油等。3.优先书写原理大多数冇机反应(亦冇少数无机反应),反应物相同,在同一条件下可发生多个平行反应。但写方程式时,要写主要产物。例10.这两个反应除各口温度下的主耍生成物外,产物述有CH£H0、CHsCOOH、S02、co、CO2、C等。11・优先溶解原理若一•种试剂加入到含有多种沉淀的混合物中时,溶解度人的物质先溶解。例]1•在AgCl、AgBr.Agl沉淀的混合物中加入浓氨水,AgCl先溶解,而AgBr、Agl则不溶。因为AgCl的溶解度比AgBr、Agl大,AgCl电离出的[AgJ大,AgCl(固)=Ag++CrAg^+2NH3\n・比0二[Ag(NH3)2]++2H20同理给AgBr、Agl的混合物中加入Na2S203溶液,AgBr溶解。11.优先结晶原理当将含冇多种微粒的溶液蒸发掉一定量溶剂或改变溶液温度(一般为降温)时,溶解度小或溶解度变化大的物质优先析出。例12.取100克水,配成100°C时KC1饱和溶液,又取50克水加入35.4克NaNOs配成溶液。将这两种溶液混合后,在10CTC时有晶体析出,试计算析出的是什么晶体?(已知100°C时各物质的溶解度为:KCI31g、NaNOs80g、KNO320.9g、NaCl35.8g)解:KCINaNO;{KXO:1NaCl100C时150g水中可溶解各46.5g120g31.35g53.7g物质溶液中现冇31g35.4g42.3g24.3gKC1+NaNO3=KNO3+NaCl74.58510158.53135.4X列式解之x=42.3(g)y=24.3(g)KNO3优先析出O析出量为42.3-31.35=10.95(g)此题实质是溶液中存在着K+、Na\NO八C「四种离子,可以自由组合成KC1、NaN03>KNO:,、NaCl四种物质。因温度变化时,心。3首先达到过饱和状态,所以KNO:,优先析出。12.优先操作原理(1)装置安装:从下到上,从左到右。(2)加物质,先固后液。\n(1)制气体:先验气密性,再装笏品(一般)。(2)气体净化:先洗气净化,再干燥。(3)制气结束:先撤导气管,再撤灯。(4)可燃性气体:先验纯度,再点燃。(5)比述原CuO的实验:实验开始先通氢,排净空气再点灯,实验结束先熄灯,试管冷却再停红。11.优先鉴别原理鉴别多种物质时:先用物理方法(看颜色,观状态,闻气味,观察溶解性);再用化学方法:固体物质一般先溶解配成溶液,再鉴别;用试纸鉴别气体要先润湿试纸。例13.不用任何试剂,也不用焰色反应,如何鉴别NaNOs、BaCl2>MgSO,.NaOH>FeCh溶液。解析:可先观察出FeCL再以FeCh为试剂鉴别出NaOH,然后以NaOH为试剂鉴别出MgSO目,以MgSO,为试剂鉴别出BaCL最后余下的是NaNO:.12.优先吸引原理①极性分子与极性分子间作用力〉极性分子和非极性分子间作用力>非极性分子和非极性分子间作用力.②化学键〉氢键〉分了间作用力.③组成和结构相似的共价型分子,分子量愈大,分子间作用力愈人。16.优先考虑原理中学化学中的许多问题是对立统一的,存在着矛盾的主耍方面和次耍方而。所以我们考虑问题时,不但要全面分析,而且要优先考虑主要方而。.例14•比较物质熔沸点时,先考虑晶体类型,再考虑晶体内部微粒间的作用力,-•般:原子晶体〉离子品体〉分子晶体。例15.比较微粒半径时,先考虑电子层,再考虑核电荷数。如0八Cl、S2\Br\I的半径\n从小到大的顺序应为:02\CT、S2\Br\Io熟记化学中的这些“不一定”(河北省邱县第一中学李淑景)1.原子核不一定都是由质子和中子构成的。如氢的同位素(油)中只有一个质子。2.酸性氧化物不一定都是非金属氧化物。如Mn2O7^HMnOi的酸肝,是金属氧化物。3.非金属氧化物不一定都是酸性氧化物。如CO、NO等都不能与碱反应,是不成盐氧化物。4.金属氧化物不一定都是碱性氧化物。如MriA是酸性氧化物,AI2O3是两性氧化物。5.电离出的阳离子都是氢离子的不一定是酸。如苯酚电离出的阳离子都是氢离子,属酚类,不属于酸。6.由同种元素组成的物质不一定是单质。如金刚石与石墨均由碳元素组成,二者混合所得的物质是混合物;由同种元素组成的纯净物是单质。7.晶体中含冇阳离了不一定含冇阴离了。如金属晶体中含冇金属阳离了和自由电了,而无阴离子。8•有单质参加或生成的化学反应不一定是氧化述原反应。如金刚石一石墨,同素异形体间的转化因反应前后均为单质,元素的化合价没有变化,是非氧化还原反应。9.离子化合物中不一定含有金属离子。如NH&1属于离子化合物,其中不含金属离子。10.少水反应生成酸的氧化物不一定是酸阡,与水反应生成碱的氧化物不一定是碱性氧化物。如池能与水反应生成酸一硝酸,但不是硝酸的酸酹,硝酸的酸酹是20"总心能与水反应生成碱一NaOH,但它不属于碱性氧化物,是过氧化物。11.pH=7的溶液不一定是中性溶液。只有在常温时水的离了枳是1X10",此时pll=7的溶液才是中性。12•用pH试纸测溶液的pH时,试纸用蒸懈水湿润,测得溶液的pH不一定有误差。13•分了晶体中不一定含冇共价键。如稀冇气体在固态时均为分了晶体,不含共价键。\n14•能使品红溶液褪色的气体不一定是S02,如C12、0,均能使品红溶液褪色。15.金属阳离了被还原不一定得到金属单质。如F/可被还原为Fe2\16•某元素由化合态变为游离态时,该元素不一定被还原。如2氏0=2氏f+。2t,氢元素被述原而氧元素被氧化。17•强氧化物与强还原剂不一定能发生氧化还原反应。如浓硫酸是常见的强氧化剂,氢气是常见的还原剂,但可用浓硫酸干燥轼气,因二者不发生反应。1&放热反应在常温下不一定很容易发生,吸热反应在常温下不一定不能发生。如碳与氧气的反应为放热反应,但须点燃;Ba(0H)2-8H20与\HC1反应为吸热反应,但在常温卞很容易发生。19.含金属元素的离子不一定都是阳离子。如A10,o20.最外层电子数大于4的元素不一定是非金属元素。如周期表中IVA、VA、VIA中的金属元素最外层电了数均多于4个。21.不能在强酸性溶液屮人最存在的离子,不一定能在强碱性溶液屮人量存在。如HCO八HS'等离子既不能在强酸性溶液中大量存在,也不能在强碱性溶液中大量存在。22•组成和结构相似的物质,相对分了质量越大,熔沸点不一定越高。一般情况下该结论是正确的,但因出0、HF、NH,等分子间能形成氮键,熔沸点均比同主族元素的氮化物高。23.只由非金属元素组成的晶体不一定属于分子晶体。如NHiCl属于离子晶体。24•只含有极性键的分子不一定是极性分子。如CCh、CO2等都是含有极性键的非极性分子。25•铁与强氧化性酸反应不一定生成三价铁的化合物。铁与浓硫酸、硝酸等反应,若铁过量则生成亚铁离子。26•具有金属光泽并能导电的单质不一定是金属。如石墨、硅都具有金属光泽,它们属于非金属单质。27.失去电子难的原子获得电子的能力不一定强。如稀有气体原子既不易失去电子也不易得到电子。28•浓溶液不一定是饱和溶液,饱和溶液不一定是浓溶液。如KNO:,的浓溶液不一定是饱和溶液,因KN03的溶解度较大;Ca(OH)2的饱和溶液浓度很小,因Ca(OH)2微溶于水。\n29.强电解溶液的导电能力不一定强。导电性的强弱与溶液中口由离子的浓度大小有关,如果某强电解质溶液的浓度很小,那么它的导电性可以很弱,而某弱电解质虽然电离程度小,但如果离子浓度大时,该溶液的导电能力也可以较强。30•弱电解质被稀释时,离子浓度不一淀减小。如冰醋酸在稀释时,H)CH£00「浓度先逐渐增大而后减小。31.平衡向止反应方向移动,反应物的转化率不一定增大。32.1mol某气体的体积是22.4L,该气体所处的状态不一定是标准状态。倍受青睐的“硫酸氢钠”(河北冀州中学常焕玲)硫酸氢钠是我们屮学阶段学习的一种重要的强酸酸式盐,以其完全电离的强酸性成为高考命题的重要物质载体。一、硫酸氢钠的性质1、完全电离,强酸性:NaHSO4==Na+H>SO42-可以与弱酸盐发牛复分解反应:NaHSOMaHSO:产N^S0i+S02t+比0NaHS04+NaHC03==Na2S04+C02t+出0涉及离子方程式:H+HSOa二二SO2t+氏0H+HCO3二二CO2t+H2O2、与BaCL、Ba(0H)2反应:NaHSOi+BaCl2==NaCl+HC1+BaS0iINaHS04+Ba(OH)2==Na0H+H,0+BaS0.1I涉及离子方程式:S042_+Ba2+==BaS04IH++S042+Ba2++0H_==BaS041+H20如果Ba(OH)2少量,则方程式表示为:2H'+S042'+Ba2++20H==BaS041+2H20二、典题回放:1、向硫酸氢钠溶液中滴加氢氧化顿溶液,溶液的pH与生成的沉淀关系如图所示,止确的是:\n适淀)逝淀)适淀)班沉淀)解析:向硫酸氢钠溶液中滴加氢氧化顿溶液,溶液达到中性时(2:1反应),SO/还未沉淀完金,继续加入氢氧化顿溶液,当SO产沉淀完全时(1:1反应),溶液已成碱性。随着氢氧化顿溶液的加入,硫酸顿沉淀不会消失。选A。2、冇两种无机盐A和B,其相对分了质量均为120,为了确定A和B,将他们分别溶于水制成溶液进行卜•列实验。①将两种溶液混合,立即产牛一种易溶于水易液化的气体;②在两种溶液中分别加入BaCl2溶液,A溶液无沉淀产生,B溶液冇白色沉淀产生;③在两种溶液中分别加入Ba(0H)2溶液均有白色沉淀产牛。试推断A和B的化学式解析:两种盐混合产生易溶于水易液化的气体,由气体的明显特征推断是S02,根据复分解反应原理,这两种盐为硫酸氢盐和亚硫酸(氢)盐,②③两步实验,两种盐与BaCl2.Ba(0H)2不同实验现象确定A为亚硫酸氢盐,最后根据相对分子质量均为120,推断A和B的化学式分别为KHS03和NaHS04o3、A、B、C、D、E均为nJ溶于水的固体,组成他们的离子有阳离子Na+Mg2+Al3+Ba2+阴离子oircrco.,2-so,2-usor分别取它们的水溶液进行实验,结果如下:©A溶液与B溶液反应生成白色沉淀,沉淀口J溶于E溶液;②A溶液与C溶液反应生成白色沉淀,沉淀口J溶于E溶液;\n②A溶液与D溶液反应牛:成口色沉淀,沉淀可溶于盐酸;③B溶液与适量D溶液反应生成口色沉淀,加入过量D溶液,沉淀量减少,但不消失。据此推断它们是A;B;C;D;Eo解析:本题A物质为焦点物质,与B、C、D都能牛成白色沉淀,且沉淀能溶于E或盐酸,八为碳酸钠,E物质能溶解两种沉淀,一定具有酸性,为硫酸氢钠;④的反应有很鲜叨的特征,B与适量D溶液反应牛成口色沉淀,加入过量D溶液,沉淀量减少,但不消失,则B、D一定生成两种沉淀,B为硫酸铝,D为氢氧化顿;剩下和Cl,C为MgCl2o参考答案:Na2C03>A12(S04)3、MgCl2>Ba(0H)2.NaHSO,NaHSO.在历年高考题中先后重复出现,暗示了这种物质性质的独特性和多面性,关注它的诸多性质,会使我们在学习屮增长必备的知识和能力。高考化学等效平衡解题技巧(河南处力学校张朝利)在一定条件(恒温恒容或恒温恒压)下,同一可逆反应体系,不管是从正反应开始,还是从逆反应开始,在达到化学平衡状态时,任何相同组分的含量(体积分数、物质的量分数等)均相同,这样的化学平衡互称等效平衡(包插“相同的平衡状态”)。概念的理解:(1)外界条件相同:通常可以是①恒温、恒容,②恒温、恒压。(2)“等效平衡”与“完全相同的平衡状态”不同:“完全相同的平衡状态”是指在达到平衡状态时,任何组分的物质的最分数(或体积分数)对应相等,并且反应的速率等也相同,但各组分的物质的量、浓度可能不同。而“等效平衡”只要求平衡混合物中各组分的物质的量分数(或体积分数)对应相同,反应的速率、压强等可以不同。(3)平衡状态只与始态有关,而与途径无关,(如:①无论反应从正反应方向开始,还是从逆反应方向开始②投料是一次还是分成几次③反应容器经过扩人一缩小或缩小一扩人的过程,)只要起始浓度相当,就达到相同的平衡状态。二、等效平衡的分类在等效平衡中比较常见并且重要的类型主要冇以下三种:I类:恒温恒容下对于反应前后气体体积发生变化的反应來说(即△/()的体系):等价转化后,对应各物质起始投料的物质的量与原平衡起始态相同。\nII类:恒温恒容下对于反应前后气体体积没有变化的反应來说(即△会0的体系):等价转化麻,只要反应物(或生成物)的物质的量的比例与原平衡起始态相同,两平衡等效。III类:恒温恒压下对于气体体系等效转化后,只要反应物(或主成物)的物质的量的比例与原平衡起始态相同,两平衡等效。解题的关键,读题时注意勾画出这些条件,分清类别,用相应的方法求解。我们常釆用“等价转换”的方法,分析和解决等效平衡问题三、例题解析I类:在恒温恒容下,对于化学反应前后气体体积发生变化的对逆反应,只改变起始加入物质的物质的最,如果通过可逆反应的化学计最数Z比换算成化学方程式的同•边物质的物质的量与原平衡相同,则两平衡等效。反应,230八0=例1:在一・定温度下,把2molSO2和1molO2通入一定容积的密闭容器屮,发生如下当此反应进行到一定程度时反应混合物就处于化学平衡状态。现在该容器中维持温度不变,令a、b、c分别代表初始吋加入的旳沪°少卩的物质的量(mol),如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡状态时,反应混合物中三种气体的百分含量仍跟上述平衡完全相同。请填空:(1)若a二0,b二0,则c=0(2)若a=0・5,贝ljb二,c=o(3)a.b、c的取值必须满足的一般条件是,o(请用两个方程式表示,其中一个只含a和c,另一个只含b和c)解析:通过化学方程式:汕—v280孚可以看出,这是一个化学反应前后气体分子数不等的可逆反应,在定温、定容卜•建立的同j化学平衡状态。起始吋,无论怎样改变的,的物质的量,使化学反应从正反应开始,还是从逆反应开始,或者从正、逆反M同时开始,它们所建立起来的化学平衡状态的效果是完全相同的,即它们之间存在等效平衡关系。我们常采用“等价转换”的方法,分析和解决等效平衡问题。(1)若a=0,b=0,这说明反应是从逆反应开始,通过化学方程式3可以看出,反应从2molSO3开始,通过反应的化学计量数之比换算成皿債和°力的物质的\n量(即等价转换),恰好跟反应从2molSO?和1molO2的混合物开始是等效的,故c二2。(2)|1|于a二0.5<2,这表示反应从正、逆反应同时开始,通过化学方程式2SO〉十°力=妙卩可以看出,要使0.5molSO2反应需要同时加入0.25mol0?才能进行,通过反应的化学计量数之比换算成SO:,的物质的量(即等价转换)与0.5molSO3是等效的,这吋若再加入1.5molSO3就与起始时加入2molSO3是等效的,通过等价转换可知也与起始时加入2molSO2和1molO2是等效的。故b二0.25,c=L5o平衡。由化学方程式占0・十°2三(3)题中要求2molSO?和1mol0?要与amolSO八bmolO2和cmolSO3建立等效事可知,cmolSO3等价转换后与cmolSO2和Q—mol042等效,即是说,吟和碣)™401与amoiSO2、bmol0丄和cmolC84-C"2b+—・1SO3等效,那么也就是与2molSO2和1molO2等效。故有2II类:在恒温恒容下,对于反应前后气体体积不变的可逆反应,只要反应物(或生成物)的物质的量之比与原平衡相同,则两平衡等效。例2:在一个固定容积的密闭容器小,保持一定的温度进行以下反应:卄Br(^已知加入1molH2和2mol时,达到平衡后生成amolHBr(见下表已知项),在相同条件下,且保持平衡时各组分的体积分数不变,对下列编号①〜③的状态,填写下表小的空白。起林觀tntufifl便n(dmI)¥KtfHBrnunnsn(mol)HjHBrSB号\120aQ2401(L5am解析:在定温、定容下,+建立起化学平衡状态,从化学方程式可以看出,这是一个化学反应前后气体分了数相等的町逆反应。根据“等价转换”法,通过反应的化学计量数之比换算成同一•边物质的物质的量之比与原平衡相同,则达到平衡后与原平衡等效。\n①因为标准项中刀(眄起始):n(凸力起始):n(HBr平衡)二1:2:a,将n(比起始)二2mol,n(Be起始)二4mol,代入上式得刀(HBr平衡)=2ei。②参照标准项可知,n(HBr平衡)二0.5amol,需要n(H2起始)二0.5mol,n(Br?起始)=1mol,n(HBr起始)=0mol0而现在的起始状态,已冇1molIIBr,通过等价转换以后,就相当于起始吋有0.5mol出和0.5mol的混合物,为使刀(出起始):(Br2起始)=1:2,则需要再加入0.5molBe就可以达到了。故起始时出和的物质的量应为0mol和0.5molo③设起始时HBr•的物质的量为xmol,转换成出和B“后,则出和B“的总量分别为解设平m-i-—g★兰):(g+^)"1:2(2)mol和(2)mol,根据22衡时HBr的物质的最为ymol,则有2,解得y■磁F)。III类:在恒温恒压下,改变起始时加入物质的物质的量,只要按化学计量数Z比换算成化学方程式的同一边物质的物质的量之比与原平衡相同,达到平衡状态后与原平衡等效。例3:如图所示,在一定温度下,把2体积N?和6体积乩通入一•个带有活塞的容积可变的容器中,活塞的一端与大气相通,容器中发生以下反应:N3+3H3^»«5(正反应放热),若反应达到平衡后,测得混合气体的体积为7体积。据此回答下列问题:(1)保持上述反应温度不变,设a、b、c分别代表初始加入的际出和的体积,如果反应达到平衡后混合气体中各气体的体积分数仍与上述平衡相同,那么:①若a=l,c二2,贝ijb二o在此情况下,反应起始时将向(填“正”或“逆”)反应方向进行。②若需规定起始时反应向逆反应方向进行,则c的取值范围是。(2)在上述装置中,若需控制平衡后混合气体为6.5体积,则可采取的措施是,原因是。解析:(1)①化学反应:=生在定温、定压下进行,要使平衡状态与\n原平衡状态等效,只要起始时呱)°就町以达到。已知起始时各物质的体积分别为1体积N2、b体积比和2体积皿―根据“等价转换”法,将2体积刚事通过反应的化学计量数之比换算成弘和吗的体积,则相当于起始时有(1+1)体积2和(b+3)体积1»12它们的比值为,解得b=3。因反应前混合气体为8体积,反应后混合气体为7体积,体积差为1体积,由差量法可解出平衡时皿事为1体积;而在起始时,**事的体积为c=2体积,比平衡状态时人,为达到同一平衡状态,皿,的体枳必须减小,所以平衡逆向移动。②若需让反应逆向进行,由上述①所求出的平衡时朋尊的体积为1可知,朋<的体积必须大于1,最大值则为2体积N?和6体积完全反应时产生的皿事的体积,即为4体积,则Kci2o(2)由6.5<7可知,上述平衡应向体积缩小的方向移动,亦即向放热方向移动,所以采取降温措施。例4:(一),恒温、恒压下,在一个容积可变的容器屮发生如下反应:\n(1)若开始时放入1molA和1molB,达到T:衡后,生成amolC,这时A的物质的量为molo(2)若开始时放入3molA和3molB,达到平衡后,生成C的物质的量为mol0(3)若开始时放入xmolA、2molB和1molC,达到平衡后,A和C的物质的最分别为ymol和3amol,则x二,y二。平衡时,B的物质的量(填编号)。(甲)大于2mol(乙)等于2mol(丙)小于2mol(J)可能大于、等于或小于2mol(4)若在(3)的平衡混合物小再加入3moiC,待再次达到平衡后,C的物质的量分数是o(二)若维持温度不变,在一个与(一)反应前起始体积相同,且容积固定的容器中发生上述反应。(5)开始时放入1molA和1molB到达平衡后生成bmolC。将b与(1)小题中的a进行比较(填编号)。(甲)a>b(乙)anol+(l-a>nd+amd2-b也就是在(3)的平衡状态时C的物质的最分数。(二)(5)因此时容器的容积不变,而(1)中容器的容积缩小,(5)小题中容器相当于在(1)的基础上减压,则平衡逆向移动,故反应达到平衡后Q>b,即应填(甲)。新理念新教材新实验(山东省莘县实验高中李银方)高考屮化学实验题的考杳一直是备受关注的对象,特别是实行新课标以來,各地对高考中实验的研究更是加大了力度。近两年高考实验题的命题形式多种多样,但从试题的信息、命题的形式以及所涉及的内容上我们都可以找出教材中的影子,因此加大对教材中的实验的研究是提高化学实验的一个重要方向。纵观这两年的考查,与教材有关的实验题目主要有以下四种形式。1.教材不同性质实验进行组合这一类题目有以下几个特点①考杳的内容来源于教材②同时考杏多个性质③把教材屮的性质以实验的形式呈现出来。例如:(2008天津卷13).下列实验方法合理的是A、可用水鉴别已烷、四氯化碳、乙醉三种无色液体B、汕脂皂化后可用渗析的方法使高级脂肪酸钠和甘汕充分分离C、可用澄清石灰水鉴别NmCOs溶液和NaHCO:,溶液D、为准确测定盐酸与NaOH溶液反应的中和热,所用酸和碱的物质的量相等\n解析A;三种物质和水混合后,己烷在水的上层,四氯化碳在水的下层,乙醇不分层,所以口J以用水鉴别三者,故A项正确;油脂皂化后应用盐析的方法,是高级脂肪酸钠和廿油分离,所以B错;Na2C03和NaHCOs和Ca(0H)2反应,均可产生Cag沉淀,故C项错误;为了使反应充分进行,应使一方过量,而不是使二者物质的量相等,所以D错。点评:组合题具有两人特点,一是知识的容量大,能够很好的覆盖知识要点,如本题虽然是一个选择题,但四个选项分别来白于四人模块和知识,而且考杳的角度也不相同,可以满足综合考试屮题量小,考杏的范围人的要求。二是思维的跨度人,能够很好的才杏学生的对知识、信息的应用能力。因此在学习和复习时要勤于总结,并尽可能的将不模块的知识通过化学基本理论联系起來。1.教材原有实验进行改进这一类题的特点是利用教材小原有的实验进行改进,既來源于课本,但乂高于课本;既考查了棊础知识,又考查了基木技能;很适合于这几年理综试题的要求,所以在这几年的高考题中这一类试题频繁出现。例(2007上海16)某学生设计了一个“黑笔写红字”的趣味实验。滤纸先用氯化钠、无色酚瞅的混合液浸湿,然后平铺在一块钳片上,接通电源后,用铅笔在滤纸上写字,会出现红色字迹。据此,下列叔述正确的是()。A铅笔端作阳极,发生述原反应C铅笔端有少量的氯气产牛B釦片端作阴极,发生氧化反应Da点是负极,b点是正极解析:D;从题目中给出的倍息我们可以看出,铅笔写过的地方会出现红色字迹,说明铅笔附近溶液呈碱性,而在电解氯化钠溶液时阴极附近溶液呈碱性,所以铅笔与电源的负极相连,即a点是电源的负极,b点是电源的正极。点评:本题是对课木电解氯化钠溶液实验的一个改进,首先对电极进行了改进,铅笔中含有石墨,能够导电作电极。同吋以字迹的颜色说明电极种类是另一个改进的地方。此题要求学牛•対电解的基础知识非常牢固,并能够应用题目中给岀的最新的信息处理问题,这是对学生能力的考查。2.教材原有化学性质进行改编这一类题目的特点是题目中的实验不是教材屮要求的必作实验,而是某种物质的性质,在原有知识的基础上进行挖掘探究,进而在实验中进行验证。题冃中考查的都是最基本的内容,但由于题意比较新,导致学生很难得高分。例(2008广东21)某种催化剂为铁的氧化物。化学兴趣小组在实验宗对该催化剂中铁元素的价态进行探究:将适量稀硝酸加入少许样品屮,加热溶解;取少许溶液,滴加KSCN溶液后出现红色。一位同学由此得出该催化剂中铁元素价态为+3的结论。\n(1)请指出该结论是否合理并说明理由0(2)请完成对铁元素价态的探究:限选实验仪器与试剂:烧杯、试管、玻璃棒、药匙、滴管、酒粹灯、试管夹:3mol・!/昭0/3%H2O2、6mol•L_1HNO3/O.01mol•L_1Kmn04>NaOH稀溶液、0.1mol•L1KI、20%KSCN、蒸镭水。①提出合理假设假设1:;假设2:;假设3:o②设计实验方案证明你的假设(不要在答题卡上作答)③实验过程根据②的实验方案,进行实验。请在答题卡上按卜•表格式写出实验操作步骤、预期现彖与结论。实验操作预期现象与结论步骤1:步骤2:步骤3:•••解析:(1)由于加入的硝酸具有很强的氧化性,能够将亚恢离子氧化成三价的铁离子,所以得出的结论不正确。(2)进行假设时一•定要全而,由于没有给出具体的性质,有三种可能,一是只有亚铁离了,二是只冇三价的铁离了,三是二者均冇。如果要进行验证,可根据两种离了的性质进行鉴别,亚铁离了具冇较强的还原性,三价铁离了与硫貳化钾反应呈红色。同时要注意二者之间的干扰。答案:(1)该结论不正确。稀HNO:,有强氧化性,若该铁的价态为+2价,则被氧化为+3价同样口J使KSCN溶液变血红色。(2)假设1:催化剂中铁元素的价态为+3价。假设2:催化剂屮铁元素的价态为+2价。假设3:催化剂中铁元素的价态既冇+3价也冇+2价。③实验过程\n实验操作预期现象与结论步骤1:将话暈稀FbSO,加入少许样品于试管中,加热溶解;溶液呈黄绿色,说明溶液中含或FeJ步骤2:取少量溶液,滴加酸性KMnCh溶液。若KHnO;溶液的紫红色褪去为无色溶液,则说明催化剂中铁元素的价态含+2价;若不褪色,则说明催化剂中铁元素的价态不含+2价。步骤3:另取少量溶液,滴加KSCN溶液。若溶液变为血红色,则说明催化剂屮铁元索的价态含+3价;若溶液无明显变化,贝说明催化剂中铁元素的价态不含+3价。点评:亚铁离子和三价的恢离子是中学化学中常见的两种离子,亚铁离子的还原性,三价铁离子为硫氧化钾反应呈红色,这是两条最基本的性质,学生非常熟悉,本题就是用这两条最基本的性质设计成的实验题,考査了实验方案的设计、物质成份的预测以及实验结论正误判断等多项实验知识。将常见物质的性质改编成实验题,使题目耳目-•新,同时对于我们平时的学习也捉出了新的耍求,要改变原来注重化学方程式的学习为实用性学习,耍在平吋的学习小养成对物质性质的探究的习惯。1.教材中实验的再设计——新课标下的化学实验考查的又一新方向2007年是山东省实行新课标以来的第一次高考,在考试大纲中要求“(6)能根据实验试题要求,做到:①设计、评价或改进实验方案;②了解控制实验条件的方法;③分析或处理实验数据,得出合理结论;④绘制和识别典型的实验仪器装宜图。”从2007的考杳试题来看,这一求是通过对教材中的实验进行再设计來实现的。例如:(2007山东省)29.(15分)铁及铁的化合物应用广泛,如FeCls可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。(1)写出FeCL溶液腐蚀印刷电路铜板的离了方程式o(2)若将(1)中的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式:正极反应,负极反应O(3)腐蚀铜板后的混合溶液中,若CutFe3+和Fe'+的浓度均为0.10mol•L、请参照下表给出的数据和药品,简述除去CuCL溶液中Fe"利Fe^的实验步骤:氢氧化物开始沉淀时的pH氮氧化物沉淀完全时的pHb'e3+1.93.2\nFe2+7.09.0Cu2+4.76.7提供的药品:C12浓II2SO4NoOII溶液CuOCu(4)某科研人员发现劣质不锈钢在酸屮腐蚀缓慢,但在某些盐溶液屮腐蚀现象明显。请从上表提供的药品屮选择两种(水可任选),设计最佳实验,验证劣质不锈钢易被腐蚀。有关反应的化学方程式劣质不锈钢腐蚀的实验现象:o解析:第(2)是将我们熟悉的一个化学反应设计成原电池的形式笫;(3)小题是根据要求设计实验方案除去杂质离了;第(4)小题是根据要求设计一个验证实验。这三个小题都是设计题,笫(2)小题是根据课本中的一个常见的离子反应设计;第(3)小题是课本屮的一个习题的再设计;第(4)小题是铜锌原电池的一个变形应用,本小题要求设计最佳实验方案,而几是根据所给的试剂,大大提高了题的难度。题意中隐含了是要验证“验证劣质不锈钢易被腐蚀”的环境应是“盐溶液中”。而给出的试剂中乂没有盐溶液,需要学生根据所给的试剂配制,从题目屮给出的试剂来看可以得到硫酸铜、氯化饰、次氯酸钠等几种盐,而得到硫酸铜的方案乂有好儿个,这是本题的难点,同时考杳了学生能能不能在探究小获得结果科学方法。答案:29・(l)2Fe3++Cu=2Fe2+4-Cuz+(2)装直图FcCb溶液正极反应:Fe"+e=Fe21(或2Fe31+2e~=2Fe21)负极反应:Cu=Cu2*+2e(或Cu—2e=Cu2*)(3)①通入足量氯气将Fe2+氧化成Fe3②加入CuO调节溶液的pH至3.2〜4.7;③过滤[除去Fe(0H)3]\n(3)CuO+HAO—CuSOj+HECuSO1+Fe=FeSO1+Cu,不锈钢表面有紫红色物质生成。点评:第(4)小题虽然是木年度化学失分最多的地方,但我们可以看出,学生失分的主要原因是基础知识不牢固,方法不合理,不能注重实验方案的最优化。如果我们平时能注重对基木的化学反应的理解,木题目做满分还是完全能达到的。教材是我们学习的根本,高考试题总是以课本为模板的,只耍我们深入的去理解教材中的知识,养成正确的研究问题的方法,形成科学的思维,就一定能培养出符合社会要求的能力,在高考小也能灵活应对。时政热点聚焦2008高考化学(江西吉安一中胡金华)2008年的《考试大纲》中明确指出,理综命题“耍重视理论联系实际,关注科学技术、社会经济和生态环境的协调发展”、“要重视对考住科学素养的考查”o因此,联系生产生活、体现STSE(科学、技术、社会与环境)Z间密切联系的试题正是高考FI的的反映与要求。高考命题利用多种情境索材,结介图形、图表的数据分析,从这些真实情境引发的问题进行一系列设问,摒弃了虚拟的、不真实的情境,使命题更加贴近生产生活实际,同时渗透对考生情感、态度与价值观的引导。主要体现在以下四个方而:一、关注北京奥运选取社会热点事件北京奥运题材,不同程度地选择了以“奥运”作为情景命题,全面考查奥运场馆(水立方、鸟巢)材料、环境保护方而。如08北京理综卷第5题“绿色奥运”氢氧燃料电池、08全国理综卷II第6题和08山东理综卷第29题“祥云火炬燃料”。化学“奥运题”可以就“福娃”、“兴奋剂”的材料结构和性质设问,考查冇机物知识。【例1】(2008全国卷II,6)2008年北京奥运会的“祥云”火炬所用燃料的主要成分是丙烷。下列有关丙烷的叙述不疋确的是()。A.分了中碳原了不在一条直线上R.光照下能够发生取代反应C.比丁烷更易液化D.是石汕分馆的一种产品【解析】本题考杳的是烷怪的性质以及石汕分饰的相关内容,烷泾的结构并不是呈直线的而是钢齿状,故A正确。在光照的条件下烷坯能发生取代反应故B正确。石油分憎的产物是饱和坯以及芳香怪故D正确。内烷沸点比丁烷低,比丁烷难液化,所以木题选C。【答案】C【命题探究】“奥运题”只是运用与奥运有关的话题把想考的知识点引申出來而己。这个题目屮的笫一句话即使没有,也一点都不影响作答,因而考牛只耍理解透题意,调出脑\n子里储备好的基础知识,即可游刃有余地解出此题。二、关注生活选取与口常生活、社会生产和社会发展密切相关的化学知识内容作试题素材,强调化学科学对人类发展、经济发展、人类进步以及人类健康质量、生活质量及坏境质量的作用,以体现化学少人类社会的紧密关系。08年江苏化学卷笫1题化学热考查生活中的应用、08宁夏理综卷第7题图标、08北京理综卷第5题“绿色奥运”氢氧燃料电池、08天津理综卷笫7题合成技术、08重庆理综第6题物质的氧化、08广东理科基础第22题废弃物合理利用、08广东化学卷第15题用碘钩灯的转变来加深对化学平衡、化学反应的条件、物质稳定性的理解。【例2】(2008江苏,1)化学与生活、社会密切相关。下列说法不止确的是()。九利用太阳能等清洁能源代替化石燃料,有利于节约资源、保护坏境B.凡含冇食品添加剂的食物对人体健康均冇害,不叮食用C.为防止电池中的金属等污染土壤和水体,应积极开发废电池的综合利用技术D.提倡人们购物时不用塑料袋,是为了防止口色污染【解析】本题主要考查化学与牛活的密切联系。A、C、D答案均正确。对■于食甜中的添加剂只要适量即可,并不是不可食用。【答案】B【误区警示】不注意观察生活,不注意联系工活。三、关注工艺流程,拓展渗透化学新知在化学试卷中,利用“工艺流程图”、“操作流程图”、“产品生产问题”、“冇机合成路线或实际反应”等情境素材,结合图形、图表的数据分析,对这些真实情境引发的问题进行一系列设问,使考题更加贴近生产生活实际,让考牛感到真实、亲切,同时渗透对考生情感、态度与价值观的引导。如江苏化学卷第15题污水鼠化合物的含量测定;08山东理综卷第29题北京奥运会“祥云”火炬然料、08广东化学卷第19题工业碳酸钠提纯工艺、08垂庆理综卷第28题冃天然气化工等。【例3】(重庆理综卷,28)天然气化F是重庆市的支柱产业之一.以天然气为原料经下列反应路线可得工程塑料PBT.\n(1)B分子结构小只有一种氢、一种氧、一种碳,则B的结构简式是;B的同分异构体中与葡萄糖具有类似结构的是o(写结构简式)(2)F的结构简式是;PBT属于类有机高分子化合物。(3)由A、D住成E的反应方程式为,其反应类型为o(4)E的同分异构体G不能发生银镜反应,能使汾水褪色,能水解且产物的碳原子数不等,则G在NaOH溶液中发生水解反应的化学方程式是o【解析】木题考查冇机物的结构和性质,注意碳原了个数的守恒关系以及题中信息的应用。根据B物质的化学式GHeOs,环状结构,一种碳、一•种氮、一种氧,所以分子为对称结构,环丙三瞇。B的同分异构体与匍萄糖具有类似结构的是拜基醛的结构,即CH.OH-CHOH—CHOoF含有4个碳原子,A和D生成E用道题给信息,天然气高温分解得到乙烘(D),A是甲醛,所以该反应可以简单认为1mol乙块和2mol甲醛发主题小信息的反应生成OHCH?—C=C—CH2OH,F为饱和二元醇,OHCH2—CH2—CH2—CH2OH,与二元竣酸可以发生缩聚反应牛成高分子化合物。E的同分界构体G不能发牛:银镜反应,能使浪水褪色,水解得到碳原子数不等的两种产物,G中应该含有酯基和碳碳双键,在碱性条件下水解得到丙烯酸钠和甲醉。HO—CHj—CH—CHO0H⑵110—CII2—CIi2—ch2—CII2—011;酯(或聚酯)(3)HC三CH+2HCH0*一HOCFLC三CCHGH;加成反应(4)CH?-CH—C00CH:5+Na0H-CH2=CH—COONa+CH^OH【备考提示】研读题给信息,适吋迁移课木中的知识。四、关注前沿成果,渗透绿色理念\n在高考试题中,创设陌生问题情境的方式主要是把化学发展的前沿知识或与交叉学科有-关科技知识作为背景,从中设计问题。08广东化学卷的第2题用海水资源考査多种常见物质的性质、物质分离、制备•探究的棊本实验技能、08宁夏理综卷26题工业废水提取物质、08山东理综卷30题粗食盐的提纯与电解、08海南化学卷笫29题防止铁的锈蚀、08北京理综卷第5题氮氧燃料电池、08重庆理综卷第26题新型的硝化剂的制备等。【例4】(重庆卷,26)N2O5—是一种新型硝化剂,其性质和制备受到人们的关注.(1)205与苯发生硝化反应生成的硝基苯的结构简式是2NA(g)-MNO2(g)+O,g);△/>()①反应达平衡后,若再通入一定量氮气,则N:A的转化率将.(填“增人”、“减小”、“不变”)②下表为反应在刀温度下的部分实验数据:t/s05001000c(N2O5)/mol5・003.522.48则500s内N2O5的分解速率为③在%温度下,反应10005时测得1\102的浓度为4.98mol・I?,则7;7;.\n(3)题26图所示装置可用于制备N2O5,则N心在电解池的区牛成,其电极反应式为0【解析】本题考查综合考杳硝化化学平衡化学速率的计算、电解等化学基本原理。硝基苯是硝基取代苯环上的氢原了得到的产物,结构简式。恒容密闭容器中N2O5分解达到平衡,再冲入氮气各物质浓度均不变,所以平衡不移动。N2O3的分解速率为二(5-3.52)mol・I「/500s=0.00296mol*L_1・L。1000s时N2O5的分解速率为=(5-2.48)/1000=0.00252,在蛊温度下N02的浓度为4.98mol/L,N2O5的分解速率为二(4.984-2)/1000=0.00249mol・1?・S~l,速率减小,所以兀小于T\°用电解法制备N2O5,NQi失电子被氧化生成它,所以NQs在电解池的阳极生成。电极方程式书写冇些难度,N2O1转化为N2O5增加了氧原了,只能山硝酸提供。0"NO】【答案】(1)(2)①不变②0.00296mol-iJ-g1③或“小于”(3)阴极.N2()4+2HN02-2e「二2弘05+2戌【误区警示】要深入理解平衡移动的因索,主要是浓度、温度和压强;解电化学时要合理运用化合价的变化。总之,平时应该关注H然科学的新成就,但-•般只需关注和了解,不一定要深究,要理性看待热点。大多数情况下,热点问题仅仅是作为素材,考查学牛的还是対学科基础知识的理解和运用能力。对2008年四川理综第27题的探讨(江苏省南京市金陵中学王海富)题冃:A、B、C、D是按原了序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元索与金属元素的原子个数比为1:2。在一定条件下,各物质之间的相互转化关系如右图(图中部分产物未列出)。请填写下列空白:(1)、(2)、(3)略(4)F与G\n的水溶液反应生成I和D的离子方程式是。答案:S2_+Na202+2H.0===40H+SI+2Na+现笔者对该小题及答案有两点看法,在这里和人家探讨下。1.由题意推得D为S,F为嘔02,G为NaS根据电子得失守恒,1molS?被氧化成S需1molNaAo如果NM)?超过1mol,将和水反应生成@。题目没有明确Na?S和NM)2的比值,部分产物未列出。如果没6生成,NazS和1W)2按等物质的量在水中反应生成S和NaOlI,离子方程式同答案;如果有O2纶成而没列出,Na2S.M2O2和水反应的离子方程式将不唯一,相当于两个平行反应的叠加。S2_+Na202+2出0===40H_+SI+2Na+①2Na2O2+2H20二=40H+O2t+4Na*②将(l)X日+(2)X"处理得,<3S2-+(計2方)Na202+2(曰”)氏0=4(曰")0H+於!+方02t+2(曰卜2力)Na,③木题反应物的比值和关键产物都不明确,原答案仅是③的特例。2•向新配制的N/S溶液中加入险02。随着险02的加入,没有观察到S沉淀生成。S能溶于热NaOH溶液,牛成“述和Na2S0;loN/S和NQ2O2在水中反应仝成NaOH并放出大量的热,符合S溶解的条件。△3S+6OH=2S2■+SOa2■+3H>0向部分反应液中加入稀硫酸,溶液很快变成乳口色的浊液。NazSOs和未反应完的bfeS在酸性条件下反应生成S。2S2_+SO32■+6H+===3SI+3出0S,在一定条件下能被N32O2氧化成SO?-S2_+3Na202+3H20===60H+S0产+6Na向剩余的反应液中继续加入过量的Na202(可能会析出白色固体NaOH),反应后分成2份。-•份加入稀盐酸,儿乎没有S牛成;另一份加入盐酸酸化的BaCL溶液,立即生成了口色沉淀。说明中间产物SO/被氧化成SO产。\nS2_+4Na202+4H20===80H■+SO产+8N『上述实验证明S和热NaOH溶液的确发牛了后续反应。S〉被陋。2氧化成SO广或SO产。原题答案中产物为S和NaOII,显然没考虑反应物的量和反应温度升高对实际反应的影响。高考有机化学常见题型归类分析(河南宏力学校张朝利)分析比较近几年的高考有机化学试题,基本保持稳定,一是有机化学所占的分数比较稳定(约占全卷的15%〜20%);二是题型比较稳定。一、考查有机基础知识1.判断有机物的类型有机物的分类是研究有机物必需具备的基础知识,就屮学化学范围己可从多种不同角度将冇机物分类。高考中常有试题直接要求考生判断冇机物的类别。例1・化学工作者一宜关注食品安全,发现有人将工业染料“苏丹红I号”非法用作食用色素。苏丹红是一系列人工合成染料,其中“苏丹红4号”的结构式如下:CH,CH,HOA.不能发生加成反应B.属于芳香怪衍生物C.nJ以使酸性高鎰酸钾溶液褪色D.属于卬苯同系物卜列关于“苏丹红4号”说法正确的是(解析:木题通过以苏丹红为背景材料考杳官能团与启机物的性质关系,同时考杳衍生物、同系物的概念。由"苏丹红4号”的结构式看出,其分子中有苯环对以发生加成反应,有酚疑基和OC可以发生氧化反应使酸性高镒酸钾溶液褪色。由于分子中有N原子,属丁芳香桂衍生物,但不是苯的同系物,故应选BC。2.用有机化学知识分析生活中常见问题\n《考试人纲》中明确要求:“了解有机物的主要來源。了解石汕化工、农副产品化工、资源综合利用及污染和环保的概念。了解在生活和生产中常见冇机物的性质和用途。”高考中常会出现以有机化学基础知识为切口测试科学素质的试题。例2.莽草酸是一种合成治疗禽流感药物达菲的原料,软酸存在于苹果、生石榴等植物中。下列关于这两种有机化合物的说法正确的是()。A.两种酸都能与視水反应B.两种酸遇三氯化铁溶液都显色C.软酸分了与莽草酸分了相比多了两个碳碳双键D.等物质的最的两种酸与足最金属钠反应产生红气的最相同解析:本题以人们牛活有关的两种有机酸为背景材料,侧重考查考牛对官能团决定有机物性质的应用,同时也要求考生关注社会热点,注意用所学知识解释与生活、生产科技等相关的问题,做到理论联系实际。A项芥草酸与澳水发生加成反应,而软酸与漠水发生取代反应;B项莽草酸不与三氯化铁溶液发生显色反应:C项错谋地把苯环结构描述为三个双键、三个单键构成;D项两种酸与所生成的氢气的物质的量之比均为1:2。故应选AD。1.考查糖类、脂肪和蛋白质的性质新教材中将这三人类营养物质归成一章进行讨论,主要是为了强调这三类物质的重要性。高考试题比较重视这些跟人类生活紧密相关的化学物质,所以近几年来考查糖类、脂肪和蛋白质等内容的试题明显增加。例3•下列说法正确的是()。A.石油裂解可以得到氯乙烯R.油脂水解可得到氨基酸和甘油C.所启烷坯和蛋白质屮都存在碳碳单键D.淀粉和纤维素的组成都是(G出心)”水解最终产物都是葡萄糖\n解析:本题主要考杳考住掌握课本知识的准确性。选项A屮石汕裂解主要得到乙烯、内烯、异丁烯及卬烷、乙烷、丁烷、块坯、硫化氢和碳的氧化物等;选项B中油脂水解可得到高级脂肪酸和廿油;选项C中甲烷分了中就不含碳碳单键。D说法是正确的,故应选D。二、考查跟有机化学有关的基本技能1.判断同分异构体和书写同分异构体的结构简式考查同分异构体的试题口J触及到冇机化学中的任何一块内容。以“根据分了式判断同分界构体”形式编制试题是考査同分异构体概念的常见题型。A.3例1.根据下表中坯的分子式排列规律,判断空格中烧的同分异构体数冃是()。123456784CHC2IL,GIlsCtIlsC611.2C711.6aILB.4C.5D.6解析:根据题目屮给出的坯的分子式,可以发现碳原子数是依次递增,而红原子每两组是以差值为4的等差数列递增的规律,从1佃推出空格处分子式应为CM2,其同分杲构体有正戊烷、异戊烷、新戊烷三种结构,故应选A。2.高分子化合物与单体的相互判断要求学生判断一种“新”的高分子化合物的单体,可以更好地测试考生的知识水平和判断能力。从单体判断高分子化合物或从高分子化合物判断单体,是一类常考题型。例2.将用于2008年北京奥运会的国家游泳中心(水立方)的建筑采用了膜材料ETFE,该材料为四氟乙烯与乙烯的共聚物,四氟乙烯也可与六氟丙烯共聚成聚全氟乙丙烯。下列说法错课的是()。A.ETFE分了中可能存在“一CH?—血一CF?—CF2—”的连接方式B.合成ETFE及合成聚全氟乙丙烯的反应均为加聚反应C.聚全氟乙内烯分子的结构简式可能为[CF—CF—CF—CF-JXF:D.四氟乙烯分子中即含有极性键乂含有非极性键\n解析:本题考杳烯坯及卤代忌的加聚反应及产物。CF2二CF2、饥二CU的链节分别为:一CF2—CF2—、一CH2—CH2—,A项正确;CF3CF=CF2与CF^CF?加聚反应生成聚全氟乙丙烯,B项正确;C项结构简式中,一CF3—中碳原子超过4个价键,其链节为一CF2TF2—CF(CF:J—或一CF2—CFlCF(CF:J—CFl,C项错谋;CF2=CF2JllC—F键为极性共价键,C二C键为非极性共价键,D项正确。故应选C。1.有机反应类型的判断碳碳双键、醇嶷基、醛基、竣基等都是中学化学屮常见的官能团,了解这些官能团的结构和特性等是冇机化学学习的起码要求。判断加成、取代和消去三类反应的判断是最重要的基本技能。例3.(07年重庆理综卷,9题)氧氟沙星是常用抗菌药,其结构简式如下图所示,下列对氧氟沙星叙述错误的是()。A.酸发牛加成、取代反应B.能发生还原、酯化反应C.分子内共有19个氮原子D.分子内共平而的碳原子多于6个解析:本题综合考查考生对于加成、取代、氧化、还原、酯化、原子共而等有机化学基础知识的掌握情况。从氧氟沙星的结构简式可以看出该有机物分子屮含有苯环、、碳碳双键、竣基等官能团,故在一定的条件下能与山发生加成(还原)反应,能与醇类发生酯化反应,也能发牛•取代反应等,A、B均正确。根据有机物的成键规则,该结构的分子式为G$H2°N:OF,C不正确。因苯分子的12个原子全部在同一平面内,故与苯环氏接相连的C原子与苯环上的C原子也在同一平而內,故该有机物分子内共平而的C原子多于6个,D.1E确。故符合题意的选项为Co三、以有机物综合推断题测试分析和综合能力、推理能力1.从探究角度考査有机化学《高中化学课程标准》中强调化学学习中既要重视学习的结果、也要重视学习的过程,新教材中有许多引导学生自主探究的步骤,要求学牛自己研究后得出结论。近儿年的高考试题越來越重视这方面的要求。用有机化学素材测试实验探究能力是一种常见的命题形式。\n例1・(07年江苏化学卷,18题)酯是重要的有机合成屮间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:浓硫酸CH3COOH+C2H5OH二CIfeCOOCiEtWD请根据要求回答下列问题:⑴欲提髙乙酸的转化率,可采取的措施有:、等。⑵若用上图所示的装置来制备少量的乙酸乙酯,产率往往偏低,其原因对能为:等。⑶此反应以浓硫酸为催化剂,可能会造成、等问题。(4)0前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作此反应的催化剂,能垂复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)。同一反应时间同一反应温度反应温度/°c转化率(/%)选择性(/%)•反应时间/h(/%)转化率选择性(/%)*4077.8100280.21006092.3100387.81008092.6100492.310012094.59&7693.0100*选择性100%表示反应生成的产物是乙酸乙酯和水①根据表中数据,卜-列(填字母)为该反应的最佳条件。D.40°C,3hA.120°C,4hB.80°C,2hC.60°C,4h②当反应温度达到120°C时,反应选择性降低的原因可能为o解析:⑴酯化反应是一个可逆反应,为了提高乙酸的转化率,可以通过增大乙醇的浓度和及时移去生成物使化学平衡向正反应方向移动来达到。\n⑵按图示进行实验往往因为原料來不及反应就被蒸出,或者温度过高,发牛了副反应,或者冷凝效果不好,部分产物挥发了,而导致产率偏低。⑶用浓硫酸作催化剂可能会造成的问题有:产生大量的酸性废液(或造成环境污染),部分原料炭化,催化剂垂复使用因难,催化效果不理想等。⑷①由表格中的同一反应时间来看,60°C时反应的转化率以较高,且选择性为100%,同一温度时反应时间选择4小时转化率佼高,故选C。②当反应温度达到120°C时,反应选择性降低可能是因为乙醇脱水生成了乙瞇。答案:⑴增大乙醇的浓度移去牛:成物⑵原料来不及反应就被蒸出温度过高,发生了副反应冷凝效果不好,部分产物挥发了(任填两种)⑶产生大量的酸性废液(或造成环境污染)部分原料炭化催化剂重复使用闲难化效果不理想(任填两种)⑷①C②乙醇脱水工成了乙瞇1.有机框图综合推断题冇机框图综合推断题已成了高考试题中一类保留题型,几乎每份高考化学试卷、理科综合试卷中都会有一道有机框图综合推断类型的大题。例2.(07年全国理综卷I,29题)下图中A、B、C、D、E、F、G均为有机化合物。根据上图回答问题:(1)D的化学名称是o⑵反应③的化学方程式是(有机物须用结构简式表示)。(3)B的分子式是oA的结构简式是o反应①的反应类型是—o⑷符合下列3个条件的B的同分异构体的数目有个。i)含有邻二取代苯环结构、ii)与B有相同的官能团、iii)不与FeCl3溶液发生显色反应。\n写出其中任意一个同分异构体的结构简式O(5)G的重要的工业原料,用化学方程式表示G的一种重要的工业用途o解析:木题是以“醇、醛、酸、酯”为主干知识,分了式、结构简式、化学方程式、同系物、同分界构体、反应类型等为常考知识点,重点考查了考牛的推理能力和逻辑思维能力。C+D(C2H60)—FQHQHHO所以C分子式为CzHQ,为乙酸;•隈験型A*E+H2O,B为—CH2COOHM—CH,OHA水解为B、C、D三种物质,A为酯,再结合B、C、D的结构简式,从而推出A物质。答案:⑴乙醇⑵CH3COOH+CH3CH2OH—L"CH3COOCH2CH3+H2O广厂CH2COOCH2CH3丄CHQOCCH,水解反应⑶C9HioOa^yCOOHU—ch2ch2ohnCH?=CH2催花剂>4CHjYH2T~n或CH2=CH2+H2O催化剂血热:肺压*CH3CH2OH由一道高考题想到的有机化合物分子式的求解(安徽师范大学2004级化学童顺)[2007高考全国卷I理科综合12题]某有机化合物仅由碳、氢、氧三种元素组成,其相对分子质量小于150。若己知其小氧的质量分数为50%,贝9分子中碳原子的个数最多为A.4B.5C.6D.7\n解析:由题意知氧的原子量总和等于碳、红原子量总和且小于75含氧原子个数N(0)W75—M(0)=754-16=4.6875则当N(0)取最大值时M=M(O)XN(0)4-50%=16X4一50%=128所以,M(C)+M(H)=MX50%=64含碳原了个数N(C)W64一M(C)=64一16=5.33所以,分子中碳原子的个数最多为5当碳原子数取最大值时该有机物的化学式为:CsH.,0,,故选B有些同学在做该题时运用数学不等式的知识求解,发挥数学在化学中的应用,步骤复杂且易出现漏洞,在此需提醒人家的是化学就長化学里面不可能考人家太复杂的数学知识。冇关冇机化合物分了式或者冇机物分了中含碳原了数的求解是近年高考命题的热点Z一。通常情况,这些题目只要掌握方法解起来并不难,现通过儿个具体的例子讨论儿种不同的解题方法。有机化合物是以碳为骨架的化合物,要求解有机化合物的分子式确定碳原子数目是关键步骤。一、若知道存机化合物屮只含有碳、氢两种元素且知道化合物的相对分子量时,用相对分子质量除以碳的相对原子质量12所得结果的整数部分就是化合物分子中含碳原子数或含碳原子数减1,再根据所得结果屮碳氢原子个数比为烷桂相比既可得出结果。例2.己知某姪类有机物相对分子质量为72,求该化合物的分子式。解:724-12=6由于是坯类化合物,所以含冇碳氢两种元素在此氢的原了个数不可能为零,故含碳原了数为:6-1=5;含氢原子数为:(72-16X5)4-1=12所以该化合物分子式为:GH|2二、知道相对分了质量H•知道原了个数比时可直接列方程求解例3.(2007年(天津卷)理科综合能力测试27题)奶汕中有一种只含C、H、0的化合物A。A对用作香料,其相对分子质量为88,分子中C、H、0原子个数比为2:4:1。\n(1)A的分子式为o解:设该化合物的分了式为:(C2IU)’贝IJ:(12X2+1X4+16X1)x=88解得x=2即,A的分子式为:CiHsO2例4.(2007年北京理综25题)碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子氢原子个数为氧的5倍。(1)A的分子式是o解:氢原子个数为:102X9.8%三1=10贝IJ,氧原了个数为:10一5=2所以,碳原子个数为:(102-1X10-16X2)4-12=5故A的分子式为:C->H1oO2三、若已知化合物的类型可总接根据通式解方程求解例5.(2007年宁夏理科综合31.化学选考题C.[化学一选修有机化学基础])某坯类化合物A的质谱图表明其相对分子质量为84,红外光谱农明分子中含有碳碳双键,核磁共振谱表明分子中只有一种类型的氢。(1)A的结构简式为;解法1.①假设该化合物中只含有一个碳碳双键,根据烯泾的通式CJk,列方程得:12/7+2/7=84解得:77=6②假设该化合物中只含冇两个碳碳双键,根据二烯坯的通式C'J»2列方程得:12/7+2/7-2=84(不合题意)\n故A的分子式为:GH】2根据题意A中的氢均为等效氢,得结构式为:fKlfHlHbC—C=C—CHb解法2.844-12=7同例2得碳原子个数为6;氢原子个数为12余下解法同解法1.以上就有机化合物分子式的求解的-•般方法作了简单概述,有关该方而的解题方法还有很多,希望大家在学习过程中认真总结。《环境保护》考点透视(湖北省巴东县第二高级中学田宗学)坏境保护是高考命题的热点乞一。更注重考查现代工业生产或FI常生活中的坏境污染和治理问题,可以增强学生的环保意识。其题型通常有以下儿种:一、考査大气污染及成因例1下列物质排放到空气中,不会使空气受到污染的是()。A.煤燃烧时产生的烟气B.植物光合作用产生的气体C.石汕化工厂排放的废气D.汽车排放的尾气解析:煤燃烧后的朋气,石汕化工厂排放的废气及汽车尾气小都含有人量有毒气体,如NOx、CO、SO2、碳氢化合物等,会造成大气污染,而植物光合作用产生的是02。答案:B例2.“环境保护、以人为本”,从2000年6月起,新调整的上海空气质量指标屮指出,影响上海空气质量的一组主要污染物是()。A.SO?、N0?、可吸入颗粒物B.C0八2、02\n解析:SO2、N0:都是有毒气体,空气屮的一些微尘也极易危害人体健鹿.答案:A二、考査水污染及成因例3某河道两旁有甲、乙两厂.它们排放的工业废水中,共含K+、Ag\Fe3\Cl\0H\NO:「六种离子.甲厂的废水明显呈碱性,故甲厂废水屮所含的三种离子是、、:乙厂的废水中含有:W外三种离了•如果加一定量的(选填:“活性炭”“硫酸亚铁”“恢粉”),可以回收其中的金属(填写金属元素符号)。另一•种设想是将甲厂和乙厂的废水按适当比例混合,可以使废水中的(填写离了符号)转化为沉淀.经过滤后的废水中主要含,可用來浇灌农田。解析:甲厂排放工业废水明显显碱性,一定含有0肝,与OR可共存的离子有K+、Cl\NO;,考虑到Ag+与Cl不能共存,所以甲厂废水中含OH、K\Cl,乙厂废水中含AgSFe3+和NO二在乙厂废水小加入一定量的铁粉可以回收银.若将两厂废水按适当比例混合,可将Ag+与Cl、Fe”与0H「分别转化为AgCl、Fe(0H)3沉淀,经过滤后溶液中主要含有KN03,KNOj是钾、氮的复合材料。答案:0H\Cl\K+铁粉AgAg\Fe'+、Cl\OHKNOa三、考查治理污染的措施例4某工厂排出的废水中含C12,为除去废水屮的游离氯,而且使废水变成中性,如果采用卜-图所示的方案处理废水,在A、B处分别注入一定流量的废烧碱溶液和亚硫酸钠溶液处理。(1)请写出所发牛反应的化学方程式,氯气在反应中的作用是否相同?⑵试写出A、B处应加入处理液的化学式分别是、,并说明原因.解析:(1)处理含游离氯的废水,所发牛的两个反应方程式不难写出.其中氯气的作用有所不同.CL与N&SO,溶液反应,将+4价硫氧化成+6价,而氯元素由0价态还原为-1价,CL是氧化剂.而在CL跟NaOH溶液反应中,CL不仅被述原成-1价氯,而几被氧化成NaC10«|>+1价氯,CL既是氧化剂乂是还原剂.这正是本题易错之处.\n(2)正确选择A、B处应加入的处理液,关键应注意三个箭号所示的液体的流向和题目“使废水变成中性”的R的.如果能够把握住这两点,便会做出先加Na2S03后加NaOH的正确选择。答案:(l)Cl2+Na2S03+H20====Na2S04+2HC1CI2作氧化剂Cl2+2NaOH====NaCl+NaClO+H2OCl2既是氧化剂,又是还原剂(2)Na2SO;{;NaOH;A处反应住成盐酸,随废水流经B处被一定流量的NaOH屮和,使废水呈中性。例5.回答下列问题:⑴盐碱地不利于作物的牛长是因为含NaCKNMO,较多,施加少量石膏可降低盐碱地的碱性■试解释其原因并用化学方程式表示0(2)©某地雨水样品刚采集时测得pH为4.82,放在烧杯中经过2小时后,再次测得pH为4.68,则其pH变小的原因是(用化学方程式表示)。②经调杳该地区出现酸l*j的原因是因为该地区有一大型火力发电厂,该发电厂是以含硫重油作燃料,此燃料燃烧产生大量SO2Z故.又知该地附近有丰富的石灰石矿,为了降低污染做到资源的综合利用,请提出你的方案。答案:(l)C032_+H20^=^HCOf+OH加入石膏后有:Ca2++CO32_=—^ChCObI使CO:巴的浓度下降,上述水解平衡向左移,故碱性下降。(2)①雨水pH变小是因为:2H.0+2S0,+02===2H,S0<或2H2S03+02====2H2S0.i②利用ChSOb粉末或CaO粉末吸收S022CaC03+2S02+02====2CaS04+2C02O2+2CaO+2SO2====2CaSOi或先将CaC03锻烧制成生石灰,再制成石灰浆用石灰浆浊液吸收S0?2Ca(OH)2+2S02+02=—2CaSO.,+2H2O(其中第(2)中以上反应若无氧气参加,则生成物为CaSO3)。四、考査环保知识\n例6・有关化学物质对环境的影响,下列叙述错误的是()A.汽车的高温引擎产生氮的氧化物,直接排放会造成空气污染B.核能发电以铀一235为燃料,产生的核废料具有放射性,需妥善处理C.使用无铅汽汕主要是减少二氧化碳的排放,可显著降低温室效应D.电镀工厂若直接排放含高浓度铜、锌、钻等离子的废水,会造成环境污染解析:空气中NOx、放射性物质及水中重金属盐,都会污染坏境,造成人体伤害,使用无铅汽汕,目的是防止铅中毒而非CO”答案:C例7.从保护人类的生存环境角度审视,下列燃料中最好的是()A.石油B.煤C.木材D.氢气解析:石汕和煤都属化石燃料,其组成成分屮含有碳、硫、氮等元素,燃烧过程屮,会产生对大气造成污染的CO、SO2、氮氧化物等;木材燃烧虽不会对大气造成严重污染,但是木材资源有限,乱砍滥伐会导致土地沙漠化等不良后果;氢气燃烧热值高,无污染,应为最理想的沽净燃料.不过使水在较低温度下分解的问题还有待进一步解决。答案:D五、考査环境保护新概念例8“零排放”是指在生产新物质的过程中,原料中的原了全部转化成到欲制取的产物中,在生产的过程中和末端均为“零排放”,从而达到“零排放”目的。下列反应类型中一定属于“零排放”的是()A.分解反应B.化合反应C.置换反应D.复分解反应解析:由于化合反应中只有一种物质牛成,故化合反应一定属于“零排放”反应。故答案为Bo高考反应热问题解法例谈(河北省万全中学赵铁柱)反应热是研究化学反应中能量变化的重要概念,反应热问题则是高考的重点内容,处理好相关题目的关键是深刻理解概念,掌握解题方法。\n一、概念本质剖析任何化学反应进行过程中都伴随着能量的变化,|佃这种能量常以热能的形式表现出来,此热能的人小之度量以及反应过程小吸、放热情况都可以用到反应热的概念。要点:⑴符号:AH(2)单位:kj/molo⑶判断:△川刀F(生成物)—ZEQ反应物)其中工F表示物质具有的总能量。具体地:①若AQOZEJ生成物)>ZEJ反应物),物质所具能量升高,反应吸热。②若△//<()2E(生成物)VK反应物),物质所具能量降低,反应放热。二、解题方法总结1.图像分析法图像的特点是直观、形象,尤其适合问题分析与推断吋使用。例1(2004年全国)已知25°C、101kPa下,石墨、金刚石燃烧的热化学方程式分别C(石墨)+02(g)=C02(g)△H=—393.51kJ・mol-1C(金刚石)+02(g)=C02(g)AH=—395.41kJ•mol-1A.由石墨制备金刚石是吸热反应;等质最时,石墨的能最比金刚石的低\nA.由石墨制备金刚石是吸热反应;等质量时,石墨的能量比金刚石的高B.山石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的低C.由石墨制备金刚石是放热反应;等质量时,石墨的能量比金刚石的高解析:根据题意知石墨与金刚石的燃烧都为放热反应,据此作出下图。由图很容易看出,金刚石能最比石墨能最要高,即完成由石墨制备金刚石的过程需要吸热。故答案为A1.键能计算法反应热的实质是化学反应中化学键的断裂与形成过程屮的能最变化的综合,键能肓接反映了化学键的断裂与形成过程中的能量变化,因此反应热与键能有着密切的联系,可以通过键能计算出反应热。具体地:AH=E£(生成物)一ZEI反应物)=ZU(反应物)一刀U(生成物)其中刀E表示物质具冇的总能量,EU表示物质所含化学键的总键能。例2已知H-H键能为436KJ/mol,H-N键能为391KJ/mol,根据热化学方程式N,(g)+3H2(g)=2NH3(g);△洋-92.4KJ/mol,则N三N的键能是()A.431KJ/molB.946KJ/molC.649KJ/molD.869KJ/mol解析:A(N=N)+3U(H-H)-6U(N-H)=-92.4KJ/mol代入相应数据,计算得E(N=N)=945.6KJ/mol故选择E\n1.定义解析法燃烧热和中和热是反应热的两个菇木概念,它们的考查多围绕定义展开,因此,理解定义内容、抓住定义要点是解题的关键。⑴燃烧热定义:在101kPa时,1mol物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热。定义要点:①规定在101kPa压强下测出热量,因为压强不定,反应热数值不相同。②规定以1molnJ燃物作为标准來进行测定,因此在计算燃烧热时,热化学方程式里其他物质的化学计量数常出现分数。③规定对燃物完全燃烧生成稳定化合物所放出的热量为标准。④燃烧热为放出的热量,故为止值。⑵中和热定义:在稀溶液屮,酸跟碱发生中和反应生成1niol水时的反应热叫做屮和热。定义要点:①必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热。②强酸和强碱的稀溶液反应才能保证H'(aq)+0H_(aq)==H20⑴小和热均为57.3而弱酸或弱碱在中和反应中由于电离吸收热量,其中和热小于57.3kJmol^o③以生成1mol水为基准,测定放出来的热量,因此书写它们的热化学方程式时,应以生成1mol水为标准來配平其余物质的化学计量数。例3(2006天津)已知反应:①101kPa时,2C(s)+02(g)=2C0(g);△〃=一221kj/mol②稀溶液中,I「(aq)+0II(aq)=Ib0(l);A//=-57.3kj/mol下列结论正确的是(A.碳的燃烧热人于110.5kj/mol\nA.①的反应热为221kj/molB.稀硫酸与稀NaOII溶液反应的中和热为一57.3kj/molC.稀醋酸与稀NaOH溶液反应生成1mol水,放出57.3kJ热量解析:A项考查燃烧热的概念,根据燃烧热的定义要点,结合题给信息,由C(s)到C0(g),CO(g)到g(g)的过程均为放热过程,故A正确。B项考查反应热的概念,反应热要注意正负号,反应①为放热反应,故①的反应热为一221kj/mol,故B错误。C项考查中和热的概念,中和热为放出的热量,为正值,故C错谋。D项要注意醋酸为弱酸,电离吋要吸收热量,则最终放岀的热量将小于57.3kjo1.盖斯定律法1840年,俄国化学家盖斯从大量实验事实中总结出一条规律:化学反应不管是一步完成还是分儿步完成,其反应热是相同的。即化学反应的反应热(能量)只与反应的始态(各反应物)和终态(各生成物)有关,而与具体反应进行的途径无关。如果一个反应可以分儿步进行,则各分步反应的反应热Z和与该反应一步完成时的反应热相同,这就是盖斯定律。如:AH2.AH3AH4A->B>C>DIfAH]I有:△〃=△/+△/+△〃盖斯定律的主要应用是计算无法直接用实验测量的反应之反应热。例4(2006年江苏)下列各组热化学方程式中,化学反应的AH前者大于后者的是()©C(s)+02(g)==C02(g);△必C(s)+02(g)=C0(g);\n③«2(g)+1/202@)=金0⑴;△念④CaCOs(s)==CaO(s)+C0?(g);△冯A.①B.④C.②③④解析:2H2(g)+Oz(g)==2H2O(l);△以CaO(s)+H2O(1)==Ca(OH)2(s):△必D.①②③①△比由盖斯定律知,△Hi=AH2+AH△H2.Ah.J•因为c(s)的燃烧为畝热反应,故△hCOfg)——>co2(g)②乂由盖斯定律知,Ah尸△h+Ah4AhAH4[因为s(s)到s(g)的过程为吸热反应,故△h>o,S⑸——S(g)——S02(g)即△h‘>Ah4①根据物质变化与能量变化一一对应的关系,可知发生同样的燃烧反应,物质的量越多,放出的热量越多,贝|J|A/^|<|Ai%|,即厶必>△«②碳酸钙分解吸收热量,A〃>o;CaO下H2O反应放出热量,A/V0,显然A〃>A故答案为C此题中的①、②的确定就是根据盖斯定律。利川盖斯定律解题的关键为:合理设计变化过程。总Z,解决反应热问题的一个革木思路就是抓住定义要点、选择最佳方法,从而以不变应万变,在高考中取胜。点击高考化学实验题的三大特点(山东省莘县实验高中李银方)\n化学实验题是化学高考试题中最重要的题型之一,2007年乂是山东省实行新课程标准以来的第一次高考,大考试人纲中对实验的要求是人纲屮描述的最为详细的一部分。2007年的山东省的考试说明中对化学实验的要求如下:(一)了解化学实验是科学探究过程中的一种重要方法。(二)了解化学实验室常用仪器的主要用途和使用方法。(三)掌握化学实验的基本操作。能识别化学品安全使用标识,了解实验室一般事故的预防和处理方法。(四)掌握常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。(五)能对常见的物质进行检验、分离和提纯,能根据要求配制溶液。(六)能根据实验试题要求,做到:①设计、评价或改进实验方案;②了解控制实验条件的方法;③分析或处理实验数据,得出合理结论;④绘制和识别典型的实验仪器装置图。(七)以上各部分知识与技能的综合应用。从耍求我们可以看出,在对一部分知识点删减的情况F对实验却作了进一步加强,2008的高考小,化学实验仍会在此基础上平稳发展。分析近儿年的高考试题,高考实验题变化多样,总结起来有以下三大特点:一、实用、基础——实验考查的两个重要方向实验作为每年必考的知识点Z—,考查的方式是灵活多变,命题的角度往往创新性较强,也是学生失分较多的地方,所以实验题成了学生分值拉开的最重要的一类题型。而实川和基础是考查两个最为平稳的特点。这些题hl往往是来源于课木中的某一部分知识,在命题时进行了组合。1.基本操作考查的出其不意在高考实验题中,实验的基本操作是每一年的必考题,但以而总是把基木操作题与其他的知识点放在一起进行考杳,但2006年的实验操作题的命题形式有了一个人的改变。例:29(江苏卷)(9分)(1)有右下图所示A、B、C、D四种仪器:\n请选择下列仪器名称的序号,填人相应的空格内:①烧杯②普通漏斗③圆底烧瓶④锥形瓶⑤分液漏斗⑥酸式滴定管ABCD(2)某同学用托盘天平称量烧杯的质量,天平平衡后的状态如图.山图中可以看出,该同学在操作时的一个错误是,烧杯的实际质量为g.(3)指出下面3个实验中各存在的一个错误:A.向试种中海加液休B鑽最無钠受热分"C.粽去CO%牡中的CO;n体解析:此题是一个实验基木操作的考题,第(1)小题是一个仪器的识别题,此小题给出了名称,人人降低了题目的难度,如果没有给出名称而让学生去填写,那将会有相当一部分基础不牢固的学生在此失分,比如酸式滴定管,分液漏斗学生都会有问题岀现。第(2)小题是考查称量这一基本操作的小题,本题中操作错误是物码放反;同时读数也是学生常出错的一个知识点,特别是当物码放反时的读数更容易出错。第(3)小题是判断向试管中滴加液体、给固体加热、洗气这三项基本操作的一个题,这也是学牛在学习和实验中常岀问题的三个操作,如杲平时注意实际操作,这样的题得分还是比较容易的。答案:29.(共9分)(1)③⑤④(©(各]分)(2)祛码放在左盘,烧杯放在右盘(或他码和物品的位置放反了)(1分)27.4(1分)(3)A.滴管口伸人试管中B.试管口向上C.混合气体从短导管进入洗气瓶(各1分)总评:此题的新意是命题的形式比较新颖,没有把基本操作放在其它知识点小才能考查,\n而是把几个常见、常川、常错的基本操作合并在一起进行设计和考查,从这一点说明高考的导向是加大对基操作的考査力度,提高对基木操作的认识,注重在实践中的应用。1.基础实验的考査注重了实用粗盐捉纯是课木中的一个基础实验,特别是在新教材中更是很详细的作了介绍,但2006年的高考实验题就是在这个基础上进行了改编,而且进行了创新。26(重庆卷)(15分)(请在答题卡上作答)为除去粗盐中的Ca2\Mg2\Fe3\SOf以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):,*藩解BaCl.NaOHNa.CO,过滩适ht盐战燕发、结朋、烘干亠称取粗盐►A►►灌液►韬盐-①一②.…③—「④—⑤.一⑥.⑦⑴判断BaCl2已过量的方法是o(2)第④步中,相关的离了方程式是o(3)若先用盐酸调pH值再过滤,将对实验结果产生影响,其原因是\n(4)为检验精盐纯度,需配制150mL.0.2mol/LNaCl(精盐)溶液,题右图是该同学转移溶液的示意图,图中的错误是解析:课本小虽然介绍了粗盐的提纯,但并没有深入的介绍,本题中的第(1)小题就是以此出发点的考题,BaCl2的作用是除去SO产,在除杂时,所加的试剂一般都要过量,这样判断过量就成了实验的一个基木要求。第(3)小题则是对实验的一个设计问题央除朵时,一淀会遇到先麻问题,本题屮如果是先用盐酸酸化则会使沉淀屮的陥C0,溶解,产生可溶性的BaCl2,而B『是有剧毒的离子,所以应先过滤再酸化。笫(4)小题是一个基本操作题,从图屮有两处错误,一是没有玻璃棒引流,二是容量瓶的规格不对。在此小题中容量瓶的规格容易忽视。答案:26.15分(1)取第②步后的上层清液1〜2滴于滴定板上,再滴入1〜2滴BaC12溶液,若溶液未变浑浊,则表明BaCLS过量(2)Ca2++CO:厂=CaC031;Ba2++CO广=BaC031(3)在此酸度条件下,会有部分沉淀溶解,从而彩响制得精盐的纯度(4)未用玻璃棒引流;未釆用150ml容量瓶。总评:从以上两个题来看,实验题除了进行了创新Z外,更加注重了基础知识,特别是实际实验屮经常用到的基本操作和与我们牛活密切相关的工业住产,都成了高考命题的热点,注重了实验室实验的实用性。因此实验的学习要注意以下三个问题①创造条件做实验而不要背实验和只作实验题②多阅读与现代的工业工产相关的资料,扩人知识而③提高对实验的认识,不仅仅为考试,更重要的是应用。二.对教材中的实验、物质性质进行创新是高考实验题的主要形式实验题的命题形式是多种多样,但从它们的信息中我们仍可以找出教材中的影子,从这几年的高考题来看,与教材有关的实验题目主要何以下三种形式。1.教材原有实验进行改进这一类题的特点是利用教材中原有的实验进行改进,既來源于课本,但乂高于课本;既考杳了基础知识,又考杳了基木技能;很适合于这几年理综试题的要求,所以在这几年的高考题屮这一类试题频繁出现,例如:(02年理综全国卷)制取氨气并完成喷泉实验(图屮夹持装宜均己略去)。\n(1)写出实验宗制取氨气前化学方程式:O(2)收集氨气应使用法,耍得到干燥的氨气可选用做干燥剂。(3)用图1装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是o该实验的原理是0(4)如果只提供如图2的装置,请说明引发喷泉的方法。解析:本题考查了教材中的两个重要实验①实验室制备氨气②喷泉实验。这两个实验在侮一个学生心目中都很熟悉,特别是第喷泉实验。从原理到装置,从试剂到注意事项,可以说讲的已经很多了,但只要学生没有在实验索中作过实验,只是听教师在课堂上讲实验,这一个题想得高分很难。因此,这就告诉我们必须让学生动手作实验,这是化学这一学科特点的要求,切不可只讲不作。答案:(1)♦CtCb.2112(2)向下排空气法,碱石灰(3)打开止水夹,挤出胶头滴管中的水;氨水极易溶于水,致使烧瓶内气体压强迅速减小(4)打开夹子,用手(或热毛巾等)将烧瓶捂热,氨受热膨胀,赶玻璃导管中的空气,氨气与水接触,即发卞喷泉。1.教材原有化学性质进行改编这一类题目的特点是题目中的实验不是教材小要求的必作实验,而是某种物质的性质,在原冇知识的基础上进行挖掘探究,进而在实验中进行验证。题冃中考查的都是最基本的内容,但由于题意比较新,导致学生很难得高分。例如:(03年理综全国卷)用下而两种方法町以制得白色的Fe(0HL沉淀。方法一:用不含的FeSO.溶液与用不含O2的蒸係水配制的NaOH溶液反应制备。\n(1)用硫酸亚铁晶体配制上述FcSO.’:溶液时还需加入。(2)除去蒸懾水中溶解的02常采用的方法。(3)生成白色Fe(0H)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO;溶液液面下,再挤出NaOH溶液。这样操作的理由是o方法二在如图装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。(1)在试管I里加入的试剂是o(2)在试管【I里加入的试剂是。(3)为了制得白色Fe(0H)2沉淀,在试管I和II中加入试剂,打开止水夹,塞紧塞子后的实验步骤是o(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是o解析:Fe(0H)2很容易被空气中的氧气氧化,这是Fe(0H)2的重要性质,木题是在原有性质基础上进行了改编,设计成了探究型实验题,此题考查的内容比较多,既有水解方面的问题,乂有氧化还原方面的问题,还有实验小的实际问题,同时还考查了实验的设计,可以说是一道不可多得的好题。答案:方法一(1)稀H2SO4铁屑(2)总沸(3)避免生成的Fe(0H)2沉淀接触O方法二(1)稀H.SO.,铁屑(2)NaOH溶液(3)检验试管II出口处排出的氢气的纯度。当排出的仏纯净时,再夹紧止水夹。(4)试管【中反应生成的氏充满了试管I和试管]【,且外界空气不容易进入。1.教材不同性质实验进行组合\n这一类题冃有以下几个特点①考查的内容来源于教材②同吋考查多个性质③把教材中的性质以实验的形式呈现出來④往往和化学实验棊础知识结合起來进行考查。例如:(2005年广东)研究性学习小组进行S0?的制备及性质探究实验。(1)根据反应N沐()3(固)+H2SOX浓)=Na2S0.;+S02+H20,制备SO2气体。①用卜■列简图,在答题R的方框中画出制备并收集S02的实验装置(含试剂)示意图。带孔胶塞锥形瓶集气瓶分液漏斗导管液体固体②实验过程屮,使用分液漏斗滴加浓硫酸的操作是c(2)将SO?气体分别通入下列溶液中:①品红溶液,现彖是:②漠水溶液,现彖是;③硫化钠溶液,现象是0(3)有一小组在实验中发现,S0?气体产住缓慢,以致后续实验现象很不明显,但乂不存在气密性问题。请你推测口J能的原因并说明相应的验证方法(可以不填满)。①原因,验证方法O②原因,验证方法o③原因,验证方法o解析:第(1)小题考查了仪器的组装和分液漏斗的使用方法,这是化学实验基本操作中的最棊木的内容,在教材中要求也比较高,在前几年的高考中经常出现,近几年较少,但在2005年出现也说明了化学基木操作扔是化学考查的重点内容Z-o第(2)小题考查了SO?的三个重要性质①漂白性②还原性③氧化性。可以说是典型的组合题。第(3)小题是一\n个开放型的问题,同时也是一个实验中的实际问题。在一个题冃中把这么多的知识点组合起來,这也是近儿年高考实验题的一大趋势,前儿年这类题目往往以选择题的形式出现,而今年以第II卷的形式岀现也说明了实验题的考查,这也是一个很重要的发展方向。\n答案:⑴①②打开分液漏斗上口的活塞,旋开分液漏斗的旋塞,慢慢滴加(2)①溶液褪色②溶液褪色③冇浅黄色溶液(或溶液变浑浊)(3)①NMO:浚质;取待测试样于试管屮,加适最蒸馆水配成溶液,先滴入足量稀盐酸,再滴入BaCL溶液有白色沉淀生成,则证明该血2«)3固体变质②不是浓硫酸;川洁净玻璃棒蘸取待测试样,涂白纸不变黑,则证明该溶液不是浓硫二.探究性实验是新课标地区的一大特色2007年是山东省实行新课标以來的第一次高考,实验题增强了探究性实验的考查,很好的体现了新课标的考査目的。但从2007的考查试题来看,把课教材中的知识再进一步挖掘是命题的主要方向。(2007山东省)29.(15分)铁及铁的化合物应用广泛,如FeC1:,可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。(1)写出FeCh溶液腐蚀印刷电路铜板的离子方程式。(2)若将(1)屮的反应设计成原电池,请画出原电池的装置图,标出正、负极,并写出电极反应式:止极反应,负极反应。(3)腐蚀铜板后的混合溶液中,若Cu2\Fe”和Fe?+的浓度均为0.10mol・L~'请参照下表给出的数据和药品,简述除去CuC12溶液中F和Fe?+的实验步骤:氢氧化物开始沉淀时的PII轼氧化物沉淀完全时的PIIr3^re1.93.2\n7.09.0be4.76.7CiT提供的药品:c12浓mso(NaOil溶液Cu0Cu(1)某科研人员发现劣质不锈钢在酸屮腐蚀缓慢,但在某些盐溶液屮腐蚀现象明显。请从上表提供的药品中选择两种(水对任选),设计最佳实验,验证劣质不锈钢易彼腐蚀。有关反应的化学方程式、—劣质不锈钢腐蚀的实验现彖:。解析:在新课标的考试说明中明确规定了对实验的要求:“(6)能根据实验试题要求,做到:①设计、评价或改进实验方案;②了解控制实验条件的方法;③分析或处理实验数据,得出合理结论;④绘制和识别典型的实验仪器装置图。”这也是新课标地区所特有的。本题中的第(4)小题就是这样的一个考题。本题要求设计最佳实验方案。阳且是根据所给的试剂,大人提高了题的难度。题意屮隐含了是要验证“验证劣质不锈钢易被腐蚀”的环境应是“盐溶液中”。而给出的试剂中又没冇盐溶液,需要学生根据所给的试剂配制,从题冃中给出的试剂来看可以得到硫酸铜、氯化钠、次氯酸钠等儿种盐,而得到硫酸铜的方案乂有好儿个。这是木题的关键,同时考杏了学生能能不能应用在探究屮获得结果科学方法。答案:29.(1)2Fe3++Cu=2Fe2++Cu2+(2)装置图FcCb溶液正极反应:Fe'++e_=F「+(或2Fe‘十+2e一=2Fe?+)负极反应:Cu=Cu2++2e"(或Cu-2e"=Cu2+(3)①通入足量氯气将Fe'H氧化成Fe3+;②加入Cu0调节溶液的pH至3.2〜4.7;③过滤[除去Fe(OH)3]\nCuS04+Fe=FeS0,+Cu,(4)CuO+H2S0,=CuSO^+H.O不锈钢表面冇紫红色物质生成。点评:第(4)小题虽然是本年度化学失分最多的地方,但我们可以看出,学生失分的主要原因是基础知识不牢固,方法不合理,不能注重实验方案的最优化。如果我们平时能注重对基本的化学反应的理解,本题冃做满分述是完全能达到的。透析高考实验题,复习钠的化合物(河北冀州中学常焕玲)碳酸钠、氯化钠、过氧化钠是具有极强代表性的钠的化合物,根据其性质设计的相关实验连续两年在肓考题中出现,成为高考的热点之一。所以钠的化合物复习更加侧重于其性质实验的复习。碱金属一章共有11个演示实验和1个学生实验,分别在实验的基本操作、实验现象的观察与分析等角度注重了学牛实验能力的培养,所以该部分内容成为了实验习题的设计很好的载体。卜而就两例高考实验题剖析钠的化合物的知识考点。【例1】(06高考全国卷T)ABCDE在呼吸而具和潜水艇屮可用过氧化钠作为供氧剂。请选用适当的化学试剂和实验用品。用上图中的实验装置进行实验,证明过氧化钠可作供氧剂。(DA是制取CO:川勺装置。写出A中发生反应的化学方程式⑵填写表中空格仪器加入试剂加入试剂的目的B饱和NallCOi溶液CD⑶写出过氧化钠与二氧化碳反应的化学方程式⑷试管F中收集满气体后,卜•一步实验操作是解析:过氧化钠作为重要的供氧剂z—,本题的命题苗景涉及我国航天事业的发展。围\n绕过氧化钠与二氧化碳反应,考查了二氧化碳的制备、净化、过氧化钠与二氧化碳牛•成氧气、氧气的证明等基本实验知识。所以在根据实验要求,结合实验目的,理解题给实验装置作川的基础上,才能正确选择必要的试剂,即两个洗气瓶分别除去二氧化碳中氯化氢,除去氧气中二氧化碳,而U形管作为气体和固体反应的容器。木题对两个化学方程式的考杏,均是学生应该掌握的基本反应。最后一问是本题的亮点,紧扌II本题的实验冃的,证明过氧化钠可作供氧剂,要点是叙述出氧气检验的完整操作细节,不同学生的实验体验不同,答题的准确性差异很大,有很好的区分度。答案:(DCdCO:汁2HCl=CaC12+H20+C02t仪器加入试剂加入试剂的目的B饱和NdHC0:<溶液除去二氧化碳中的氯化氢C过氧化钠固体与二氧化碳反应DNaOH溶液吸收二氧化碳气体(3)2Na202+2C02==2Na2C03+02⑷用带火星的木条伸到试管F的管口,如果木条复燃,说明过氧化钠与二氧化碳反应产生氧气,可做供氧剂。【例2】(05高考全国卷I)已知某纯碱试样屮含有NaCl杂质,为测定试样屮纯碱的质量分数,可用下图中的装置进行实验。NaOH洛液试说珀SO.主要实验步骤如F:①按图组装仪器,并检查装置的气密性②将ag试样放入锥形瓶中,加适量蒸憎水溶解,得到试样溶液③称最盛有碱石灰的U型管的质量,得到bg④从分液漏斗滴入6mol・的硫酸,直到不再产牛气体时为止\n①从导管A处缓缓鼓入一定量的空气②再次称量盛有碱石灰的U型管的质量,得到cg③重复步骤⑤和⑥的操作,直到U型管的质量棊木不变,为dg请填空和I川答问题:(1)在用托盘天平称量样品时,如果天平的指针向左偏转,说明(2)装置中干燥管B的作用是(3)如果将分液漏斗小的硫酸换成浓度相同的盐酸,测试的结果(填高、偏低或不变)(4)步骤⑤的甘的是(5)步骤⑦的H的是(6)该试样中纯碱的质量分数的计算式为(7)还町以用其他实验方法测定试样中纯碱的质量分数。请简述一种不同的实验法。解析:这是一个定量实验题,主要考查定量操作中量的规定性以及学生严谨规范的实验态度。本题解题的关键在于对实验原理的理解,即通过测泄反应产生二氧化碳的质量计算纯碱样品的质量分数,所以准确测定牛成二氧化碳的质量成为本题的要点问题。为完成严格的定量要求,重要环节包括,①两次T燥创设CO?的吸收环境,②通过鼓入空气保证反应产生的气体全部被U形管吸收,③两次称最判断COj勺吸收情况。最后根据原理求出试样屮纯碱的质量分数。至于其他定量测定方法,答案很具开放性,可以利用测定生成沉淀的质量(碳酸钙或者碳酸顿等)进行分析展开。答案:(1)样品重,確码轻(2)防止空气中的C02和水气进入U型管中\n(3)偏高(4)把反应产生的CO,全部导入U型管屮(1)判断反应产牛的CO?是否全部排出,并被U型管屮的碱石灰吸收(2)如(7)略小结:两道实验试题都出自钠的化合物,足见钠的化合物性质实验的重要性,课本上最为熟悉的基础知识,经过灵活整合都能变成很好的高考题。两道试题的亮点都在最示一问,06试题主要考杏学生简答题的规范严谨性,而05试题最示一问开放形式的问答,有利于对学牛创新意识的考查,较好地体现了新课程的教学理念。【类比练习】某研究性学习小组在做过氧化钠与水反应的实验吋,发现过氧化钠与水反应后的溶液中滴加酚瞅溶液呈现红色,但红色很快褪色,甲乙丙三位同学对此现象分别做了如下实验:甲、因为反应后试管很热,所以町能是溶液温度过高使红色褪去;乙、因为所加水量太少,红色褪去可能是牛•成氮氧化钠浓度较大的影响;丙、过氧化钠具有强氧化性,牛•成物中氧气、过氧化氢(可能产物)等也貝有强氧化性,可能是氧化作用漂白了红色物质。(1)验证甲同学的推测是否正确的方法是,验证乙同学的推测是否正确的方法是,验证丙同学的推测是否正确的方法是(2)冇同学提出用定量的方法探究丙同学方案中是否含冇双氧水,其实验方案是:称取2.6克过氧化钠固体,使之与足量的水反应,测得产牛氧气的体积,与理论值比较,即可得出结论。a.测量气体的体积时,必须待试管和量筒中的气体都冷却到室温时进行,应选用下图中的,理由是b、若在标准状况时测量气体的体积,应选用最筒的大小规格为.参考答案:(1)冷却后加酚瞅试液或冷却后看溶液是否变红;\n加水稀释后看溶液是否变红;加入氮氧化钠溶液看是否变红(2)©11;防止气体冷却时发生倒吸现彖;②500ml以上所述,我们对于钠的化合物的复习,一定要认真对待课本上基本实验,尽可能培养学生的动手能力,增强学生处理实验问题的能力,然麻以此带动元素化合物的学习,使学生获得丰富的感性认识和实验技能。化学规律与特例52例(河南宏力学校髙屮部张朝利)1.原子都是由质子、中子和电子组成,但氢的同位素気却无中子。2.同周期的元素小,原子最外层电子越少,越容易失去电子,还原性越强,但Cu、Ag原子的述原性却很弱。3.原了电了层数多的其半径大于电了层数少的,但锂的原了半径大于铝的原了半径。4.主族元素的最高正价一般等于其族序数,但F2却不是。(OF?是存在的)5.同主族元素的非金属元素随原子序数的递增,其最鬲价氧化物的水化物的酸性逐渐减弱,但硒酸的酸性却比硫酸的酸性强。6・二氧化碳通常能來灭火,但镁却能与它燃烧。7.氧元素一般显-2价,但在N&2O2、H2O2等物质中显-1价。8.元素的氧化性一般随化合价的升高而增强,但氯的含氧酸的氧化性顺序却是HC10〉HCIO2〉HC103〉HClOio9.在元索周期表屮的各周期元素一般是以活泼金属开始的,但第一周期却是以非金属开始的。10.通常金属单质一般为固态,但汞却是液态。11.通常非金属单质一般为气态或固态,但漠却是液态。12.碱金属一般保存在煤油中,但锂(因其密度小于煤油的密度)却浸在液体石蜡中。13.碱金属的密度从上到下递增,但钾的密度却比钠的密度小。14.一种元素组成一种单质,但碳、氢、氧、磷等元素却能组成几种同位素。15.金属单质的导电性一•般随温度的升高而减弱,但铢、错却相反。16.具有金属光泽又能导电的单质是金属,但石墨却是非金属。17.有机物一般易燃烧,但四氯化碳和聚四氟乙烯却不易燃。18.物质的熔点一般低于沸点,但乙烘却相反(沸点-84,熔点却为-80.8)。19.C1?、Bi*2与水反应生成相应的氢卤酸和次卤酸,但F?却不能(F2+2H20=4HF+02)20.卤索单质与强碱反应一般生成相应的卤化物、次卤酸盐和水,但F2却不能。(X2+NaOH=NaX+NaXO+氏0,2F2+2NaOH=2NaF+OF?+出0)。21.实验室中制取HC1、HBr、HI都在玻璃容器中进行,但HF应在铅制容器中进行(因SiO2+4HF=SiFi+2出0)。22•氢卤酸一般是强酸,但氢氟酸却是弱酸。\n23.CaCl2>CaBr2>Cab都易溶,但CaF?却微溶。24.卤化银难溶于水,但氟化银却易溶于水。25.含有NH;和笫IA主族阳离子的盐一般易溶于水,但KC10;和正长石等却难溶于水。26.重金属阳离子一-般都有壽,但BaSOj却可用作“顿餐”。27.成网状结构的晶体一般都是原了晶体,但石墨却是原了晶体。28.品体-•般都由阴离子和阳离子组成,但金属品体是山金属阳离子和口山电子组成。29.共价键-般都有方向性,但比却无方向性。30.有机物一般为分子晶体,门熔沸点低,但醋酸钠、醋酸钙等却为离子晶体,且熔沸点高。31.活泼金属与活泼非金属形成的化合物一般都是离子化合物,但A1C13.BrCls却是共价化合物。32.金属性强的元素,相应的碱的碱性也强,但A1(OH)3的碱性却比Fe(OH)3弱。33.离子化合物中一般不存在单个分子,但NaCl等在气态时却以分子形式存在。34.离子方程式一般表示同一类反应,但Br2+SO2+2也0=4H*+2Br_+SOf却只表示一个方程式(注意:Ba2++20H-+2H++SO?-=BaSO4+2比0可以表示硫酸溶液与氢氧化锲溶液反应、向氢氧化顿溶液中加入硫酸氢钠溶液至中性或加入过量硫酸氢钠溶液等反应)。35.强碱弱酸盐或强碱弱酸的酸式盐因水解而呈碱性,但爪閘)04却呈酸性。36.盐类一般都是强电解质,但HgCJCdl2等少数几种盐却是弱电解质。37.酸碱中和生成盐和水,但lOHNOs+3Fe(0HL=3Fe(N03)3+NO+8H2O中还有还原产物。38.在金属活动性顺序表里,排在氢前面的金属能宜换出酸小的氢,但铅却不能与硫酸反应放出氢气。39.在金属活动性顺序表里,排在氢后面的金属不能置换出酸中的氢,但铜却能与浓盐酸反应产生氢气,2Cu+4HC1(浓)二出+2H[CuC12]o40.在金属活动性顺序表里,排在前面的金属能把排在后面的金属从其盐溶液中置换出来,但钾钙钠却不能[2Na+CuSO4+2H20=Cu(OH)2+Na2SO4+比]。41.在金属活动性顺序表里,排在前面的金属不能把排在后面的金属从其不溶于水的盐中置换出来,但铁却能把银从氯化银中置换出^(Fe+2AgCl=FeCl2+2Ag)。42•—般只能用强酸制弱酸,但H2S+CuSO-i=CuS+H2SO%HCIO+H2SO3二HCI+H2SO八Br2+H2SO3=2HBr+氏SOHCI2、FeCh等也可以)等反应却能用弱酸制强酸。43.酸能与醇发生酯化反应,但氢卤酸与醇发牛卤代反应。44.制取氯气采用固一液装置,但制渙却须采用曲颈甑。45.启普发生器适用于反应物为块状、反应不需加热以及产物难溶于反应液的气体(如比、C02、H2S),但乙如C2H2)却不能用该装置。46.测量仪器的“0”刻度不是在上就是在下,但是托盘天平的指针却在中间,温度计的“0”刻度在偏中下,量筒无“0”刻度。47.一般只有有机物才有同分构现象,但不少无机物如氟酸银(AgCNO)与雷酸银(AgONC)是互为同分异构体。48.固体物质的溶解度一般随温度找升高而增大,NaCl的溶解度受温度改变的影响很小,而Ca(OH)2>Li2CO3等却随温度的升高而降低。49.氯化钙是中性干燥剂,可用來T•燥酸性、小性、碱性气体,但不能干燥氨气(CaCl,・8NH:J和酒精蒸气。50.非金属的气态氮化物的水溶液一般呈酸性,但NH3的水溶液却呈碱性。51.胶体中的胶粒-•般都带电荷,但蛋白质胶体微粒却不带电荷(呈电中性,但有电泳现象)。52.制取盐的晶体时通常采用加热蒸发使Z结晶的方法,但FeCla>AlCh等却不能。\n与生产生活有关的化学必备知识50例(河南宏力学校高中部张朝利)现行高考说明中要求学生了解生活中的一些化学现象,并仇对冇些现象能加以解释。下面根据教学大纲和教材,搜集体现渗透于牛•活中、牛产的化学50例,以期対学生复习备考有实实在在的帮助。1.在山区常见粗脖子病(甲状腺肿人),呆小病(克汀病),医生建议多吃海带,进行食物疗法。上述病患者的病因是人体缺一种元素:碘。2.用来制取包装香烟、糖果的金属箔(金属纸)的金属是:铝。3.黄金的熔点是1064.4°C,比它熔点高的金属很多。其中比黄金熔点高约3倍,通常用来制白炽灯泡灯丝的金属是:餌。4.冇位妇女将6.10g的一个IU金戒指给金银匠加工成一对耳环。她怕工匠偷金或掺假,一直守在旁边不离开。她见工匠将戒指加热、捶打,并放人一种液体中,这样多次加工,一对漂亮的耳环加工完毕了。事隔数日,将这对■耳环用天平称量,只有5.20go那么工匠偷金吋所用的液体是:王水。5.黑白相片上的黑色物质是:银。6.很多化学元素在人们生命活动中起着重要作用,缺少它们,人将会生病。例如儿童常患的软骨病是由于缺少:钙元索。7•在石英管中充入某种气体制成的灯,通电时能发出比萤光灯强亿力•倍的强光,因此有“人造小太阳”之称。这种灯中充入的气体是:尙气。8•在紧闭门窗的房间里生火取暖或使用热水器洗澡,常产生一种无色、无味并易与人体血红蛋白(Hb)结合而引起中毒的气体是:COo9•地球人气圈的被破坏,则形成臭氧层空洞,致使作为人们抵御太阳紫外线伤害的臭氧层受到损坏,引起皮肤癌等疾病的发生,并破坏了自然界的生态平衡。造成臭氧层空洞的主要原因是:冷冻机里氟里昂泄漏。10.医川消毒酒精的浓度是:75%。11•医院输液常用的生理盐水,所含氯化钠少血液中含氯化钠的浓度大体上相等。生理盐水中NaCl的质量分数是:0.9%。12.发令枪中的“火药纸”(火了)打响后,产生的白烟是:五氧化二磷。13.荼卫生球放在衣柜里变小,这是因为:荼在室温下缓缓升华。14.人被蚊了叮咬示皮肤发痒或红肿,简单的处理方法是:擦稀氨水或碳酸氢钠溶液。15.因为某气体A在大气层屮过量累积,使地球红外辐射不能透过大气,从而造成人气温度升高,产生了“温室效应”。气体A为:二氧化碳。16.酸雨是指pH值小于5.6的雨、雪或者其他形式的大气降水。酸雨是大气污染的一种表现。造成酸雨的主要原因是:燃烧燃料放出的二氧化硫、二氧化氮等造成的。17.在五金商店买到的铁丝,上面镀了一种“防腐”的金属,它是:锌。\n12.全钢手表是指它的表壳与表后盖全部是不锈钢制的。不锈钢锂亮发光,不会牛锈,原因是在炼钢过程屮加入了:倂、繚。13.根据普通光照射一种金属放出电了的性质所制得的光电管,广泛用于电影机、录相机中。用來制光电管的金属是:絶。14.医院放射科检查食道、胃等部位疾病时,常用“锁餐”造影法。用作“锁餐”的物质是:硫酸钞!。15.我国世界闻名的制碱专家侯徳榜先生,在1942年发明了侯氏制碱法。所制得的碱除用在工业上Z外,LI常生活中油条、馒头里也加入一定量这种碱。这种碱的化学名称是:碳酸钠。16.现代建筑的门窗框架,有些是用电镀加工成古铜色的硬铝制成,该硬铝的成分是:A1—Cu—Mg-Mn-Si合金。17.氯化顿有剧毒,致死量为0.8go不慎误服时,除大量吞服鸡蛋清解毒外,并应加服一定量的解毒剂,此解毒剂是:硫酸镁。18.印刷电路板常用化学腐蚀法來生产。这种化学腐蚀剂是:氯化铁。19.液化石汕气早已进入家庭。它的主要成分是:丙烷和丁烷。20.天然气主要成分为川烷。若冇一套以天然气为燃料的灶具改烧液化石油气,应采用的正确措施是:增大空气进入量或减少液化气进入量。21.装冇液化气的煤气罐用完后,摇动时常听到晃动的水声,但这种冇水声的液体决不能私白乱倒,最主要的原因是:这种液体是含碳稍多的烽,和汽汕一样易燃烧,乱倒易发生火灾等事故。2&录音磁帶是在酷酸纤维、聚酯纤维等纤维制成的片基上均匀涂上一层磁性材料——磁粉制成的。制取磁粉的主要物质是:四氧化三铁。29.泥瓦匠用消石灰粉刷墙,常在石灰屮加人少量的粗食盐,这是利用粗食盐中含有的易潮解的物质潮解,有利于二氧化碳的吸收。这种易解潮的物质是:氯化镁。30.我国古代书法家的真迹能保存至今的原因:使用墨汁或碳素墨水,使字迹久不褪色,这是因为碳的化学性质稳定。31.在字画上常留卜-作者的印签,具印签鲜艳红润,这是因为红色印泥含有不褪色、化学性质稳定的红色物质,它应是:朱砂(硫化汞)。32.随着人们生活水平的捉高,黄金首饰成为人们喜爱的装饰品。黄金制品的纯度单位用K表示。24K通常代表足金或赤金,实际含金量为99%以上。金笔尖、金表壳均为14K,它们通常的含金量为:不低于56%。33•吸烟能引起支气管炎、心血管病,还能诱发肺癌、口腔癌、胃癌、膀肌癌等癌症,所以说吸烟是慢性自杀。世界卫牛大会规定每年4月7日为“世界戒烟Fl”o据分析可知,烟草成分中危害性最人的物质主要有:尼古丁和苯并Q)花。34.潜水艇在深水小长期航行,供给船员呼吸所需氧气所用的最好物质是:过氧化钠。\n34.变色眼镜用的玻璃片在日光下能变深色,是因为:在玻璃中加人了适量的卤化银晶体和氧化铜。35.铅中毒能引起贫血、头痛、记忆减退和消化系统疾病。急性中毒会引起慢性脑损伤并常危及牛命。城市大气铅污染主要来源是:汽车尾气。36.盛在汽车、柴油机水箱里的冷却水,在冬天结冰后会使水箱炸裂。为了防冻,常加入少量的:乙二醇。3&医院里的灰镒氧或PP粉是:高镒酸钾。39.高橙饮料、罐头中的防腐剂是:苯甲酸钠。40.水壶、保温瓶和锅炉中水垢的主要成分是:碳酸鈣和氢氧化镁。41.不能用來酿酒的物质是:黄豆。能用來酿酒的物质是:谷子、玉米、高粱、红薯等。42.剧烈运动后,感觉全身酸痛,这是因为肌肉屮增加了:乳酸。43.营养素中,发热量大食后在胃肠道停留时间最长(冇饱腹性)的是:脂肪。44.味精乂叫味索,它冇强烈的肉鲜味,它的化学名称是:2—氨基丁二酸一钠(谷氨酸单钠)。45.在霜降以后,青菜、萝卜等吃起來味道甜美,这是因为青菜里的淀粉在植物内酶的作用下水解空成:葡萄糖。46•为什么古人“三犬打鱼,两犬晒网”?因为过去的渔网是用麻纤维织的,麻纤维吸水易膨胀,潮湿吋易腐烂,所以渔网用上两三天后晒两天,以延长渔网的寿命。现在用不着这样做,这是因为现在织渔网的材料一般选用:尼龙纤维。47.电视屮播放文艺演出时,经常看到舞台上烟气腾腾,现在普遍用的发烟剂是:乙二醇和干冰。4&用自來水养金血时,将水注入鱼缸以前需在阳光下晒一段时间,目的是:使水中次氯酸分解。49.若长期存放食用油,最好的容器是:玻璃或陶瓷容器。50.不粘锅之所以不粘食物,是因为锅底涂上了一层特殊物质:“特富隆”,其化学名叫聚四氟乙烯,俗名叫塑料王。