- 211.50 KB
- 2022-07-28 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
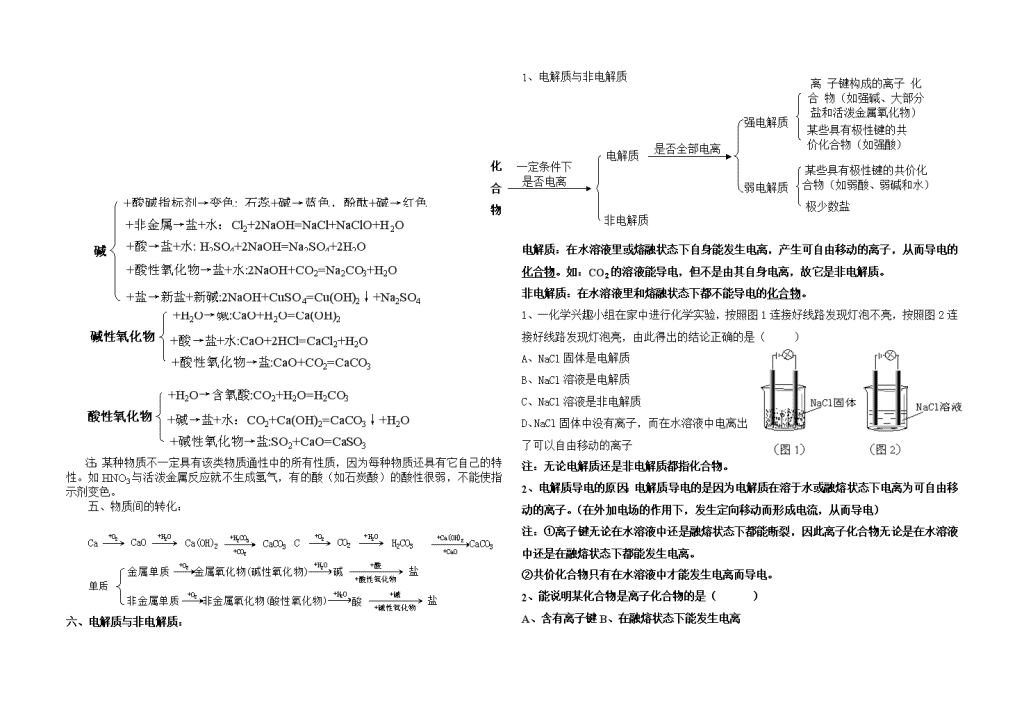
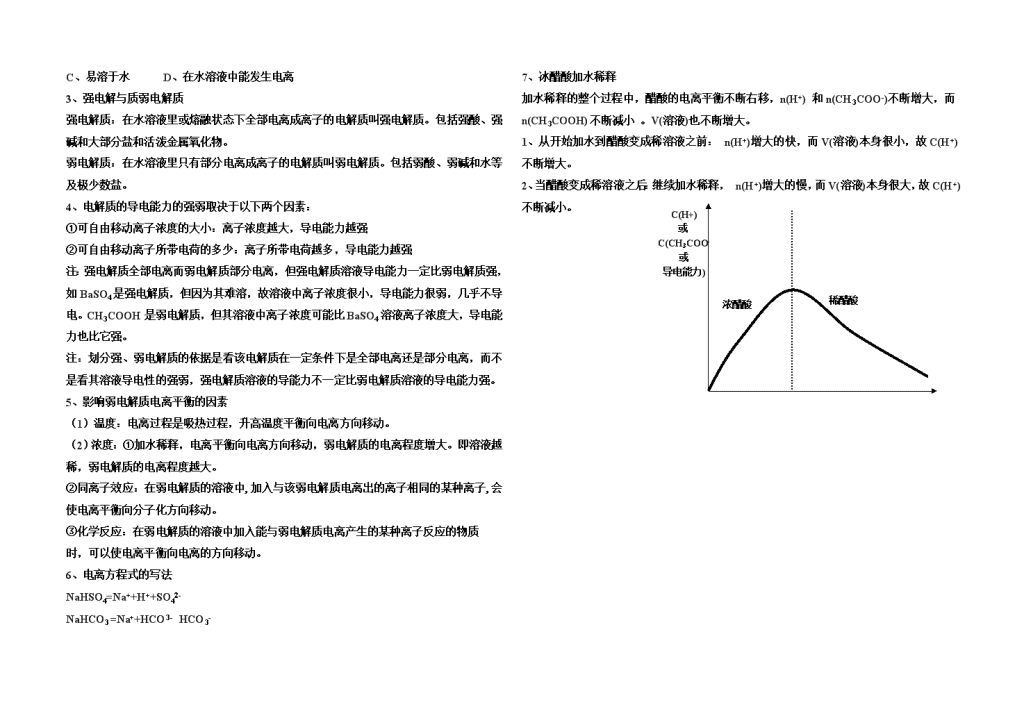
化学反应原理复习资料一、化学:化学是一门以实验为基础的自然科学,它研究物质的组成、结构、性质、变化以及合成等。其研究对象是物质。二、物质的分类及性质1、物质的分类1、纯净物:只由一种物质组成的物质叫纯净物。如:O2、H2O等。(1)单质:由一种元素组成的纯净物叫单质。注:由一种元素组成的物质不一定是单质。如O2和O3的混合物。(2)化合物:由不同种元素组成的纯净物叫化合物。①酸:电离时产生的阳离子全部是氢离子的化合物叫酸。如:HCl、H2SO4。因为NaHSO4=Na++H++SO42-,所以它不是酸,而是盐,且为酸式盐。②碱:电离时产生的阴离子全部是氢氧根离子的化合物叫碱。如:NaOH、Ba(OH)2等。③盐:由金属离子(或铵根离子)与酸根离子所组成的化合物叫盐。如:Na2CO3、NH4Cl。A、正盐:酸与碱完全中和生成的盐。如:Na2CO3。H2CO3+2NaOH=Na2CO3+2H2OB、酸式盐:酸中的氢离子没有被碱完全中和的产物。如:NaHCO3。H2CO3+NaOH=NaHCO3+H2O,由于酸式盐中的氢离子没有完全被碱中和,故它还能继续被碱中和,最终变为正盐。NaHCO3+NaOH=Na2CO3+H2OC、碱式盐:碱中的氢氧根离子没有被酸完全中和的产物。如:Cu2(OH)2CO3。D、复盐:由两种或两种以上的金属离子或铵根离子与酸根离子所组成有化合物。如:KAl(SO4)2。④氧化物:由两种元素组成,其中一种为氧元素的化合物。如:A、酸性氧化物:与碱反应生成盐和水的氧化物。如:CO2。H2CO3+2NaOH=Na2CO3,CO2+2NaOH=Na2CO3+H2O,CO2虽然是氧化物,却和酸一样,能与碱反应生成盐和水,将这样的氧化物叫酸性氧化物,即与酸具有某方面共性的氧化物叫酸性氧化物。SO2+2NaOH=Na2SO3+H2O,大部分非金属氧化是酸性氧化物。但并非所有的非金属氧化物都是酸性氧化物。如NO、CO等。酸性氧化物也不全是非金属氧化物,如Mn2O7也是酸性氧化物。B、碱性氧化物:与酸反应生成盐和水的氧化物。如:CaO。Ca(OH)2+2HCl=CaCl2+H2O,CaO+2HCl=CaCl2+H2O虽然是氧化物,却和碱一样,能与酸反应生成盐和水,将这样的氧化物叫碱性氧化物,即与碱具有某方面共性的氧化物叫碱性氧化物。Na2O+2HCl=2NaCl+H2O,大部分金属氧化是碱性氧化物。但并非所有的金属氧化物都是碱性氧化物。如Mn2O7等。碱性氧化物全是金属氧化物。C、两性氧化物:与酸和碱反应生均成盐和水的氧化物。如:Al2O3。Al2O3+2NaOH=2NaAlO2+H2O;Al2O3+6HCl=2AlCl3+3H2O;D、不成盐氧化物:与酸和碱都不反应的氧化物。如CO,NO等。⑤氢货物:特别活泼的金属与氢元素形成的化合物。如KH,NaH等。2、混合物:由多种不同种分子混合而成的物质叫混合物。如:空气。(1)溶液:分散质微粒直径小于1nm(10-9m)的混合物。(2)胶体:分散质微粒直径介于1—100nm(10-9m—10-7m)之间的混合物。(3)浊液:分散质微粒直径大于100nm(10-7m)的混合物。①悬浊液:较大的固体颗粒悬浮在液体中形成的混合物:如:泥水混合物。②乳浊液:较大的液滴悬浮在液体中形成的混合物:如:油水混合物。注:溶液是均一、稳定的,长时间放置不会有明显的变化,浊液不稳定,长期放置,悬浊液会变成沉淀,乳浊液会产生分层现象。2、物质的性质:物质的性质=(该类物质的)共性(通性)+该个物质的特性(个性)因为物质的种类非常多,不可能一一学习,所以先要对其进行分类,通过分类,先掌握每一类物质的共性,再了解每一种物质的特性,这样可以提高学习和研究的效率。+酸→盐+H2:Mg+H2SO4=MgSO4+H2↑(1)金属+非金属→化合物:Mg+Cl2=MgCl2+O2→金属氧化物:2Mg+O2=2MgO+盐→盐+金属:Mg+CuSO4=MgSO4+Cu3、几类物质的通性+盐→盐+非金属:Cl2+2NaBr=2NaCl+Br2非金属+O2→非金属氧化物:S+O2=SO2+碱→盐+H2O:Cl2+2NaOH=NaCl+NaClO+H2O+金属→化合物:Mg+Cl2=MgCl2+碱→盐+水:H2SO4+2NaOH=Na2SO4+2H2O酸+酸碱指标剂→变色:石蕊+酸→红色,酚酞+酸→无色+活泼金属→盐+H2:H2SO4+Mg=MgSO4+H2+盐→新盐+新酸:H2SO4+BaCl2=BaSO4↓+2HCl+碱性氧化物→盐+水:H2SO4+MgO=MgSO4+H2O\n+酸→盐+水:H2SO4+2NaOH=Na2SO4+2H2O碱+酸碱指标剂→变色:石蕊+碱→蓝色,酚酞+碱→红色+酸性氧化物→盐+水:2NaOH+CO2=Na2CO3+H2O+盐→新盐+新碱:2NaOH+CuSO4=Cu(OH)2↓+Na2SO4+非金属→盐+水:Cl2+2NaOH=NaCl+NaClO+H2O碱性氧化物+H2O→碱:CaO+H2O=Ca(OH)2+酸性氧化物→盐:CaO+CO2=CaCO3+酸→盐+水:CaO+2HCl=CaCl2+H2O酸性氧化物+H2O→含氧酸:CO2+H2O=H2CO3+碱性氧化物→盐:SO2+CaO=CaSO3+碱→盐+水:CO2+Ca(OH)2=CaCO3↓+H2O注:某种物质不一定具有该类物质通性中的所有性质,因为每种物质还具有它自己的特性。如HNO3与活泼金属反应就不生成氢气,有的酸(如石炭酸)的酸性很弱,不能使指示剂变色。五、物质间的转化:单质六、电解质与非电解质:化合物一定条件下是否电离非电解质电解质是否全部电离弱电解质强电解质某些具有极性键的共价化合物(如弱酸、弱碱和水)极少数盐某些具有极性键的共价化合物(如强酸)离子键构成的离子化合物(如强碱、大部分盐和活泼金属氧化物)1、电解质与非电解质电解质:在水溶液里或熔融状态下自身能发生电离,产生可自由移动的离子,从而导电的化合物。如:CO2的溶液能导电,但不是由其自身电离,故它是非电解质。非电解质:在水溶液里和熔融状态下都不能导电的化合物。1、一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的高考资源网结论正确的高考资源网是()A、NaCl固体是电解质B、NaCl溶液是电解质C、NaCl溶液是非电解质D、NaCl固体中没有离子,而在水溶液中电离出了可以自由移动的高考资源网离子注:无论电解质还是非电解质都指化合物。2、电解质导电的原因:电解质导电的是因为电解质在溶于水或融熔状态下电离为可自由移动的离子。(在外加电场的作用下,发生定向移动而形成电流,从而导电)注:①离子键无论在水溶液中还是融熔状态下都能断裂,因此离子化合物无论是在水溶液中还是在融熔状态下都能发生电离。②共价化合物只有在水溶液中才能发生电离而导电。2、能说明某化合物是离子化合物的是()A、含有离子键B、在融熔状态下能发生电离\nC、易溶于水D、在水溶液中能发生电离3、强电解与质弱电解质强电解质:在水溶液里或熔融状态下全部电离成离子的电解质叫强电解质。包括强酸、强碱和大部分盐和活泼金属氧化物。弱电解质:在水溶液里只有部分电离成离子的电解质叫弱电解质。包括弱酸、弱碱和水等及极少数盐。4、电解质的导电能力的强弱取决于以下两个因素:①可自由移动离子浓度的大小:离子浓度越大,导电能力越强②可自由移动离子所带电荷的多少:离子所带电荷越多,导电能力越强注:强电解质全部电离而弱电解质部分电离,但强电解质溶液导电能力一定比弱电解质强,如BaSO4是强电解质,但因为其难溶,故溶液中离子浓度很小,导电能力很弱,几乎不导电。CH3COOH是弱电解质,但其溶液中离子浓度可能比BaSO4溶液离子浓度大,导电能力也比它强。注:划分强、弱电解质的依据是看该电解质在一定条件下是全部电离还是部分电离,而不是看其溶液导电性的强弱,强电解质溶液的导能力不一定比弱电解质溶液的导电能力强。5、影响弱电解质电离平衡的因素(1)温度:电离过程是吸热过程,升高温度平衡向电离方向移动。(2)浓度:①加水稀释,电离平衡向电离方向移动,弱电解质的电离程度增大。即溶液越稀,弱电解质的电离程度越大。②同离子效应:在弱电解质的溶液中,加入与该弱电解质电离出的离子相同的某种离子,会使电离平衡向分子化方向移动。③化学反应:在弱电解质的溶液中加入能与弱电解质电离产生的某种离子反应的物质时,可以使电离平衡向电离的方向移动。6、电离方程式的写法NaHSO4=Na++H++SO42-NaHCO3=Na++HCO3-HCO3-7、冰醋酸加水稀释加水稀释的整个过程中,醋酸的电离平衡不断右移,n(H+)和n(CH3COO-)不断增大,而n(CH3COOH)不断减小。V(溶液)也不断增大。1、从开始加水到醋酸变成稀溶液之前:n(H+)增大的快,而V(溶液)本身很小,故C(H+)不断增大。C(H+)或C(CH3COO-或导电能力)稀醋酸浓醋酸2、当醋酸变成稀溶液之后:继续加水稀释,n(H+)增大的慢,而V(溶液)本身很大,故C(H+)不断减小。