- 736.50 KB
- 2022-07-29 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
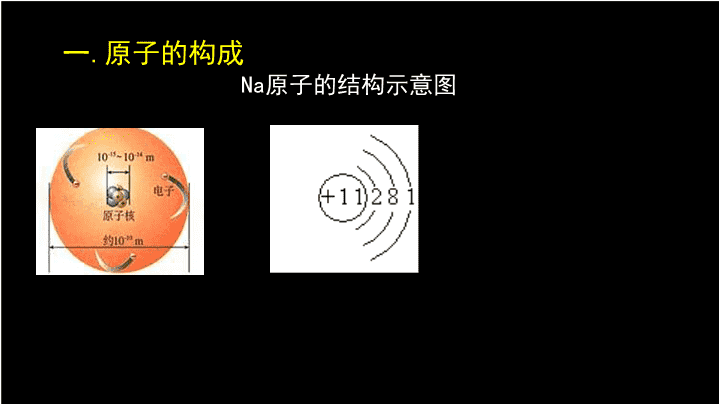
\n第四单元物质构成的奥秘课题一原子的构成课题二元素课题三离子课题四化学式与化合价\n一.原子的构成Na原子的结构示意图\n1.原子的构成\n构成原子的各种粒子间的关系在原子中,原子序数=核电荷数=核内质子数=核外电子数。由于原子核所带的正电荷与核外电子所带的负电荷的电量相等,电性相反,所以原子整体不显电性。\n2.相对原子质量\n二.元素定义:元素就是具有相同电荷数(即核内电子数)的一类原子的总称。几点说明:(1)元素只论种类,不论个数;(2)物质在发生化学变化时,元素的种类不变。(3)元素的种类决定于原子中的质子数。\n元素的分类:\n元素与原子的区别元素:只表示一类原子的总称;只表示种类,不论个数,是宏观概念,化学变化中元素种类不变,但形态可能变化原子:原子是微观概念,既表示种类,又表示数量含义化学变化中,原子种类和数量不变,但最外层电子数可能变化\n元素与原子的联系:元素是同一类原子的总称,原子是构成元素的基本单元\n元素符号元素符号的意义:元素符号不仅表示一种元素,还表示这种元素的一个原子。如果物质由原子构成,元素符号还可以表示一种物质。如果元素符号前加上系数,就只表示该原子的个数,只具有微观意义。\n地壳中含量(质量分数)排在前五位的元素:\n⒈物质由元素组成:⒉物质由粒子(分子、原子、离子)构成。例如:⑴水是由水分子构成的。⑵金是由金原子构成的。⑶氯化钠是由钠离子和氯离子构成的。⒊分子是由原子构成的:物质组成、构成的描述\n描述物质宏观组成和微观构成:①宏观组成(描述物质的组成时用元素叙述):铁是由铁元素组成的。二氧化碳是由碳元素、氧元素组成的。②微观构成(描述物质的构成时用分子、原子、离子叙述)铁是由铁原子构成的。二氧化碳是由二氧化碳分子构成的。
(描述分子的构成时用原子叙述)1个二氧化碳分子是由1个碳原子和2个氧原子构成的。\n下列说法是否正确,为什么?1、二氧化碳是由二个氧元素和一个碳元素组成的。2、二氧化碳是由二氧化碳分子构成的。3、二氧化碳分子是由氧元素的碳元素组成的。课堂检测\n4、1个二氧化碳分子是由2个氧原子和1个碳原子构成的。5、氯化钠是由钠离子和氯离子构成的。6、铁是由铁原子构成的。7、铁是由铁元素组成的。\n①O表示氧元素或一个氧原子。③O2表示氧气这种物质;氧气是由氧元素组成;一个氧分子;每个氧分子由2个氧原子构成。④2O2表示两个氧分子符号O、2O、O2、2O2各具有什么意义?②2O表示2个氧原子。\n下列粒子的性质与质子数、电子数、中子数、电子层数、最外层电子数等有关,请你用它们填空元素种类_____________;元素分类______________;相对原子质量_____________;元素的化学性质___________;离子所带电荷数___________;\n元素周期表:\n三.离子规律:①核外电子总是尽先排在能量最低的电子层里,第一层排满才能排第二层,第二层排满才能排第三层。②每个电子层最多能容纳2n2个电子(n为层序数,第一层n=1,第二层n=2)。③最外层电子数不超过8个(第一层为最外层时,不超过2个)。核外电子的排布\n①金属元素:原子的最外层电子数一般少于4个(是不稳定结构),在化学变化中易失去最外层电子,而使次外层成为最外层,形成稳定结构。这种性质叫做金属性。②非金属元素:原子的最外层电子数一般多于或等于4个(是不稳定结构),在化学变化中易获得电子,而使最外层达到8电子的稳定结构。这种性质叫做非金属性。③稀有气体元素:原子的最外层有8个电子(He为2个),为相对稳定结构。元素的性质与原子核外电子排布的关系\n三.离子带电的原子或原子团叫做离子。离子的形成:在化学反应中,金属元素原子失去最外层电子,非金属元素原子得到电子,从而使参加反应的原子带上电荷。\n离子内质子数不等于核外电子数,离子的最外层电子一般是8(氢是0)个电子的稳定结构。原子通过得失电子变成离子,离子也可以通过得失电子变回原子。\n一定带正电的粒子:质子、原子核、阳离子一定带负电的粒子:电子、阴离子\n物质与其构成粒子之间的关系:①原子直接构成物质。如汞、金刚石直接由原子构成。②金属元素原子和非金属元素原子分别形成阳离子和阴离子。如氯化钠是由氯离子和钠离子构成的。③非金属元素离子和非金属元素离子各提供电子形成共用电子对,结合成分子。如氧气是由氧分子构成的。\n离子符号离子用离子符号表示:离子符号表示的意义:离子符号只有微观含义,没有宏观含义。\n四.化学式与化合价化学式:用元素符号和数字组合来表示物质组成的式子。化学式(如H2O)的意义:\n化学式的写法:\n化合价:元素化合价是一个原子在化合时表现出来的性质。在元素符号或原子团的上方标出化合价,“+”、“-”写在前,数字写在后。化合价的一般规律:金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价。氧元素通常显-2价,氢元素通常显+1价。在化合物里正负化合价的代数和为0。在单质中元素的化合价为0。\n注意同一元素在不同物质里可显不同的化合价。在同一种物质里,同一元素也可显不同的化合价(如NH4NO3)。\n数字的意义:①元素符号前的数字表示几个某原子。如2H中的“2”表示2个氢原子。②化学式前的数字表示几个某分子。如2H2O中的“2”表示2个水分子。③元素符号右下角数字表示一个某分子或离子中有几个某原子。如CO2中的“2”表示1个二氧化碳分子中有2个氧原子。\n④元素符号右上角的数字表示一个某离子中带几个单位的正或负电荷。如Fe3+中的“3”表示1个铁离子带3个单位的正电荷。⑤元素符号正上方数字表示某元素的化合价。如Fe表示铁元素的化合价是+3。\n课堂检测说出下列化学符号中“2”的含义:(1)2H_____________________(2)2H2O_____________________(3)Mg2+_____________________(4)MgO_____________________+2\n根据化学式进行计算(计算时要注意式子的化学意义)相对分子质量=(相对原子质量×原子个数)之和组成元素的质量比=(相对原子质量×原子个数)之比
在计算时要注意标清元素的顺序。\n原子个数之比=(元素质量÷相对原子质量)之比化合物中某元素的质量分数=某元素的质量=某化合物的质量×某元素质量分数=\n课堂检测多少吨的氧化亚铁(FeO)中所含铁元素质量和100t中氧化铁所含铁元素的质量相同?\n核电荷数=质子数=电子数(分子、原子)核电荷数=质子数≠电子数(离子)相对原子质量≈质子数+中子数元素种类由_________决定,元素化学性质主要由_____________决定,元素的相对原子质量由_____________决定。小结\n课下巩固原子的构成离子的构成元素元素符号与化学式核外电子排布规律化合价