- 699.00 KB
- 2022-07-29 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
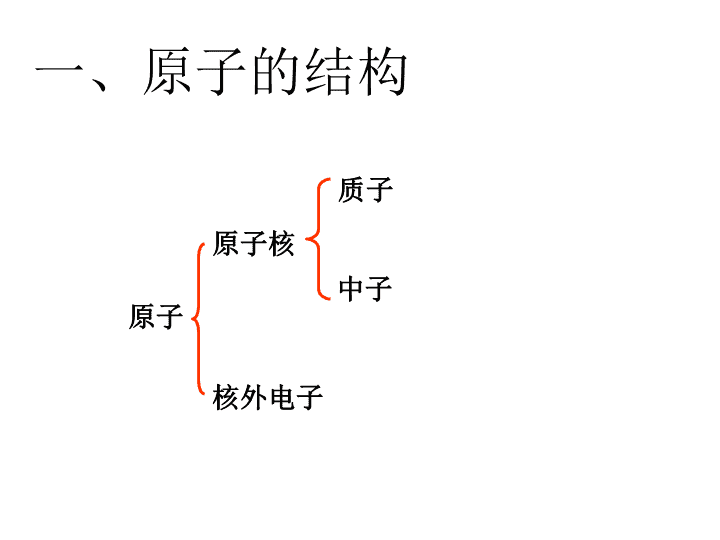
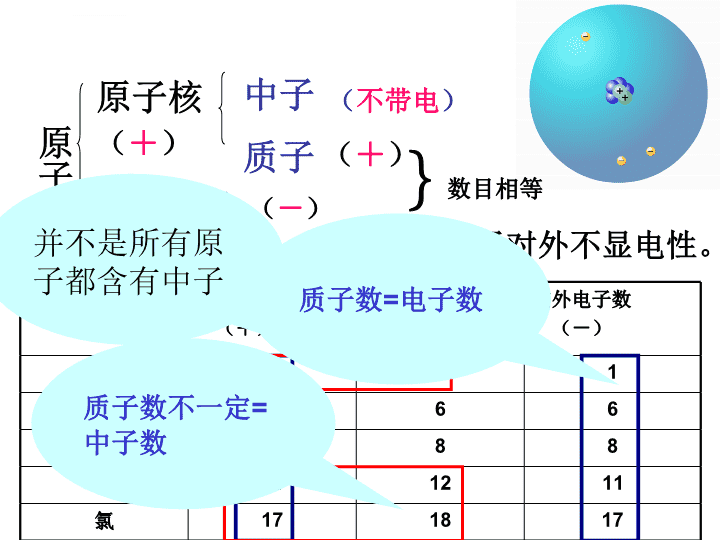
质子中子原子原子核核外电子一、原子的结构\n你能总结出哪些规律?质子数中子数电子数氢原子碳原子氧原子钠原子氯原子原子种类微粒规律表4-2几种原子的构成101666888111211171817氢原子中没有中子原子:质子数=电子数质子数不一定等于中子数原子质子数=核电荷数原子核电荷数=电子数提问展示\n原子原子核核外电子质子中子(+)(+)(不带电)(-)原子对外不显电性。}数目相等原子种类质子数(+)中子数(不带电)核外电子数(-)氢101碳666氧888钠111211氯171817质子数不一定=中子数质子数=电子数并不是所有原子都含有中子\n同步达标我国著名化学家张青莲教授与另一位科学家合作,测定了铟元素的相对原子质量新值。铟元素的核电荷数为49,相对原子质量为115。铟原子的核外电子数为()A.115B.49C.66D.164B\n提出新的问题对原子的构成你又有哪些发现?核电荷数的意义:原子核带的正电荷数①原子不是实心球体,②原子在一定条件下还可以在分③原子不显电性④原子的构成⑤原子中微粒的电性和质量关系。点评精讲穿插于提问展示之中\n【思考】电子在核外的空间里做高速的运动。它们会相互碰撞打架吗?电子在核外的排布会有什么特点?排布特点1:电子在核外是分层排布的(电子在核外是按照能量由低→高,由里→外分层排布的)二、核外电子的排布\n一、核外电子的排布排布特点1:电子在核外是分层排布的。排布特点2:原子的第一层最多排2个电子,第二层最多排8个电子,最外层电子数最多不超过8个(只有1层的不超过2个电子)。\n【思考】能否用一个更简明的图形来表示原子的结构及原子核外电子的排布特点呢?我们用原子结构示意图来表示原子在核外的运动。\n第1层第2层第3层(也叫最外层)原子核原子核带正电质子数152852、原子结构示意图+\n排布特点2:原子里第一层最多排2个电子,第二层最多排8个电子,最外层电子数最多不超过8个(只有1层的不超过2个电子)。29+11227+11\n练习+122821、某原子的原子结构示意图如下:下列有关该原子叙述不正确的是()A、质子数为12B、最外层电子数为2C、核外有三个电子D、核外电子总数为12C该元素是什么元素?\n【小知识】物质都有趋向于稳定状态的特点。如:水往低处流;树上的苹果往下掉)。氦(He)氖(Ne)氩(Ar)【稳定结构】像稀有气体元素原子这样的结构叫8电子稳定结构。若只有一个电子层,则2电子也是稳定结构(如:He)。原子也不例外,也有趋向于稳定结构的特点。那么,什么样的结构才是原子的稳定结构呢?\n?1、当原子得失电子后,还显电中性吗?2、原子得失电子后,所得到的微粒如何称呼?提出问题\n二、离子的形成1、离子带电的原子2、离子分类阴离子阳离子3、离子的表示——离子符号(电子数>质子数)(电子数<质子数)Xn±元素符号离子所带电荷数(得失电子数;当n=1时略去不写)离子带正或负电\n氯化钠的形成NaNa+ClCl-NaCl\n化学反应中的离子:钠+氯气 氯化钠点燃NaClNaCl2NaCl\n失去2个电子得到2个电子28+12Mg2+2+1686S2-28+1682+12821、在原子中,质子数和电子数有何关系?2、在离子中,质子数和电子数又有何关系?原子中:质子数=电子数阳离子中:质子数>电子数;阴离子中:质子数<电子数;MgS不相等\n原子和离子的区别原子不带电(质子数=电子数)离子带电(质子数≠电子数)\n2、离子的形成1.离子的概念:带电荷的原子(或原子团)叫做离子。2.阴离子:带负电荷的原子叫做阴离子。 如:O2-、S2-、F-、Cl-、阳离子:带正电荷的原子叫做阳离子。 如:H+、Na+、Mg2+、Al3+3.离子符号的书写:电荷数标注在元素符号的右上角(先写数字后写“+”号)。4.离子所带电荷数由该元素原子的最外层电子数决定。\n2Mg2+表示两个镁离子2Mg2+表示每个镁离子带2个单位的正电荷表示2个镁离子例:Mg2+表示一个镁离子表示带两个单位正电荷的镁离子。意义:1)表示一个某离子2)表示带几个单位正或负电荷的某离子3)离子符号前面的系数表示离子的个数(重点);\n1.下面A、B、C、D四幅图,你知道那幅图是原子结构图,那幅是离子结构图吗?属于原子的是,依据是。属于离子的是,依据是;其中属于阳离子的是因为。其中属于阴离子的是因为。ACBDDB质子数等于电子数质子数不等于电子数质子数大于电子数质子数小于电子数练一练\n试一试S2-:1个硫离子带两个单位负电荷的硫离子3S2-:3表示:3个硫离子4Fe3+:带3个单位负电荷的铁离子4个铁离子\n判断下列是原子结构图、
离子结构图?并用化学符号表示82+118+17826+168282+81+118282+10SNaCl-O2-NeNa+练习:\n原子阴、阳离子分子物质构成构成构成直接构成得失电子物质与其构成粒子之间的关系\n一个氢原子的质量是:1.67×10-27㎏一个氧原子的质量是:2.657×10-26㎏一个碳原子的质量是:1.993×10-26㎏或0.00000000000000000000000001993千克原子的实际质量由于原子质量太小,书写和使用极不方便。所以国际上一致采用相对原子质量\n1、概念:以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比。作为这种原子的相对原子质量。2、计算公式:Ar=某种原子的质量一种碳原子质量×1/12①相对原子质量是一个比值,不是实际质量。②单位为“1”(省略不写)。注意四、相对原子质量(Ar):\n相对原子质量=已知:一个氢原子的质量为1.67×10-27kg一个碳原子的质量为1.993×10-26kg一个氧原子的质量为2.657×10-26kg,计算它们的相对原子质量你知道公式吗?计算:氢碳氧的相对原子质量\n氢原子的实际质量碳原子质量的×1/12氢的相对原子质量==1.674×10-27kg1.993×10-26kg×1/12≈1氧的相对原子质量=氧原子的实际质量碳原子质量的×1/12=2.657×10-26kg1.993×10-26kg×1/12≈16\n原子质子数中子数电子数相对原子质量H101C666O888Na1112111121623知识点三查出相对原子质量得到:氢是1,碳是12,氧是16,钠是23等等规律是相对原子质量≈质子数+中子数\n分析表格阅读下表(4-1),你能得出什么结论呢?构成原子的粒子种类各粒子的质量(kg)质子1.6726×10-27中子1.6749×10-27电子质子质量的1/18361、质子和中子的质量很小,但远远大于电子的质量。2、原子中:质子的质量≈中子的质量3、原子的质量主要集中在原子核上。\n1.一个碳原子的质量是1.993×10-26Kg,碳的相对原子质量为()A.12gB.1/12C.12D.1.993×10-26Kg/12C2.碳和镁的相对原子质量分别是12和24,则碳和镁的原子质量最之比为()A.12:1B.2:12C.2:1D.1:2D练习\n1.下图是几种粒子的结构示意图,有关它们的说法正确的是()A它们的最外层电子数相同B它们核外都有两个电子层C它们都属于同种粒子D它们都是原子2+1082+17882+882+138A课堂练习\n2.已知质子数和中子数都是6的碳原子的质量为aKg,m个A原子的质量为bKg,则该原子的相对原子质量为()A12b/aB12a/bCb/aD12b/maD课堂练习\n3、铁原子的相对原子质量是()A、56克B、56C、9.288×10-26KgD、1/56B4、某原子的质子数为26,中子数比质子数多4,则该原子中所含微粒总数为()A.26B.56C.82D.86C课堂练习\n4.一个碳原子的质量是1.993×10千克,
碳的相对原子质量为()
(A)12克(B)14(C)12(D)16
5.已知原子的核电荷数,可以确定它的()
(A)相对原子质量(B)质子数
(C)中子数(D)电子数6.原子中决定相对原子质量大小的主要微粒是()
A.质子数和电子数B.质子数和中子数C.中子数和电子数D.核电荷数CBDB课堂练习