- 652.50 KB
- 2022-07-29 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
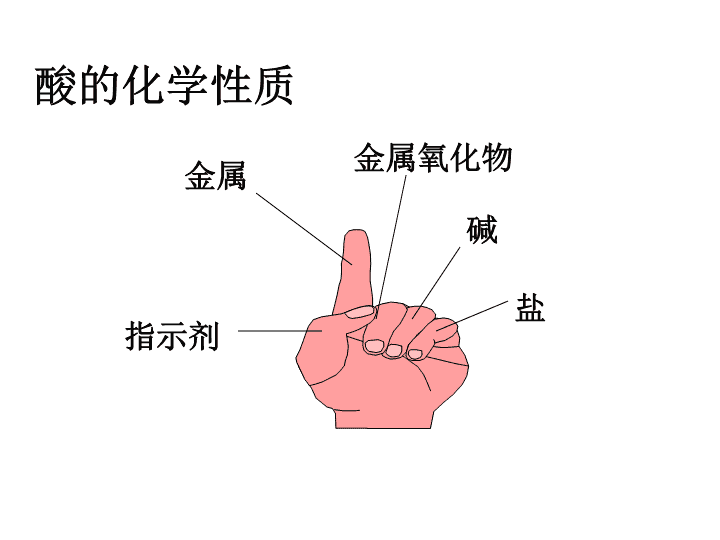
思考:为何盐酸、硫酸等酸具有相似的化学性质?如何用稀硫酸取代盐酸,重复盐酸的性质实验?\n指示剂金属金属氧化物碱盐酸的化学性质\n碱氢氧化钠(酚酞)指示剂(石蕊)H2SO4=SO42-+2H+锌粒金属氧化物CuO盐(Na2CO3)稀硫酸描述现象\n紫色石蕊试液无色酚酞试液稀盐酸稀硫酸总结变色规律?思考:变色的是指示剂还是酸溶液?酸的化学性质1:酸与指示剂的反应:\n酸碱指示剂:紫色石蕊和无色酚酞\n酸的化学性质2:酸+金属=盐+水与稀硫酸的反应镁锌铁铝注意:当铁和盐酸、稀硫酸反应时铁都变成+2价Mg+H2SO4=MgSO4+H2↑Zn+H2SO4=ZnSO4+H2↑Fe+H2SO4=FeSO4+H2↑(该反应的现象?)2Al+3H2SO4=Al2(SO4)3+3H2↑\n酸的化学性质3:酸+金属氧化物=盐+水现象化学方程式铁锈+硫酸氧化铜+硫酸红棕色铁锈逐渐消失,溶液由无色变黄色Fe2O3+3H2SO4=Fe2(SO4)3+3H2O
黑色固体逐渐溶解,无色溶液变成蓝色CuO+H2SO4=CuSO4+H2O思考:该性质的用途?总结文字通式?【实验】(1)在试管中放入少量Fe2O3粉末,再加入1mL稀硫酸(2)在试管中放入少量CuO粉末,再加入1mL稀硫酸思考:FeCl3、Fe2(SO4)3溶液呈黄色与溶液中的什么粒子有关?\n稀硫酸可以用于除铁锈,可观察到____,可是,后来看到铁表面有气泡生成,这气体是怎么来的?是什么?化学方程式为_____。表面生锈的铁钉,除锈时能否将金属制品长时间浸在硫酸中?为什么?Fe2O3+3H2SO4=Fe2(SO4)3+3H2OFe+H2SO4=FeSO4+H2↑\n与Cu(OH)2反应与NaOH反应稀硫酸现象Cu(OH)2+H2SO4=CuSO4+H2O2NaOH+H2SO4=Na2SO4+2H2O酸的化学性质4:酸+碱=盐+水(中和反应)\n与CaCO3反应与Na2CO3反应稀硫酸Na2CO3+H2SO4=Na2SO4+H2O+CO2↑CaCO3+H2SO4=CaSO4+H2O+CO2↑【实验】(1)在试管中放入少量CaCO3粉末,再加入稀硫酸(2)在试管中加入0.5mlNa2CO3溶液,再加入稀硫酸酸的化学性质5:酸+盐=新酸+新盐\n锌粒氧化铁氧化铜氢氧化铜碳酸钠溶液稀硫酸\nH2SO4(稀)Na2CO3NaOHFe2O3Zn指示剂变色ZnSO4+H2↑Fe2(SO4)3+H2ONa2SO4+H2ONa2SO4+H2O+CO2↑酸的通性:\n分别选取少量下列药品与稀硫酸反应,完成
实验报告,探究酸的化学性质:待选试剂现象化学方程式石蕊酚酞ZnFeFe2O3CuOCu(OH)2NaOHNa2CO3CaCO3\n现象化学方程式实验:在盛有稀硫酸的试管中滴入硝酸钡溶液和稀硝酸有白色沉淀生成H2SO4+Ba(NO3)2=BaSO4↓+2HNO3实验室中常用这种方法检验硫酸或能电离出硫酸根离子的物质。BaSO4、AgCl是既不溶于水,又不溶于酸的白色沉淀。\n鉴别盐酸和硫酸?BaCl2或Ba(NO3)2(不可用AgNO3溶液)\n1、稀硫酸有哪些化学性质?2、通过化学反应方程式比较盐酸和稀硫酸的化学性质的异同?想一想(1)使石蕊试液变红(2)某些金属+稀硫酸=盐+氢气(3)某些金属氧化物+稀硫酸=盐+水(4)碱+稀硫酸=盐+水(5)盐+稀硫酸=新的盐+新的酸\n盐酸稀硫酸1、使石蕊试液变红1、使石蕊试液变红2、Zn+H2SO4=ZnSO4+H2↑3、Fe2O3+3H2SO4=Fe2(SO4)3+3H2O4、Cu(OH)2+H2SO4=CuSO4+2H2O5、BaCl2+H2SO4=BaSO4↓+2HCl2、Zn+2HCl=ZnCl2+H2↑3、Fe2O3+6HCl=2FeCl3+3H2O4、Cu(OH)2+2HCl=CuCl2+2H2O5、2HCl+CaCO3=CaCl2+H2O+CO2↑\n课堂练习下列物质放入到稀硫酸中,无气体生成的是()A.铝B碳酸钠C铁锈D石灰石\nFe和H2SO4B.Al和浓H2SO4C.Zn和HNO3D.Ag和稀HCl下列金属跟酸能反应而放出氢气的是()\n不能由金属跟稀硫酸直接反应制得的物质是()A.MgSO4B.FeSO4C.CuSO4D.Al2(SO4)3\n将混有少量氧化铜的铁粉,加入到盛有稀硫酸的烧杯中,充分反应,有部分铁剩余,过滤后,滤液中含有的溶质是( )A.H2SO4B.FeSO4C.FeSO4和CuSO4D.H2SO4和FeSO4【课堂练习】