- 656.99 KB
- 2022-07-29 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
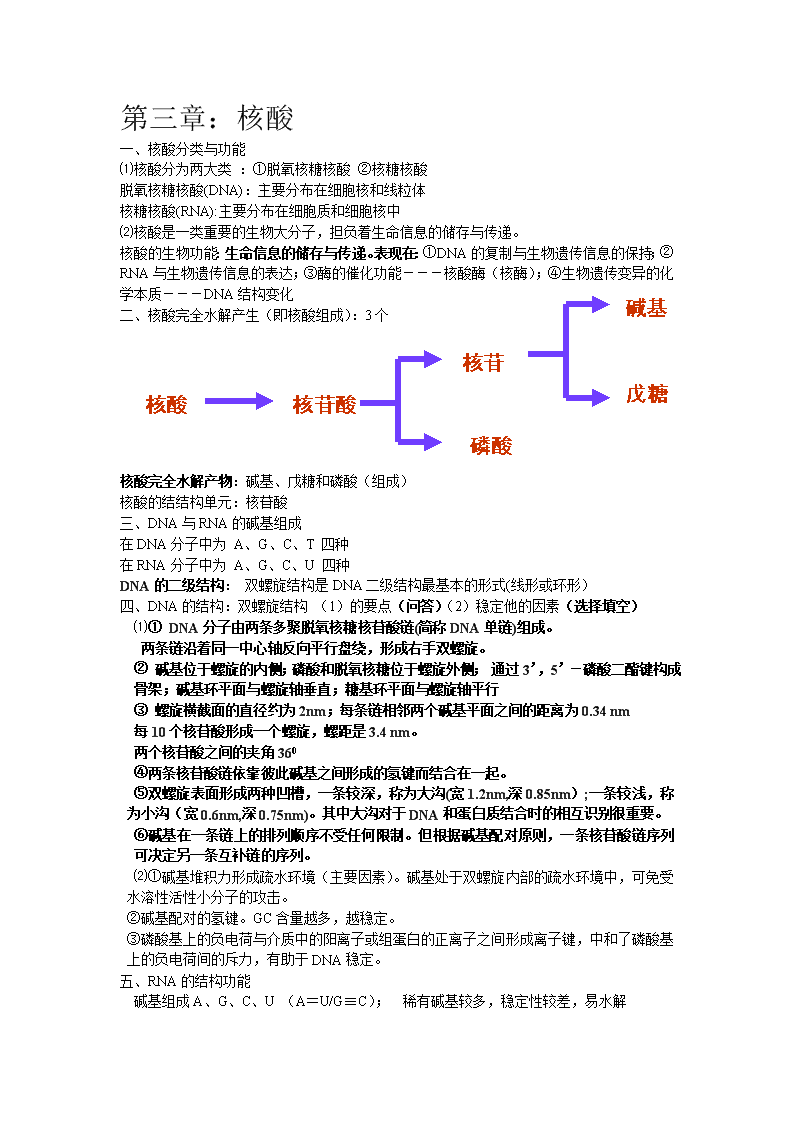
第二章按R基团的极性分类:(4种)(1)非极性氨基酸——疏水性侧链Ala,Ile,Leu,Phe,Met,Trp,Val,Pro(2)极性不带电荷氨基酸—侧链含极性基团(不解离)Ser,Thr,Tyr,Asn,Gln,Cys,Gly(3)极性带正电荷氨基酸——侧链含氨基或亚氨基Lys,Arg,His(4)极性带负电荷氨基酸——侧链均含1个羧基Asp,Glu氨基酸化学性质:(1)α-氨基和α-羧基共同参加的反应与茚三酮反应成肽反应a.与水合茚三酮的反应(定性、定量)p26茚三酮在弱酸性溶液中与氨基酸共热,所有具有游离氨基的氨基酸都生成蓝紫色复合物。脯氨酸和羟脯氨酸与茚三酮反应直接生成的是黄色复合物。b.成肽反应(2)α-氨基参加的反应a.与甲醛的反应:甲醛能与氨基酸中的氨基作用,使氨基的碱性消失。这样就可以用碱来滴定氨基酸的羧基,从而测定氨基酸的含量。这称为氨基酸的甲醛滴定法b.2,4-二硝基氟苯(DNFB)的反应首先被Sanger用来鉴定多肽或蛋白质的N末端氨基酸。2,4-二硝基氟苯缩写为DNFB或FDNB,亦称Sanger试剂c.与异硫氰酸苯酯反应首先被Edman用于鉴定多肽或蛋白质的N端氨基酸。苯异硫氰酸酯缩写为PITCEdman降解法测定氨基酸序列d.与亚硝酸反应鉴定蛋白质或N末端主要试剂有2种:2,4-二硝基氟苯,异硫氰酸苯酯C-末端分析(Sanger试剂,DNFB或FDNB):羧肽酶法;还原法;肼解法1、蛋白质结构(一、二、三、四)(1)一级结构:指多肽链中氨基酸的组成及排列顺序(主要为肽键,包括二硫键)。一级结构是蛋白质空间构象和特异生物学功能的基础。一级结构→决定→高级结构→决定→功能(2)二级结构:指肽链的主链在空间的排列,或规则的几何走向、旋转及折叠。由肽键和α-碳原子构成的多肽链骨架称为主链,伸展在外的R基团称为侧链。维系力:链内或链间形成的氢键。主要有aa-螺旋、bb-折叠、bb-转角。\n(3)三级结构:是建立在二级结构、超二级结构乃至结构域的基础上的,多肽链进一步折叠卷曲形成复杂的球状分子结构,称为三级结构。维系力:有氢键、疏水键、离子键和范德华力等三级结构的重要性:①三级结构形成后,蛋白质分子才形成固有的分子形状;②才具有亲水胶体的特性;③功能蛋白质的活性部位得以形成并表现出相应的生物学活性。(4)四级结构:是指寡聚蛋白中亚基的种类、数量以及各个亚基在寡聚蛋白质中的空间排布和亚基间的相互作用。维系力:疏水相互作用、范德华力、盐键。2、稳定空间结构的作用力有哪些非共价键:氢键、疏水相互作用力、范德华力、盐键共价键:二硫键3、二级结构主要类型(α—螺旋右手螺旋)影响形成螺旋稳定的因素(问答题)①侧链基团大小的影响,甘氨酸由于侧链太小,构象不稳定,是α螺旋的破坏者;极大的侧链基团(存在空间位阻);②连续存在带相同电荷的氨基酸残基(同种电荷的互斥效应);③有Pro等亚氨基酸存在(不能形成氢键),脯氨酸由于其亚氨基少一个氢原子,无法形成氢键,而且Cα-N键不能旋转,所以是α螺旋的破坏者,肽链中出现脯氨酸就中断α螺旋,形成一个“结节”。4、蛋白质三级结构特点44页⑴含多种二级结构单元;⑵有明显的折叠层次;⑶是紧密的球状或椭球状实体;⑷分子表面有一空穴(活性部位);⑸疏水侧链埋藏在分子内部,亲水侧链暴露在分子表面。5、蛋白质变性的本质:概念(名词解释)⑴天然蛋白质在某些物理或化学因素的作用下,其空间结构(次级键,特别是氢键)被破坏,使其理化性质和生物学性质都发生改变,但一级结构不被破坏,这种现象称为蛋白质的变性。⑵变性实质:维系蛋白质空间结构的次级键断裂,其特定的空间结构被改变或破坏。6、蛋白质的沉淀反应:概念(名词解释)概念:在一定条件下,蛋白疏水侧链暴露在外,肽链融会相互缠绕继而聚集,因而从溶液中析出。变性的蛋白质易于沉淀,有时蛋白质发生沉淀,但并不变性。7、蛋白质的颜色反应\n第三章:核酸一、核酸分类与功能⑴核酸分为两大类:①脱氧核糖核酸②核糖核酸脱氧核糖核酸(DNA):主要分布在细胞核和线粒体核糖核酸(RNA):主要分布在细胞质和细胞核中⑵核酸是一类重要的生物大分子,担负着生命信息的储存与传递。碱基核酸的生物功能:生命信息的储存与传递。表现在:①DNA的复制与生物遗传信息的保持;②RNA与生物遗传信息的表达;③酶的催化功能---核酸酶(核酶);④生物遗传变异的化学本质---DNA结构变化二、核酸完全水解产生(即核酸组成):3个核苷戊糖核苷酸核酸磷酸核酸完全水解产物:碱基、戊糖和磷酸(组成)核酸的结结构单元:核苷酸三、DNA与RNA的碱基组成在DNA分子中为A、G、C、T四种在RNA分子中为A、G、C、U四种DNA的二级结构:双螺旋结构是DNA二级结构最基本的形式(线形或环形)四、DNA的结构:双螺旋结构(1)的要点(问答)(2)稳定他的因素(选择填空)⑴①DNA分子由两条多聚脱氧核糖核苷酸链(简称DNA单链)组成。两条链沿着同一中心轴反向平行盘绕,形成右手双螺旋。②碱基位于螺旋的内侧;磷酸和脱氧核糖位于螺旋外侧;通过3’,5’-磷酸二酯键构成骨架;碱基环平面与螺旋轴垂直;糖基环平面与螺旋轴平行③螺旋横截面的直径约为2nm;每条链相邻两个碱基平面之间的距离为0.34nm每10个核苷酸形成一个螺旋,螺距是3.4nm。两个核苷酸之间的夹角360④两条核苷酸链依靠彼此碱基之间形成的氢键而结合在一起。⑤双螺旋表面形成两种凹槽,一条较深,称为大沟(宽1.2nm,深0.85nm);一条较浅,称为小沟(宽0.6nm,深0.75nm)。其中大沟对于DNA和蛋白质结合时的相互识别很重要。⑥碱基在一条链上的排列顺序不受任何限制。但根据碱基配对原则,一条核苷酸链序列可决定另一条互补链的序列。⑵①碱基堆积力形成疏水环境(主要因素)。碱基处于双螺旋内部的疏水环境中,可免受水溶性活性小分子的攻击。②碱基配对的氢键。GC含量越多,越稳定。③磷酸基上的负电荷与介质中的阳离子或组蛋白的正离子之间形成离子键,中和了磷酸基上的负电荷间的斥力,有助于DNA稳定。五、RNA的结构功能碱基组成A、G、C、U(A=U/G≡C);稀有碱基较多,稳定性较差,易水解\n多为单链结构,少数局部形成螺旋;分子较小六、RNA的种类:3种;tRNA,mRNA,rRNA它们的功能①tRNA(转运RNA):转运氨基酸。(结合活化氨基酸(3´-CCA-OH),搬运氨基酸到核糖体;识别mRNA密码子,参与蛋白质的翻译。)(分子量最小,约由73-93个核苷酸组成;稀有碱基最多(10-20%)3’-末端都具有-CCA-OH的结构;5’-末端磷酸化,常为pG(pC)含有保守序列:有十几个位置的核苷酸是不变的,如第8位的U,第18,19位的G等,对维持tRNA的三级结构和生物功能起重要作用。)②rRNA:核蛋白体组分占RNA总量的80%;核糖体:rRNA+蛋白质,40%蛋白质,60%rRNA催化肽键合成的是rRNA;蛋白质维持rRNA构象,起辅助作用③mRNA(信使RNA)——蛋白质合成的模板(把DNA所携带的遗传信息,按碱基互补配对原则,抄录并传送至核糖体,用以决定其合成蛋白质的氨基酸排列顺序)占细胞总RNA的3%~5%;代谢快,寿命短碱基的排列顺序决定蛋白质肽链上氨基酸的排列顺序七、核酸的变性、复性1、(1)核酸的变性:在某些理化因素作用下,如加热,DNA分子互补碱基对之间的氢键断裂,使DNA双螺旋结构松散,变成单链的过程。不涉及共价键3’,5’-磷酸二酯键的断裂,所以它的一级结构(碱基顺序)保持不变降解:多核苷酸骨架上共价键断裂,引起相对分子质量降低(2)变性的因素:温度升高、酸碱度改变、有机溶剂(甲醛、尿素)。变性后的表现:粘度降低、浮力密度上升,沉降速度增加,增色效应等。2、(1)变性DNA在适当条件下,两条互补链可重新恢复天然的双螺旋构象,这一现象称为复性,产生减色效应。DNA复性后,一系列性质将得到恢复,但是生物活性一般只能得到部分的恢复。对于热变性的DNA,在缓慢冷却的条件下可重新结合恢复双螺旋结构,称为退火。(2)复性的条件:A、将热变性的DNA骤然冷却至低温时,DNA不可能复性。即淬火。B、将变性的DNA缓慢冷却时,可以复性。退火温度=Tm-25℃C、分子量越大复性越难。浓度越大,复性越容易。此外,DNA的复性需要一定的盐浓度,也与它本身的组成和结构有关。(3)影响复兴的因素:①单链片段浓度越高,随机碰撞的频率越高,复性速度越快。②较大的单链片段扩展困难,链间错配频率高,复性较慢。③片段间的重复序列多,则容易形成互补区,因而复性较快。④维持溶液一定的离子强度,消除磷酸基负电荷造成的斥力,可加快复性速度。八、增色效应与减色效应概念(名词解释)增色效应:核酸变性后,由于双螺旋解体,碱基暴露,在260nm的吸光值比变性前明显升高的现象。减色效应:在DNA复性(恢复双链)的过程中则伴随着光吸收的减少。九、二级(三叶草)、三级(“L”)问答题\n额外环四环四臂D环UANTψC环反密码子反密码子环321载运氨基酸氢键和碱基堆积力是稳定倒L的因素。第五章1、生物膜的概念、化学组成(选择或判断)①细胞中各种不同的膜统称为生物膜。包括围在细胞质外围的质膜和细胞器的内膜系统②化学组成:糖类、脂质、蛋白质2、生物膜的不对称性、流动性结构特点(1)生物膜的不对称性①膜脂的分布不对称,即膜脂双分子层内外两侧的脂种类、含量不同,如人红细胞质膜:v膜的外层卵磷脂、鞘磷脂较多v膜的内层脑磷脂、磷脂酰丝氨酸较多②膜蛋白的分布不对称如线粒体内膜中的NADH电子传递链各组分:vCyt氧化酶、琥珀酸脱氢酶在线粒体内膜内侧vCytc在线粒体内膜外侧③糖蛋白和糖脂中的多糖只分布在膜的非细胞质一侧(2)生物膜流动性:膜的流动性主要是指膜脂及膜蛋白流动性n膜脂的流动性主要决定于磷脂分子。n在生理条件下,磷脂大多呈流动的液晶态①磷脂分子在膜内作侧向扩散或侧向移动②磷脂分子在脂双层中作翻转运动③磷脂烃链围绕C—C键旋转而导致异构化运动④磷脂分子围绕于膜平面相垂直的轴左右摆动⑤磷脂分子围绕于膜平面相垂直的轴作旋转运动(3)影响膜脂的流动性的大小的因素:n与磷脂分子中脂肪酸链的长短及不饱和程度密切相关:n链越短,不饱和程度越高,流动性越大。\nn受环境温度影响n在一定限度内,温度升高,膜脂流动性增强;温度降低,流动性减弱。n当温度降至一定值时,膜脂从流动的液晶态转变为类似晶体的凝胶态,这个温度称为相变温度。凝胶状态也可再熔解为液晶态.3、生物膜的功能⑴保护细胞—结构、形状⑵物质传送—转运物质⑶信息传递—如神经信号传导⑷能量交换—如化学能®生物能⑸细胞识别(免疫)—专一性抗原受体物质传送分为:主动运输(指物质逆浓度梯度,需消耗代谢能,并需专一性的载体蛋白。)被动运输(被动运输指物质顺浓度梯度,不需要消耗代谢能的运输方式。)又分为简单扩散(无需载体)、协助扩散(需要载体)第六章1、酶的概念:酶是由活性细胞产生的生物催化剂。(除有催化活性的RNA之外几乎都是蛋白质。)2、酶的化学本质(判断)酶的化学本质—蛋白质(核酸)3、酶的作用的特点⑴与一般催化剂的相同点①反应前后质与量不变,且用量少。②.缩短到达平衡的时间,不改变平衡点。③.只能催化本来进行的反应。④.降低反应所需活化能。(2)与一般催化剂的不同点①.高效性比一般催化剂高106—1013倍②高度专一酶对催化的反应和反应物有严格的选择性③.条件温和(酶易失活)引起蛋白质变性的因素都能使酶失活。④.活性能调节、控制⑤常需要辅助因子4、结构化学组成1.单纯蛋白酶类:只是由氨基酸组成,此外不含其他成分,其活性仅仅决定于它的蛋白质结构。2.结合蛋白酶类:这些酶其蛋白质部分称之为酶蛋白,非蛋白质部分称为辅因子(或辅助因子)。酶蛋白与辅因子单独存在时,均无催化活力,或活性很弱,结合在一起组成全酶后,才表现有明显的催化作用。5、(1)根据反应性质可分为:①氧化还原酶类②转移酶类③水解酶类④裂合酶类⑤异构酶类⑥合成酶类(2)据化学组成分类:(填空题)①.单纯蛋白酶类:只是由氨基酸组成,此外不含其他成分,其活性仅仅决定于它的蛋白质结构。②.结合蛋白酶类:这些酶其蛋白质部分称之为酶蛋白,非蛋白质部分称为辅因子(或辅助因子)。酶蛋白与辅因子单独存在时,均无催化活力,或活性很弱,结合在一起组成全酶后,才表现有明显的催化作用。\n绝对专一6、酶的专一性(图)(问答题)键专一结构专一相对专一旋光异构顺反异构基团专一立体(异构)专一专一性酶的专一性:酶对底物和催化的反应有严格的选择性。一种酶仅能作用于一种底物或结构上相似的一类物质,促进发生一定的化学反应7、辅酶及维生素类型(重点掌握B1、B6、B2)维生素的特点:①种类多②需要量少③常常需要从食物中获得④大部分充当辅酶(1)、维生素B1—硫胺(素)(抗神经炎V、抗脚气病V)缺乏症:1.脚气病2.中枢神经和肠胃患糖代谢失常功能:以辅酶方式参加糖的分解代谢。TPP是脱羧酶、脱氢酶的辅酶。分布:在米糠、麦麸、黄豆、酵母、瘦肉等食物中含量最丰富。(2)、维生素B2(又称核黄素)维生素B2的生理功能:是作为递氢辅酶(FMN、FAD),参与生物氧化作用。维生素B2每人每天需要量:儿童0.6mg,成人1.6mg。动物体内不能合成维生素B2。过量则排出。膳食中长期缺乏:口角炎、舌炎、唇炎、眼睑炎,角膜血管增生等症状。\n分布:广泛存在于动、植物中。在酵母、肝肾、蛋黄、奶及大豆中含量丰富。(3)维生素B6又称吡哆素,包括吡哆醇、吡哆醛、吡哆胺。功能:作为辅酶参加多种代谢反应,包括脱羧、转氨、氨基酸内消旋、Trp代谢、含硫氨基酸的脱硫、羟基氨基酸的代谢和氨基酸的脱水等。缺乏症:导致皮肤、中枢神经系统和造血机构的损害,可以引发皮炎。分布:动植物中分布很广,谷类外皮含量尤为丰富。同时肠道细菌也能合成供人体需要。8、酶蛋白结构分为3种(1).单体酶(2).寡聚酶(3).多酶复合物9、酶的结构(图)结合部位催化部位酶的结构必需基团其它部分活性中心活性中心以外的必需基团必需基团:直接或间接与酶催化活性相关的多肽链上某些氨基酸残基组成的功能基团10、酶的作用机理:(大题)(1)酶作用专一性机理1.锁钥学说:认为整个酶分子的天然构象是具有刚性结构的,酶表面具有特定的形状。酶与底物的结合如同一把钥匙对一把锁一样。此学说可以较好的解释酶的立体异构专一性;但不能解释酶的多底物现象、酶对正反方向的催化等。2.诱导契合学说—酶受底物诱导而变形该学说认为酶的活性部位并不是和底物的形状正好互补的。而是在酶和底物结合的过程中,底物分子或酶分子,有时是两者的构象同时发生了一定的变化后才互补的。这时催化基团的位置也正好在所催化底物键的断裂和即将生成键的适当位置。这个动态的辨认过程称为诱导契合。(2)酶作用高效性机理中间产物学说(3)影响酶高效性的因素1.邻近定向效应2.底物的形变和诱导契合3.亲核催化/亲电催化(共价催化)4.酸碱催化5.微环境的影响11、抑制剂对酶反应速度的影响:(1)抑制作用与抑制剂(2)抑制作用的类型(3)可逆抑制作用的动力学特征(4)一些重要的抑制剂抑制作用的类型:一些重要的抑制剂\na不可逆抑制剂1.有机磷化合物—与酶活性直接有关的丝氨酸上的-OH牢固地结合,从而抑制某些蛋白酶或酯酶。(敌百虫、敌敌畏、农药1605等)2.有机汞、有机砷化合物—与酶蛋白上的-SH作用,从而抑制含-SH酶的活性。(对氯汞苯甲酸)3.氰化物、硫化物和CO—这类物质能与酶中的金属离子形成较为稳定的络合物,使酶的活性受到抑制。4.重金属—Ag、Cu、Hg等盐能使大多数酶失活,加入EDTA可以除去。5.烷化剂—这一类试剂中往往含一个活泼的卤素原子,如碘乙酸、碘乙酰胺和2,4-二硝基氟苯等,使酶蛋白中的–SH、-NH2、-OH等发生烷基化,失活。6.青霉素—抗菌素类药物,与糖肽转肽酶活性部位Ser-OH共价结合,使酶失活b.可逆抑制剂在可逆抑制剂中最重要的是竞争性抑制剂。如:磺胺药、氨基叶酸等。用增加底物浓度的方法可以减弱抑制作用。12、别构调控、共价修饰(名词解释)别构调控:酶分子除了具有活性中心外,还具有调节部位,酶的调节部位可以与某些化合物可逆地非共价结合,使酶的构象发生改变,进而改变酶催化活性,这种调节方式称为别够调控。共价修饰:在其他酶的催化作用下,某些酶蛋白肽链上的一些基团可与某种化学基团发生可逆的共价结合,从而改变酶的活性,此过程称为共价修饰。13、酶原的激活及本质酶原与酶原的激活:酶原——酶在生物体内首先合成出来的无活性前体。酶原的激活——酶原必须在一定的条件下去掉一个或几个特殊的肽键,从而使酶的构象发生一定的变化,才有活性,这一过程称为酶原激活。激活的本质或本质:酶的活性中心形成或暴露的过程14、影响酶促反应速度的因素:底物浓度[S]、酶浓度[E]、反应温度、pH值、抑制剂、激活剂第八章1、能量流通的货币:ATP(ATP作用:是能量的携带者或传递者,而非贮存者,ATP是磷酸基团的传递者。)2、新陈代谢、生物氧化的概念(名词解释)新陈代谢概念:生物与外界环境进行物质交换与能量交换的全过程生物氧化的概念:有机物在生物体内氧的作用下,生成H20和CO2并释放出能量的过程。也称呼吸作用。水和二氧化碳的生成过程(1)CO2的生成方式:糖、脂、蛋白质等有机物经一系列脱氢、加水反应,转变成含羧基的中间化合物,然后在酶催化下脱羧而生成CO2。类型:直接脱羧和氧化脱羧(2)H2O的生成代谢物在脱氢酶催化下脱下的氢由相应的氢载体(NAD+、NADP+、FAD、FMN等)所接受,再通过一系列递氢体或递电子体传递给氧而生成H2O。3、电子传递链(呼吸链)的位置:真核……线粒体内膜;原核…….细胞核)(填空)呼吸链的五个成员(填空题)(1)烟酰胺脱氢酶类(2)黄素脱氢酶类(3)铁硫蛋白类(4)辅酶Q类(5)细胞色素类4、呼吸链的分类:根据接受氢的初受体不同,典型的呼吸链有两条NADH呼吸链和FADH2呼吸链5、线粒体内膜..作用细胞内的线粒体是生物氧化和氧化磷酸化的主要场所,\nØ线粒体内膜向内折叠形成嵴(cristae),扩大了内膜的面积。Ø内膜表面含有ü执行氧化反应的电子传递链üATP合成酶ü线粒体内膜转运蛋白6、氧化磷酸化的抑制剂(4种);呼吸链阻断剂、解偶联剂、离子载体抑制剂、质子通道阻断剂(懂得选那种抑制剂)第九章1、糖(分为单糖、寡糖、多糖、结合糖)血糖指葡萄糖体内糖的来源内源性:量少,不能满足机体对能量的需要外源性:主要来自植物,从动物性食物中摄入的糖量很少。婴儿,乳汁中的乳糖是主要来源2、糖原分解的三个过程(三种酶)协同作用磷酸化酶(催化1.4-糖苷键断裂)、转移酶(催化寡聚葡萄糖片段转移)、脱枝酶(催化1.6-糖苷键断裂)糖的分解代谢一般指葡萄糖(1)需氧(2)不需氧1分子C6H12O6生成2分子丙酮酸,去路。。。。丙酮酸葡萄糖“糖酵解”不需氧“磷酸戊糖途径”需氧有氧情况缺氧情况好氧生物厌氧生物“三羧酸循环”“乙醛酸循环”CO2+H2O“乳酸发酵”、“乙醇发酵”乳酸CO2+H2O乳酸或乙醇“乳酸发酵”3、糖酵解的位置和3个关键酶糖酵解的位置:糖酵解是在细胞质中进行。不论有氧还是无氧条件均能发生三个关键酶:6-磷酸果糖激酶-1、己糖激酶(或葡萄糖激酶)、丙酮酸激酶4、三羧酸循环的概念(名词解释)关键酶因为在循环的一系列反应中,关键的化合物是柠檬酸,所以称为柠檬酸循环,又因为它有三个羧基,所以亦称为三羧酸循环,简称TCA循环。三羧酸循环的关键酶是柠檬酸合酶、异柠檬酸脱氢酶和a-酮戊二酸脱氢酶系5、三羧酸循环总图\n每完成一次循环,氧化分解掉一份子乙酰辅酶A,可生成10分子ATP6、1分子蛋白质经过糖酵解生成7、活性葡萄糖又称尿苷二磷酸葡萄糖第十章b-氧化磷酸C3化合物丙酮酸乙酰辅酶A糖TCA甘油脂肪酸脂肪脂肪分解代谢总览①②③动物体b-羟丁酸丙酮乙酰乙酰辅酶A乙酰乙酸④1、食物中的脂肪是脂肪:分甘油、脂肪酸(填空)2、β—氧化分为3个步骤(重点):①脂肪酸活化为脂酰CoA(细胞液)②脂酰CoA转运进入线粒体(限速步骤)载体:肉毒碱(L-β-羟基-γ-三甲氨基丁酸)。\n肉毒碱脂酰转移酶:CAT-Ⅰ:位于内膜外侧,催化正反应,是限速酶。CAT-Ⅱ:位于内膜内侧,催化逆反应。③脂酰CoA的β-氧化过程(线粒体)氧化过程包括四个循环步骤:氧化脱氢、水化(加水)、再氧化脱氢、硫解3、酮体代谢(饥饿的时候产生)酮体:糖代谢非正常时,在肝脏中脂肪酸经b-氧化生成的乙酰CoA,大部分转变为乙酰乙酸、b羟丁酸和少量丙酮,这三种物质统称为酮体。产生部位(肝脏线粒体)、的利用(肝外组织)酮体过量酮血症或酸尿症4、合成代谢的关键酶第十一章1、氨基酸代谢2、氨基酸分解的共同途径:脱氨基作用、脱羧基作用(选、填)3、氨基酸产生的NH3以尿素的形式排出体外尿素合成的部位在肝脏第十二章1、嘌呤核苷酸的分解代谢及分解代谢的产物是尿酸别嘌呤醇治疗痛风症机理:1、抑制黄嘌呤氧化酶2、反馈抑制嘌呤核苷酸从头合成的酶系TMP合成:在胸苷酸合成酶催化下,由dUMP甲基化生成;甲基供体:N5,N10-甲烯FH4;dUMP来源:dUDP或dCMP2、核苷酸的从头合成p3183、嘧啶核苷酸的合成\n合成部位:主要在肝细胞液。原料:Gln、Asp、CO2、PRPP等合成方式:先合成嘧啶环,再与磷酸核糖相连(与嘌呤核苷酸的合成不同)。关键的中间化合物:乳清酸。合成过程:先合成UMP,再转变成其他嘧啶核苷酸。第十三章1、转录、复制、翻译、逆转录(名词解释)·复制:以亲代双链DNA为模板,按照碱基互补配对的原则,合成出与亲代DNA相同的子代DNA分子的过程。·转录:双链DNA中的一条链为模板,按照碱基互补配对的原则,合成出与模板DNA互补的RNA分子的过程。·翻译:在mRNA指令下,按照三个核苷酸(三联体密码子)决定一个氨基酸的原则,把mRNA上的遗传信息转换成蛋白质中特定的氨基酸序列的过程。逆转录:病毒以RNA为模扳指导合成DNA的过程2、DNA链合成(复制)的条件、参与DNA复制的条件(底物、模板、引物、酶和蛋白质因子(大题)DNA链合成的条件(重点)底物:dNTP(dATP,dGTP,dCTP,dTTP)模板:单链的DNA引物:寡核苷酸引物(RNA)酶和蛋白质因子3、DNA聚合酶及分类:DNA辅酶Ⅰ、Ⅱ、Ⅲ的作用分类看笔记(大题)RNA的合成过程DNA聚合酶Ⅰ不是复制酶,而是修复酶DNA聚合酶活性,可以使DNA链沿5´→3´方向延长,起始双链DNA局部解开磷酸二酯键形成终止阶段解链区到达基因终点延长阶段3´→5´核酸外切酶的活性,由3´端开始水解DNA链;5´→3´核酸外切酶的活性,由5´端开始水解DNA链;DNA聚合酶ⅡDNA聚合酶Ⅱ是多亚基酶以dNTP为引物,从5´→3´方向合成DNA有3´→5´外切酶的活力,没有5´→3´核酸外切酶的活力DNA聚合酶Ⅲ是一个多亚基的酶(核心酶为αεθ),是DNA的复制酶在模板的指导下,以dNTP为底物,按照5´→3´方向聚合DNA,具有3´→5´外切核酸酶的活性,没有5´→3´核酸外切酶的活性4、逆转录酶的作用三个功能(1)依赖RNA的DNA聚合酶活力(2)RNaseH活力(3)依赖DNA指导下的DNA聚合酶活力是DNA聚合酶,5’-3’方向,需要引物5、RNA的合成与转录(看图)6、RNA聚合酶的组成及功能(各个哑基功能)\n1)全酶——由多亚基组成,α2ββ’σ称为全酶。识别转录起始点并参与解链。(2)α2ββ’称为核心酶,负责RNA链的延长。σ因子功能——识别并结合启动子。β¢——和模板DNA结合β——与底物结合α——酶的连接、装配第十四章1、翻译模板mRNA2、遗传密码:(填空)3、密码子的特点:⑴连续性:密码子无标点符号⑵简并性:氨基酸可以有几组不同的密码子⑶摆动性:密码子专一性由头两位碱基决定⑷通用性:高等和低等生物共用同一套密码;⑸方向性:即解读方向为5′→3′4、核糖体的功能(大题)(1)组成:由rRNA,亚基,蛋白质…..(2)大小亚基分别有不同功能小亚基:可与mRNA、GTP及tRNA反密码区段结合。大亚基:①具有两个不同的tRNA结合点。A位(右):氨酰基位,可与新进入的氨基酰tRNA结合;P位(左):肽酰基位,可与延伸中的肽酰基tRNA结合。②具有转肽酶活性:将给位上的肽酰基转移给受位上的氨基酰tRNA,形成肽键。③具有GTPase活性,水解GTP,获得能量。④具有起始因子、延伸因子及释放因子的结合部位。5、蛋白质合成过程:①氨基酸的活化与转运②肽链合成的起始③肽链的延伸④肽链合成的终止与释放⑤蛋白质的加工、修饰6、蛋白质合成是一个高耗能过程延长时的能量:活化:2个ATP起始:1个GTP进位:1个GTP移位:1个GTP第1个氨基酸参入需消耗3次(活性2+起始1))以后每掺入一个氨基酸需耗4个(活化2+进位1+移位1)第十六章1、代谢调节水品的分类:分子水平调节—酶水平调节酶水平调节\n酶水平的调节酶活性的调节酶含量的调节反馈调节共价修饰调节酶原激活酶合成调节酶降解调节酶合成:真核生物基因表达调控(5个):DNA水平调节、转录水平调节、转录后加工的调节、翻译水平调节、翻译后加工的调节1、2、真核生物基因表达调控(1)、DNA水平调控(2)、转录水平调控(3)、转录后加工的调节(4)翻译水平调节(5)翻译后加工的调节