- 471.25 KB
- 2022-07-29 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
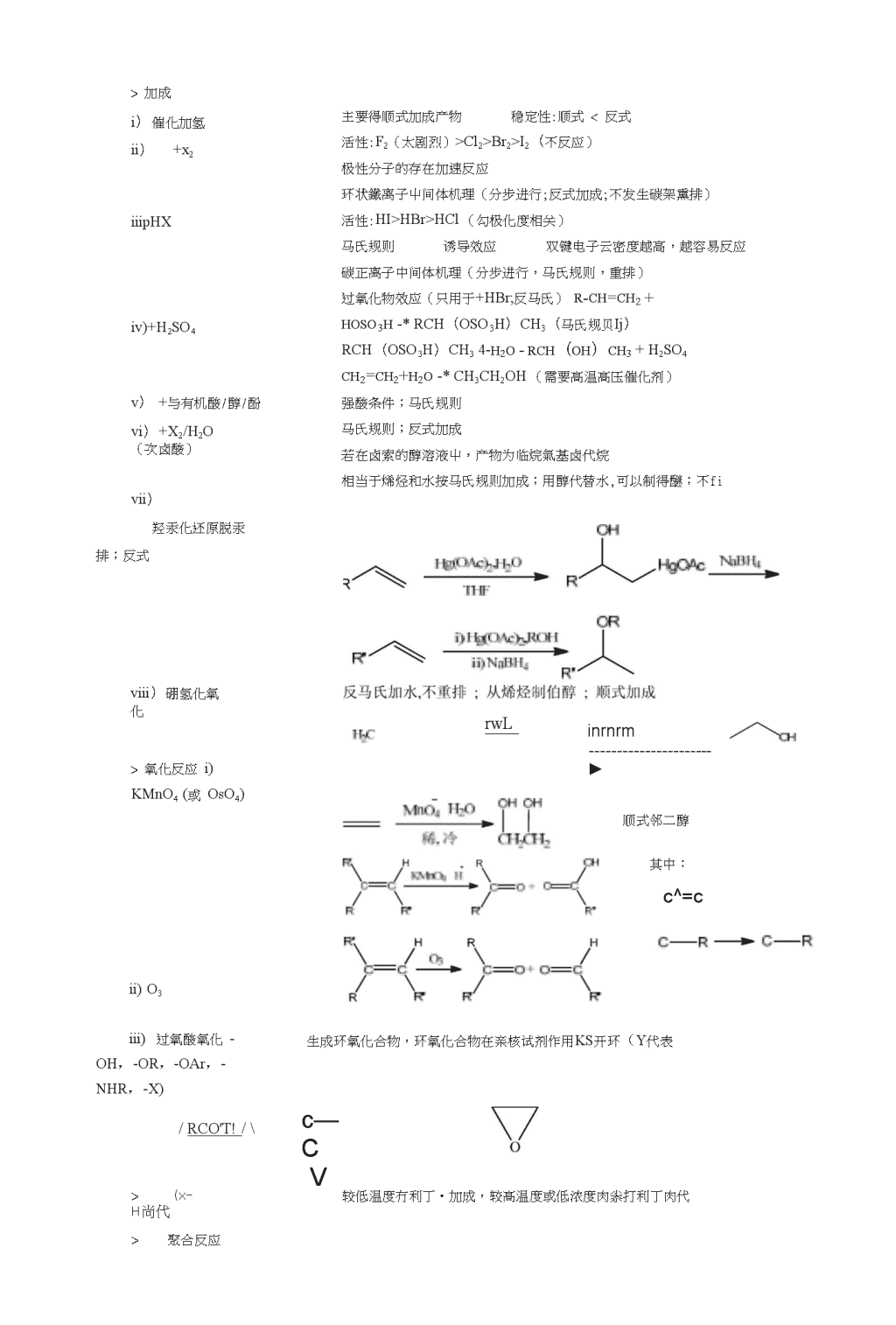
编者按:有机期末考试在即,在此特请我们班数位同学按章整理出各章要点。由于水平有限,知识点未必详尽,但都是大家觉得比较重要的,希望大家能从中对照自己,发现不足,及时加强。另外若觉得有要点遗漏请大家不吝指山,我们互朴I帮助,两相提挈,共同进步。药一的童鞋们,加油啦!!!姜老师寄语:第三章脂环烃(董芳)1.命名(i)单环①有两个取代基“顺反”②多个取代基令位次最低的为参考基团,在前边加“r(ii)当取代基较为复杂是将K环作为取代基(iii)螺环与桥环的命名母体名称很据环上碳原子总数命名为“螺某烷”。根裾环上碳原子总数命名为“某环某烷”。[]内标出各环的碳原子数把各环的碳原子数目(螺掠子不算在内),按由小到人的次序用阿拉伯数•卞写在“螺”和“某院”之M的方拈号里,数字用岡点分开。把各“桥”所含碳胶子的数目(桥头碳原子不算在内),按由大到小的次序用阿拉伯数字写在“二环”和“某浣”之W的方括号里,数字用圆点分开。编号原则环上碳原子的编号顺序:从较小环屮那个和螺原子相邻的碳原子开始编号,沿环向前,经过螺原子,再绕到较人环进行。桥环碳原子的编号顺序:从最长桥的靠近取代基的那个“桥头碳”原子开始,沿桥编到第二个桥头碳原子;再沿次松的桥编回到起始桥头碳原子:设后编S短的桥2化学反应一一大环像烷易取代,小环像烯易加成注:反应总是向生成稳定的结构进行3优势构象应将取代基尽景放在e键,大的取代基放在e键环己烷取代产物的优势构象4十氢化萘反式顺式第四章烯径(张剑武)•命名从主链靠近官能团的一端将主链编号(官能闭具冇敁低位次,取代基具有较低位次)异构体命名顺/反Z/E(按照次序规则,优先基团同侧为Z,异侧为E)注意:顺/反和Z/E并不一一对应•化学性质(加成;氧化;(x-Hg代;聚合)\n>加成i)催化加氢ii)+x2iiipHXiv)+H2SO4v)+与有机酸/醇/酚vi)+X2/H2O(次卤酸)vii)羟汞化还原脱汞排;反式主要得顺式加成产物稳定性:顺式<反式活性:F2(太剧烈)>Cl2>Br2>I2(不反应)极性分子的存在加速反应环状鐵离子屮间体机理(分步进行;反式加成;不发生碳架熏排)活性:HI>HBr>HCl(勾极化度相关)马氏规则诱导效应双键电子云密度越高,越容易反应碳正离子中间体机理(分步进行,马氏规则,重排)过氧化物效应(只用于+HBr;反马氏)r-ch=ch2+hoso3h-*RCH(OSO3H)CH3(马氏规贝Ij)RCH(OSO3H)CH34-h2o-rch(oh)ch3+H2SO4ch2=ch2+h2o-*CH3CH2OH(需要髙温髙压催化剂)强酸条件;马氏规则马氏规则;反式加成若在卤索的醇溶液屮,产物为临烷氣基卤代烷相当于烯烃和水按马氏规则加成;用醇代替水,可以制得醚;不fiviii)硼氢化氧化rwLinrnrm►>氧化反应i)KMnO4(或OsO4)顺式邻二醇其中:c^=cii)O3iii)过氧酸氧化-OH,-OR,-OAr,-NHR,-X)/RCO'T!/\生成环氧化合物,环氧化合物在亲核试剂作用KS开环(Y代表c—CV>(x-H尚代>聚合反应较低温度冇利丁•加成,较髙温度或低浓度肉尜打利丁肉代\n\nnCH2=CH2第五章炔径和二烯径(杨育柳)命名化学性质(酸性>>?-儿烯-?-炔催化加氢;亲电加成;亲核加成;二聚;氧化)和Na反应酸性水>醇>炊氢>氨Pd/Ni:直接成院径Lindlar催化剂:顺式铺烧酸性催化加a式烯烃>亲电加成(X2/HX/H2O)马氏规则反式加成>硼氢化氧化反马氏顺式加成>亲核加成与含活泼氢的试剂加成(醇/羧酸/氢氛酸)>二聚条件:氯化亚铜/氯化铵生成1-丁烯-3-炔>氧化(1<\11104或03)生成羧酸制备邻二卤代物强碱消除共轭二烯烃y*>1,2加成和1,4加成H总是加在链端>Diels-Alder反应亲双烯体上有拉电子莶是活性升高Na/液戰反第六章芳径(朱中意)一化学性质1.亲电取代(机理是加成消除)①卤代一一三价铁②硝化一一浓硫酸浓硝酸催化③磺化一一硫酸加热(可逆)④F-C反应一一烷基化和酰基化(Lewis酸催化,三鉍化铝)(i)烷基化可逆,会发生熏排(ii)芳环连冇吸电子基团不反应(iii)和烯烃,醇等能形成碳正离子的化合物均可反应(iv)注意分子内成环2.氯甲基化\^cm注意:苯环上连有吸电子基不反应,酚和芳胺不反应o:)1rci-►ADChCihCI;3-Gattennann-Koch反应\n注意:苯环上连有吸电子基不反应,主要进入烃基、烷氣基的对位4.氧化还原\nBirch还原一一钠醇液氨4.侧链反应①氣化:所有有a氢的ci碳被氣化成羧基⑦卤代:苄位优先卤代二芳香性——休克而规则条件:①成环原子共平面不是平分子)②n电子数为4n+2③W合井扼体系(碳无sp3杂化)三两类定位效应S团第七章立体化学(董芳)1.耍注意是构造异构还是立体异构(构型:顺反,对映;构象一一同一化合物)例:c6h12的环烃的构造异构和构型异构各有多少个?2对映异构:实物与镜像不重叠(旋光异构:R〜S)在判断对映体时,首先要判断是否是手性分子3在判断手性(旋光)时从对称下手注意:(1)环►面(2)平面分子无手性(3)丙二烯性(包括螺环和联苯性)4注意手性碳(sp3杂化)和手性分子(从整体)的区别。手性碳屮一种特殊的一一假不对COOHh-KohHO—F^HH—toH称碳原子如COOH,2号碳是R,四号碳是S构型,根据命名R>S所以3号碳是手性碳(S),但分子整体无手性(有对称面),所以3号碳是假不对称原子,命名为(2R,3s,4S)5.Fischer,透视式(伞形式),鋸架式,Newman投影式转换及R/S表示法注意:①秘准Fischer投影式:1号碳原子在最上方或者筑化态最高的原子在最上方②判断R/S构型时,使优先顺序最小的基团在最远处(不一定为氢)其余从大到小排列③Newman&Fischcr转化例\nhc=ch2HOHHCH^例命名及转化为锯架式和Newman式6D/L标记法甘汕醛(为标准Fischer投影式)CHOCHO0HHO.CH2OHCH2OHD型L型7机理的应用明确机理,注意是顺式还是反式,有(^注意重排及邻基参与8酒石酸的三种构型COOH7?HHCCOI•CHCCOIH-hD-RtOH•HCODHIICOCHHOHCOCH内消旋对映体(外消旋)第八章卤代烃(李雷)一命名(注意岗素取代芳环氢,以芳环作为母体:岗素取代侧链则芳环作为取代基)二性质(1)亲和取代反应(SN)条件产物注意oir/n?o/A醇在较复杂的分子中引入羟基CN7醇/△腈分子屮增加一个碳且執基可以转变为其他仃能团NH,(过量〉胺醇(酚)钠醚合成非对称醚(W川iamson醚合成法8以),齒代醇碱性条件卜吋生成环醚炔钠炔增长碳链AgNO3/B/A硝酸酯SN1,鉴定卤代烃(P235比较重要!!!)Nal/丙酮R-ISn2注:前六个耍足伯岗代烃,乙烯型、苯基型一般不反应(2)消除反应(i)脱HX(a)P-消除(乙醇加热)①一般卤代烃:萨伊切夫规则⑦向代烯烃(芳烃):虫成共轭体系③邻/偕/乙烯基鹵:生成炔烃\n③活性顺序:R-I>R-Br>R-CI叔卤>仲卤>伯卤\n(b)a-消除(碱性条件下虫成卡宾,耍求u氢冇足够酸性)(ii)脱X2:条件一一Zn/乙醇/加热制备脂环烃(3)与活泼金屈反应(i)与Mg生成格氏试剂Mg—:-►①R-X无水乙酿(乙烯型氯代烃在THF加热条件下反应)①偶联、;鹵代烃活性过髙以发生偶联,多用溴代烃或氯代烃,但是制备甲基格氏试剂只能用ch3i③格氏试剂易与活泼氢反应(ii)和Li反应R2CuLi+ITX->R-R’+RCu+LiX(R’X只能是伯卤)(4)还原成烷烃可被多种还原剂还原,合成时注意保护三亲核取代机理SN1Sn2特征外消旋(CT越稳定,比例越髙)构型转化步骤分步(一级)一步(二级)稳定因索C*(注意重排)空间位肌活性烯W驻型,苄驻型>3>2>1>乙烯型,苯堪型烯两难型,苄难型>1>2>3>乙烯型,苯难型典型反应AgNOs/R?/ANal/丙酮叫邻基参与1.类型:邻位碳上有①杂原子②双键③苯基2.条件:离去基团和邻基反平行(注意环状化合物的特殊情况)3.特点:构型保持或重排,加速反应五消除机理1.活性:烯丙基型,苄基型>3>2>1>乙烯型,苯基型碘代烃>溴代烃>氯代烃2.方向:萨伊切夫规则(当碱体积较大吋为Hoffman规则)六芳环上的亲核取代1.加成一一消除机理①氯代芳烃活性大一一取决于电负性②处在吸电子基团间位的卤原子不易被取代2.消除一一加成机理①一般在强碱条件下发屯第九章醇酚(王金龙)1.命名a⑷uxiiciyjI2醇酚的酸性酸性和负离子的亲核性相反,故进而可以可以比较负离子的稳定性,并联想到离去基团的相关知识按亲核性排序\ncoI,ocIKCIhboc(ch3)3oc6h5hc=cNO23醇的化学性质纖(1)(i)(ii)(iii)水解机理:烯丙型,苄基型,叔醇,仲醇多fiSN2,伯醇(中醇)是SM活性:HI>HBr>HCl,烯丙型>苄基型>叔醇>仲醇>伯醇<甲醇邻基参与:亲核试剂优先进攻承受正电荷能力强的碳原子例Q2K5iv)卢思卡试剂:无水氯化锌加浓盐酸鉴别伯仲叔醇(2)消去(i)机理:纯的消除均为SN1(ii)活性:正比于碳正离子的稳定性(v)取向:萨伊切夫规则一一氢去氢少,落井下石(vi)重排:给电子芳烃>芳烃>吸电子芳烃>烷烃(3)醇,——’以酌(4)水解注意:磺酸酯在合成中的重要用途一一防止重排,构型保持W-匕(5)注意.•(i)伯醇氧化为醛或羧酸,仲醇氧化成酮,叔醇不易氧化(ii)沙瑞特试剂和鉍铬酸砒啶(P.C.C)可以将氧化控制在醛阶段,且对双键无影响\n\K2CX>7KMU)4„(iv)邻二醇被高碘酸氧化一一每断一个碳碳键加上两个羟基(6)频哪醇重排(i)取向:脱去羟基后生成较稳定的碳正离子(ii)能稳定破正离子的基团优先重排:给电子苯基>苯基>吸电子苯基>烷基4注意格氏试剂在制备醇中的重要用途5烯►醇酸性水合马氏规则羟汞化脱汞马氏规则无重排硼氢化氧化反马氏规则、顺式加成无重排6酚的性质(i)酚的酸性增强,碱性和亲核性减弱(ii)增强了碳氧键,使之不易发生断裂,难以进行像醇一样羟基被取代的反应(iii)羟基共轭,给电子作用使芳环电子云密度增大,更容易进行芳环上的亲点取代7苯酚芳环上的反应傅克反应的催化剂及羟基的定位效应(i)OH(ii)Fries重排和Reimer-Tiemamn反应第十章醚和环氧化合物(周明星)命名较小烃基或苯基写在前面有S杂支链把烷氧基作为取代基环氧化合物以”环氧”开尖化学性质什羊盐;醚键断裂;过氧化物;Claisen重排;环氧化合物开环)年羊盐醚键断裂ii)3°-0-iii)Ar-O-R条件:浓盐酸,低温区分醚和烷烃或脂环烃和Lewis酸形成络合物活性:HI>HBr>HC1Sn2较小烷驻生成卤代烃SN1且叔卤易消除成烯产物为苯酚和卤代烃注意互变异构iv)乙烯基醚和烯酸反应屮成醛/酮过氣化物i)检验a湿润的淀粉KI(变蓝)bKI-HOAc(析出ii)去除aNa2SO3或FeSO4洗涤b蒸馏后存丁•棕色•C:\n>Claiscn重排>环氣化合物开环式开环制备>醇脱水>Williamson>烷氧汞化-脱汞>乙烯基醚>环氧化合物i)4-HCN/NaHSOs饱和溶液ii)+醇护羰基)乙酯HC(OC2H5)3iii)+H2Oiv)+金属(Mg,Li,Na)v)+氨的衍生物(幾基试剂)进入酚羟基邻位,邻位冇取代基吋进入对位(二次重排)酸性:SN2部分SN1机理亲核试剂进攻取代基较多的C马氐规则反碱性:SN2机理亲核试剂进攻取代基较少的C反马规则反式开环制备对称醚伯超+酚钠/醇钠Sn2级数较低的制成卤代烃,较高的制成醇钠或酚钠脂芳混合醚一般制使用酚钠,但芳环上若连宥吸电了基,则可使用卤代芳烃马氏规则ORrc=CH-hI¥*CII^C=CH2i)烯催化氢化P-函代醇+碱Hi)烯烃的过氧酸氧化第H^章醛和酮(徐磊)命名以组含羰基碳的碳链为卞链(兼顾其他宫能团与取代基),M吋出现醛羰基和酮羰基吋命名为xxx醛,酮羰棊为”氧代”化学性质(羰基亲核加成,氧化,还原,其他反应)>亲核加成(活性:醛>酮;脂肪醛>芳醛;芳环上连冇吸电子基则增加活性)醛,脂肪族甲基酮,碳<8的环酮可逆条件:干燥HCl(g)或无水强酸产物是胞二醚(在烯酸下易水解/.保可发生分子内反应(形成五六元环)形成缩酮的反应一般用原甲酸加硫醇(酿性条件)形成硫代缩醛/酮,W催化加氧成亚甲基甲醛、乙醛可反应,羰基若与吸电子基相连更易反应不可逆;空间位附较大吋用Li(如用叔丁基锂制叔醇)反应分步写①RMgX+乙醚/(CH3)3CLi/NaC三CR②H3CT相当于脱一分子水;产物冇顺反和羟氨屯成酮肟在PC15或H2SO4等酸性试剂下发生Beckman重排(p398)(反式迁移,构型不变)>氧化[Ag(NH5)2]OH硝酸银的氨溶液;加热反应生成Agl适用于所宥醛,不影响碳碳双键i)托伦试剂和碳碳三键ii)菲林/班氏试剂Cu2+加热反应,生成Cu2OI,适川于脂肪醛,不影响碳碳双键和碳碳三键iii)Baeyer-Villiger氧化(过氧酸):基团迁移顺序:芳基>叔>仲>伯>甲基;给电子來基>苯基>吸电子苯基迁移基团构型不变醛迁移H得羧酸相当于在迁移基团和羰基碳之间加一个O>还原i)成醇催化加氢同吋还原其他含重键的官能团\n无水LiAlHVNaBR,还原能力LiAlH4>NaBH4不影响碳碳双键和三键Meerwein-Pomidorf还原条件:异W醇铝/异内‘醇不影响碳碳双键/三键/硝基/卤原子\n处醛酮最好的还原剂金属还原生成的临二醇在浓硫酸下熏排McMurry反应ii)成亚甲基Clemmensen还股羟基,氨基)逆反应为Oppenauer氧化单分子还原(Na+EtOH,Fe+CH3CO2H)镁或镁汞齐双分子还原(还原偶联)在非质子溶剂中反应(苯)TiCU+Li/K/Ga还原成烯条件:Zn-Hg/浓HC1不川于对酸敏感的醛酮(含碳碳双键,三键,Wolft'-Kishner-贸鸣龙条件:肼+KOH+商温商压或阱+KOH+H2O+(HOCH2CH2)2O+加热不用于对碱敏感的醛酮硫代缩醛酮iii)歧化(Cannizzaro)没冇a-H的酸和浓碱共热,虫成一份子醇和狻酸交叉歧化吋,甲醛总是氣化成羧酸(亲核位阻小)>其他反应i)Wittig反应C=O+(Ph)3P=CR,R2-C=C+(Ph)5P=OWittig试剂由卤代烃和(PhhP制备对碳碳双键,三键,羧基无影响.岗代烃可力甲基肉7伯卤/仲卤,可含冇其他宫能团,但不能是烯基^ii)安息香缩合(醛)iii)PCl5iv)Cram规则:制备>从不饱和烃制备>从芳烃制备>偕二卤代烃水解>从醇制备试剂>Reimer-Tiemann>Rosenmund还原(p409)>酰氯+冇机金属试剂CN"或VB1催化;交义缩合吋羟基总连在吸电子芳基一边生成偕二卤代物优势构象是最大基团和羰基反式共平面烯烃兑氣化氣甲酰化(p406)炔烃水合侧链控制氧化(P4O7)F-C酰基化Gattermann-Koch不用来制脂肪醛酮;制醛用酸催化,制酮可用酸或碱催化氧化(常用氧化剂:K2Cr2O7/H2SO4CrOj/HOAcKMnO4Sarrett脱氢(伯或仲醇在铜/银作用下脱氢)生成邻位羟基醛条件:鉍仿+强碱酰氯制醛酰氯制酮金属试剂包括:R2CdR2CuLiR2MgX