- 189.84 KB
- 2022-08-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
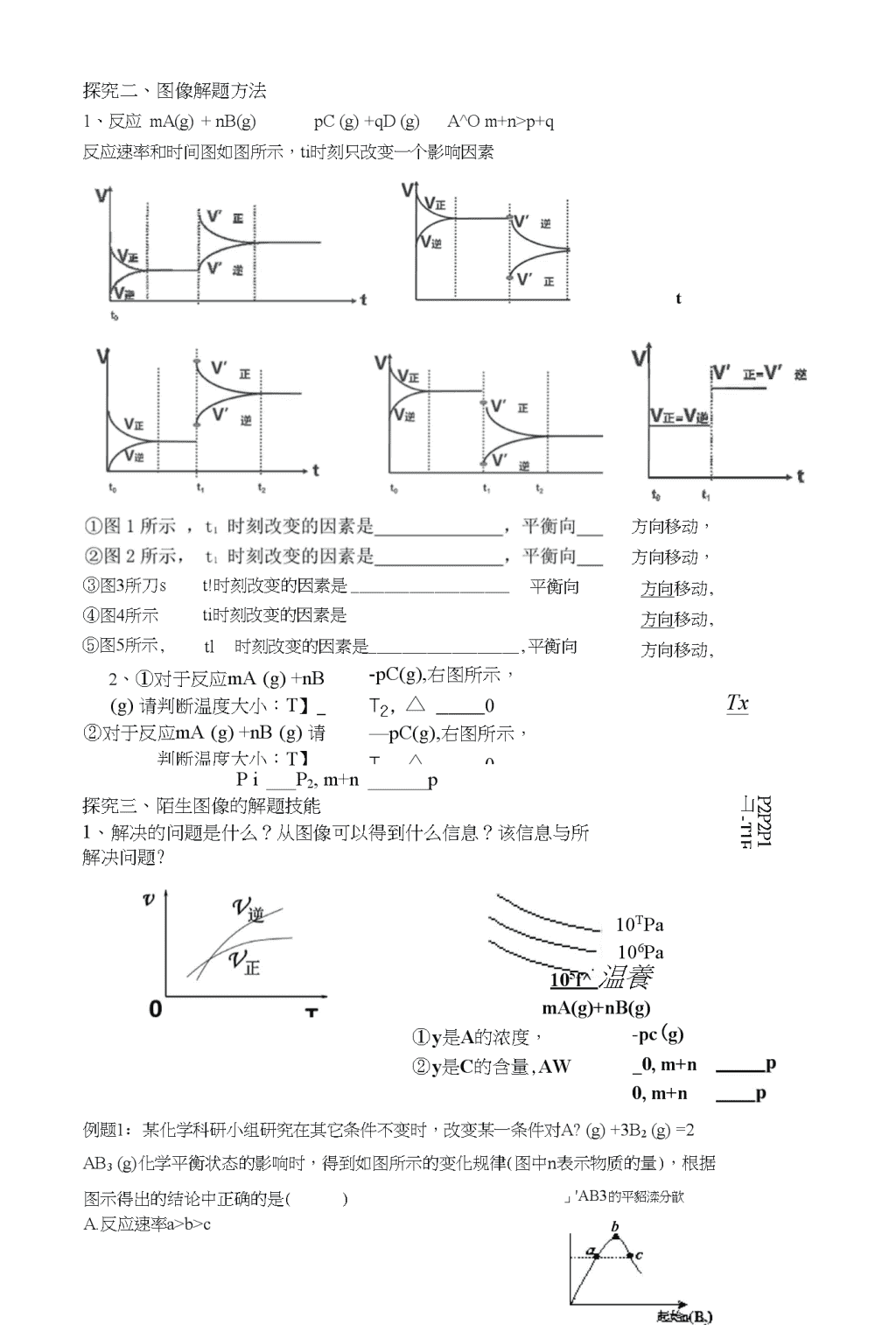
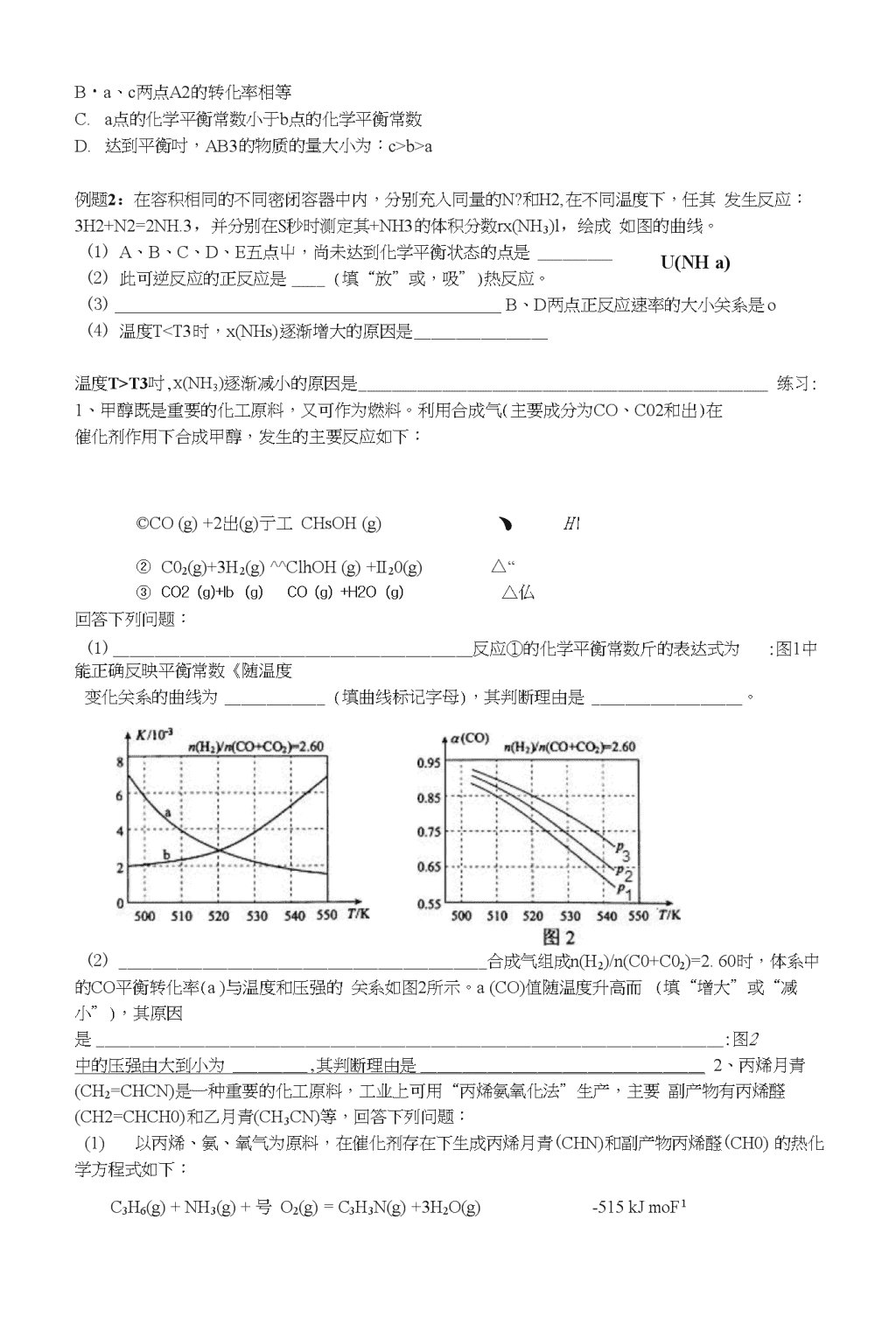
化学平衡图像专题基础知识:对于反应mA(g)+nB(g)pC(g)+qD(g)△*()m+n>p+q保持其他条件不变,只改变一个条件时,请根据反应原理填写表格:条件改变变化结果条件改变v逆v正变化K变化平衡移动反应A的浓度C(A)A转化率C的含量1C(A)增大2C⑷减小3C(C)增大4c(c)减小5温度升高6温度降低7压强增大8压强减小9加催化剂课时探究探究一、图像绘制,读图解题例题氨气有广泛用途,工业上利用反应3H2(g)+N2(g)=2NHs(g)来合成氨气;某小组为了探究外界条件对反应的影响,在Qb两种条件下分别加入相同浓度的氢气和氮气合成氨气,蛍气的浓度随时间变化如下表:时间t/min02468条件ac(H-2)/10"mol・L12.001.501.100.800.80条件bc(H2)/10a条件下,(f4n)in的反应速率为:平衡时,氏的转化率为;平衡常数为;在q条件下,8min末将容器体积压缩至原来的1/2,llmin后达到新的平衡,画出8min"12min时刻c(也)的变化曲线。mol・L12.001.301.001.001.00(1)若探究的条件是温度,条件a、b分别为Ti和T2,则TiT2(填或下同),△“0,根据表格数据请在下面画出c(H2)-t图:\n探究二、图像解题方法1、反应mA(g)+nB(g)pC(g)+qD(g)A^Om+n>p+q反应速率和时间图如图所示,ti时刻只改变一个影响因素③图3所刀st!时刻改变的因素是平衡向t④图4所示ti时刻改变的因素是⑤图5所示,tl2、①对于反应mA(g)+nB(g)请判断温度大小:T】_②对于反应mA(g)+nB(g)请判断温度大小:T】_时刻改变的因素是,平衡向-pC(g),右图所示,t2,△0—pC(g),右图所示,t2,△0方向移动,方向移动,方向移动,方向移动,方向移动,TxPiP2,m+np探究三、陌生图像的解题技能1、解决的问题是什么?从图像可以得到什么信息?该信息与所£解决问题?P2P2P1山-T1F10TPa106Pa105f^温養mA(g)+nB(g)①y是A的浓度,②y是C的含量,AW-pc(g)_0,m+n0,m+n例题1:某化学科研小组研究在其它条件不变时,改变某一条件对A?(g)+3B2(g)=2AB3(g)化学平衡状态的影响时,得到如图所示的变化规律(图中n表示物质的量),根据图示得出的结论中正确的是()A.反应速率a>b>c」'AB3的平貂滦分歆b\nB・a、c两点A2的转化率相等C.a点的化学平衡常数小于b点的化学平衡常数D.达到平衡吋,AB3的物质的量大小为:c>b>aU(NHa)例题2:在容积相同的不同密闭容器中内,分别充入同量的N?和H2,在不同温度下,任其发生反应:3H2+N2=2NH.3,并分别在S秒时测定其+NH3的体积分数rx(NH3)l,绘成如图的曲线。(1)A、B、C、D、E五点屮,尚未达到化学平衡状态的点是(2)此可逆反应的正反应是(填“放”或,吸”)热反应。(3)B、D两点正反应速率的大小关系是o(4)温度TT3吋,x(NH3)逐渐减小的原因是练习:1、甲醇既是重要的化工原料,又可作为燃料。利用合成气(主要成分为CO、C02和出)在催化剂作用下合成甲醇,发生的主要反应如下:©CO(g)+2出(g)亍工CHsOH(g)、H\②C02(g)+3H2(g)^^ClhOH(g)+II20(g)△“③CO2(g)+Ib(g)CO(g)+H2O(g)△仏回答下列问题:(1)反应①的化学平衡常数斤的表达式为:图1中能正确反映平衡常数《随温度变化关系的曲线为(填曲线标记字母),其判断理由是。(2)合成气组成n(H2)/n(C0+C02)=2.60时,体系中的CO平衡转化率(a)与温度和压强的关系如图2所示。a(CO)值随温度升高而(填“增大”或“减小”),其原因是:图2中的压强由大到小为,其判断理由是2、丙烯月青(CH2=CHCN)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCH0)和乙月青(CH3CN)等,回答下列问题:(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯月青(CHN)和副产物丙烯醛(CH0)的热化学方程式如下:C3H6(g)+NH3(g)+号O2(g)=C3H3N(g)+3H2O(g)-515kJmoF1\nC3H6(g)+02(g)=C3H4O(g)+H2O(g)AH=-353kJmoF1两个反应在热力学上趋势均很大,其原因是;有利于提高丙烯月青平衡产率的反应条件是;提高丙烯睛反应选择性的关键因素是O(2)图(8)为丙烯月青产率与反应温度的关系曲线,最高产率对应的温度为460匕低于460°C时,丙烯睛的产率(填“是”或者“不是”)对应温度下的平衡产率,判断理由是;高于460°C时,丙烯月青产率降低的可能原因是(双选,填标号)A.催化剂活性降低B.平衡常数变大t/°C图(a)n(氨)/n(丙烯)图(b)(3)丙烯睛和丙烯醛的产率与刀(氨)In(丙烯)的关系如图(b)所示。由图可知,最佳n(氨)/n(丙烯)约为,理由是。进料气氨、空气、丙烯的理论体积比约为。参考答案:例题2.(1)A、B(2)放热(3)v(D)>v⑻(4)反应开始v正>v逆,反应向右进行生成Mk温度升高反应速率加快,故NHj的体积分数[x(NH:i)]不断增加;当达到平衡以后,温度升高.平衡逆向移动,故NHs的体积分数[x(NHJ不断减少。1.(1)K=c(CHfH);a.反应①为放热反应,平衡常数数值应随温度升高变小c(CO)*c2(//2)(2)减小升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO的量增大,反应③为吸热反应,平衡向右移动,又使产牛CO的量增大,总结果,随温度升高,使CO的转化率降低PAPAP\相同温度下,由于反应①为气体分子数减小的反应,加压有利于提升CO的转化率;而反应③为气体分子数不变的反应,产生CO的量不受压强影响,故增人压强时,有利于CO的转化率升高2.(1)两个反应均为放热量大的反应;降低温度、降低压强;催化剂;(2)不是;该反应为放热反应,平衡产率应随温度升高而降低;AC(3)1:该比例下丙烯膳产率最高,而副产物丙烯醛产率最低;1:7.5:!\n2017国甲27丁烯是一种重要的化工原料,可由丁烷催化脱蛍制备。冋答下列问题:(1)正丁烷(C4Hi0)脱氢制1■丁烯(CH)的热化学方程式如下:®C4H1()(g)=C4H8(g)+H2(g)NH\已知:@C4H10(g)+5O2(g)=C4H8(g)+H2O(g)AH2=-119kJmor1③H2(g)+|o2(g)=H2O(g)A/73=-242kJ-mor,反应①的NH\为kJ-moP'o图(a)是反应①平衡转化率与反应温度及压强的关系图x().1(填“大于”或“小于");欲使丁烯的平衡产率提高,应采取的措施是(填标号)。A.升高温度B.降低温度C.增大压强D.降低压强0300400500600700温度/°C(a)%/槪忙獲JL10080604020I%、褂芒字BA234爪氢气)/”(丁烷)505050505044332211(c)6(1)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、蛍气等。图(b)为丁烯产率与进料气中几(红气)加(丁烷)的关系。图中曲线呈现先升高后降低的变化趋势,英降低的原因是。(2)图(c)为反应产率和反应温度的关系曲线,副产物主耍是高温裂解生成的短碳链坯类化合物。丁烯产率在59()°C之前随温度升高而增大的原因可能是、;590°C之后,丁烯产率快速降低的主要原因可能是o