- 1.75 MB
- 2022-08-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
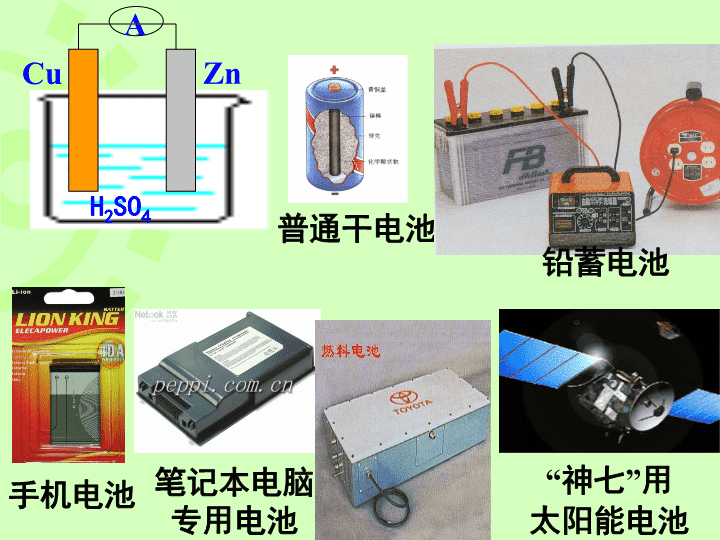
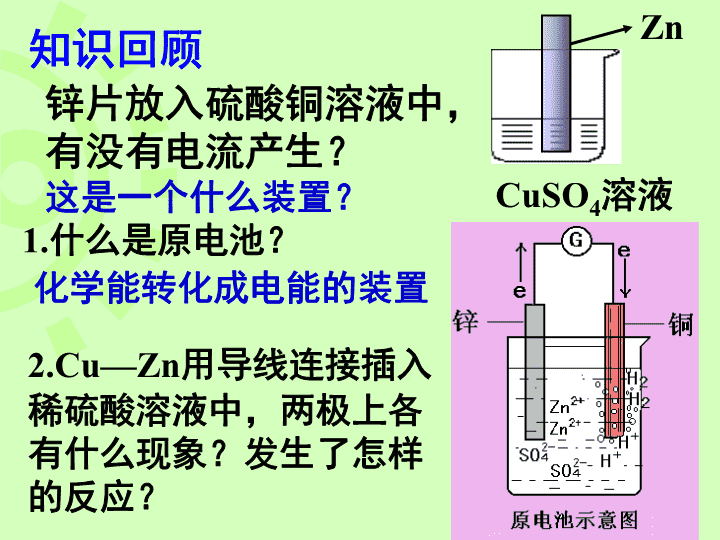
普通干电池手机电池笔记本电脑专用电池“神七”用太阳能电池ACuZnH2SO4铅蓄电池\n第一节原电池高二化学\n知识回顾1.什么是原电池?化学能转化成电能的装置这是一个什么装置?2.Cu—Zn用导线连接插入稀硫酸溶液中,两极上各有什么现象?发生了怎样的反应?锌片放入硫酸铜溶液中,有没有电流产生?ZnCuSO4溶液\nCuZn稀硫酸---Zn2+H+H+灯泡Zn-2e-=Zn2+负极正极2H++e-=H2↑总反应式:Zn+2H+=Zn2++H2↑负正氧化反应还原反应\nCuZn---Zn2+H+H+负极正极阳离子阴离子正极负极SO42-原电池工作原理Ae-\n利用氧化还原反应中电子的转移,使氧化还原反应分开在两极进行,电子从较活泼的金属通过外电路流向较不活泼的金属。原电池的工作原理\n(1)有两种活泼性不同的金属(或一种是非金属单质或金属氧化物)作电极。(2)电极材料均插入电解质溶液中。(3)两极相连形成闭合电路。1.内部条件:能自发进行氧化还原反应2.外部条件:组成原电池的条件\n以下装置不是原电池的请说明原因,是原电池的请写出电极反应式。AAZnCZnZn稀H2SO4CuSO4溶液\nAAC2H5OH稀H2SO4稀H2SO4不是电解质溶液。没有形成闭合回路CuZnZnCu\n实验探究请根据反应:Zn+CuSO4=ZnSO4+Cu设计一个原电池装置,标出电极材料和电解质溶液,写出电极反应方程式.\nCuSO4溶液两个电极上都有红色物质析出电流表指针发生偏转,但随着实验时间的延续,电流表指针偏转的角度越来越小,最终又没有电流通过。负正负极Zn-2e-=Zn2+正极Cu2++2e-=Cu\n实验探究在原有实验基础上进行改进,设计成一个能产生持续稳定电流的原电池。AZnCuZnSO4溶液CuSO4溶液\n盐桥:在U型管中装满用饱和KCl溶液和琼脂作成的冻胶。盐桥中的盐起什么作用?\nZnSO4溶液CuSO4溶液盐桥保障了电子通过外电路从锌到铜的不断转移,沟通内电路传导离子,使之成为闭合回路可使由它连接的两溶液保持电中性。从而持续稳定的产生电流。\n【议一议】原电池的设计设计中需要关注的问题:1、有一个自发进行的氧化还原反应2、要有电极材料3、电解质溶液4、组成闭合回路5、装置\n练习:利用Fe+Cu2+=Fe2++Cu设计一个原电池,画出示意图,写出电极反应。负极:Fe–2e-=Fe2+正极:Cu2++2e-=CuCuFeCuSO4FeSO4FeCuCuSO4\n设计盐桥原电池的思路:还原剂和氧化产物为负极的半电池氧化剂和还原产物为正极的半电池Zn+2Ag+=Zn2++2Ag根据电极反应确定合适的电极材料和电解质溶液外电路用导线连通,可以接用电器内电路是将电极浸入电解质溶液中,并通过盐桥沟通内电路画出装置示意图\n小结:将原电池反应中的氧化反应与还原反应分开在两个不同区域内进行,再用盐桥连接起来从而获得了持续稳定的电流。\n1.(08广东卷)用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U型管)构成一个原电池。以下有关该原电池的叙述正确的是()①在外电路中,电流由铜电极流向银电极②正极反应为:Ag++e-=Ag③实验过程中取出盐桥,原电池仍继续工作④将铜片浸入AgNO3溶液中发生的化学反应与该原电池反应相同A.①②B.②③C.②④D.③④C\n2.(07年海南高考)依据氧化还原反应:2Ag+(aq)+Cu(s)==Cu2+(aq)+2Ag(s)设计的原电池如图所示。请回答下列问题:(1)电极X的材料是;电解质溶液Y是;(2)银电极为电池的极,发生的电极反应为;X电极上发生的电极反应为;(3)外电路中的电子是从电极流向电极。\n3.(09年福建理综)控制适合的条件,将反应2Fe3++2I-⇌2Fe2++I2设计成如右图所示的原电池。下列判断不正确的是A.反应开始时,乙中石墨电极上发生氧化反应B.反应开始时,甲中石墨电极上Fe3+被还原C.电流计读数为零时,反应达到化学平衡状态D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极D