- 2.08 MB
- 2022-08-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
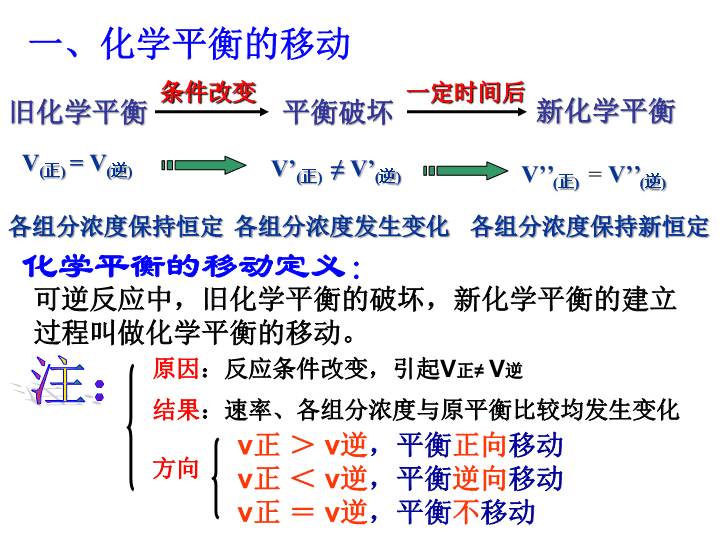
第三节影响化学平衡的条件\n【复习】化学平衡状态的概念:一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。化学平衡的特征:逆等动定变——可逆反应(或可逆过程)——V正=V逆(不同的平衡对应不同的速率)——动态平衡。达平衡后,正逆反应仍在进行(V正=V逆≠0)——平衡时,各组分浓度、含量保持不变(恒定)——条件改变,平衡发生改变(移动)\n一、化学平衡的移动旧化学平衡平衡破坏条件改变新化学平衡一定时间后各组分浓度保持恒定各组分浓度发生变化各组分浓度保持新恒定V(正)=V(逆)V’(正)≠V’(逆)V’’(正)=V’’(逆)化学平衡的移动定义:可逆反应中,旧化学平衡的破坏,新化学平衡的建立过程叫做化学平衡的移动。v正>v逆,平衡正向移动v正<v逆,平衡逆向移动v正=v逆,平衡不移动注:原因:反应条件改变,引起V正≠V逆结果:速率、各组分浓度与原平衡比较均发生变化方向\n【回忆】影响化学反应速率的外界条件主要有哪些?浓度化学反应速率温度压强催化剂【思考】如何通过改变条件来打破旧平衡?可通过改变影响反应速率的条件来打破原有平衡,建立新平衡。\n2、影响化学平衡的条件A、浓度对化学平衡的影响实验探究2-5实验现象滴加5-10滴浓硫酸滴加10-20滴6mol/LNaOH溶液橙色加深溶液黄色加深结论:增加H+的浓度,平衡向逆反应方向移动;减小H+的浓度,平衡向正反应方向移动\n实验探究2-6步骤1加饱和FeCl3溶液加1mol/LKSCN溶液现象步骤2加NaOH溶液加NaOH溶液现象结论溶液红色加深溶液红色加深产生红褐色沉淀,溶液红色变浅产生红褐色沉淀,溶液红色变浅增加Fe3+或SCN-的浓度,溶液颜色加深,平衡向正反应方向移动;减小Fe3+的浓度,溶液颜色变浅,平衡向逆反应方向移动\n总结:增加反应物浓度增加生成物浓度化学平衡向逆反应方向移动化学平衡向正反应方向移动反应物浓度降低生成物浓度降低趋势趋势化学平衡的移动能削弱浓度的改变给可逆反应所带来的影响,但并不能完全抵消。\n练习:可逆反应H2O(g)+C(s)CO(g)+H2(g)在一定条件下达到平衡状态,改变下列条件,能否引起平衡移动?CO的浓度有何变化?①增大水蒸气浓度②加入更多的碳③增加H2浓度①平衡正向移动,CO浓度增大②平衡不移动,CO浓度不变③平衡逆向移动,CO浓度减小\n注意:1、增加反应体系中固体或纯液体的量,并不改变固体及纯液体的浓度,故增加固体及纯液体的量,不会使化学平衡发生移动。2、在生产中,常采用增大容易取得或成本较低的反应物浓度的方法,以提高贵重原料的利用率。\n课本28页:实验探究(实验2-7)2NO2(气)N2O4(气)(正反应为放热反应)(红棕色)(无色)温度对化学平衡的影响现象及分析:降温颜色变浅升温颜色变深平衡向放热方向移动平衡向吸热方向移动\n总结:升高温度降低温度化学平衡向放热的方向移动化学平衡向吸热的方向移动降低温度升高温度趋势趋势化学平衡的移动能削弱温度改变给可逆反应所带来的影响,但并不能完全抵消。\n可逆反应N2+3H22NH3(正反应为放热反应)达到平衡后,其他条件不变,升高温度,则下列说法正确的是()A.V正减小、V逆增大B.V正和V逆均增大C.气体的平均相对分子质量减小D.气体的平均相对分子质量增大BC练习\n在一定条件下,发生CO+NO2CO2+NO的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列有关该反应的说法中正确的是()A.正反应为吸热反应B.正反应为放热反应C.降温后CO的浓度增大D.降温后各物质的浓度不变B练习\n压强对化学平衡的影响压强/MPa15103060100NH3/%2.09.216.435.553.669.46000C,反应2SO3(g)2SO2(g)+O2(g)的实验数据压强/MPa0.10.51.010SO3的分解率/﹪26.314.210.54.6450℃时N2与H2反应生成NH3的实验数据N2+3H22NH3结论:压强/MPa0.10.51.010SO3的分解率/﹪26.314.210.54.6增加右减小左增大压强,氨气含量,平衡向移动增大压强,SO3的分解率,平衡向移动\n总结:增大压强减小压强化学平衡向体积增大的方向移动化学平衡向体积减小的方向移动减小压强增大压强趋势趋势化学平衡的移动能削弱压强改变给可逆反应所带来的影响,但并不能完全抵消。\n反应2HI(g)H2(g)+I2(g)达到平衡时,增大压强平衡如何移动?反应速率如何变化?各物质的量浓度如何变化?\n对于反应前后气体总体积相等的反应例A(气)+B(气)2C(气)+D(固)加压对化学平衡的影响减压对化学平衡的影响V正V逆0t1t2V正’=V逆’t3V正V逆0t1t2V正’=V逆’t3增大压强,正逆反应速率均增大,但增大倍数一样,V’正=V’逆,平衡不移动。改变压强,平衡都不发生移动\n例2、增大压强对于下面处于平衡状态的化学反应有什么影响?说明理由。(1)2SO2+O2⇌2SO3+196.6kJ(2)N2+O2⇌2NO-181kJ(3)CO2+C(固)⇌2CO+Q例3、对于A+B⇌C反应,A的转化率与压强的关系如图所示:据此判断各物质的状态。A的转化率P\n二、压强对化学平衡的影响的规律(2)对于反应前后气体总体积相等的反应增大压强,正逆反应速率均增大,但增大倍数相同,V’正=V’逆,平衡不移动。(3)压强的变化必须改变混合物浓度(即容器体积有变化)才能使平衡移动。(4)平衡混合物都是固体和液体的反应(“无气反应”),改变P,平衡不移动;小结(1)在其它条件不变时,增大压强,平衡向气体体积缩小的方向移动;减小压强,平衡向气体体积增大的方向移动。\n二、影响化学平衡的条件1、浓度:其它条件不变的情况下,增大反应物浓度或减小生成物浓度,平衡均向方向移动;增大生成物浓度或减小反应物浓度,平衡均向方向移动。第三节影响化学平衡的条件一、化学平衡的移动正反应逆反应2、温度:其它条件不变的情况下,升高温度,平衡向方向移动,降低温度,平衡向方向移动吸热反应放热反应3、压强:在其它条件不变时,增大压强,平衡向的方向移动;减小压强,平衡向的方向移动。气体体积缩小气体体积增大\n勒夏特列原理(平衡移动原理)如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动。注意:①是“减弱”这种改变,不是“消除”这种改变②勒夏特列原理适用于任何动态平衡体系(如:溶解平衡、电离平衡等),未平衡状态不能用此来分析\n条件的改变平衡移动的方向平衡移动的结果增大反应物浓度减小生成物浓度升高温度降低压强正反应方向减弱反应物浓度增大的趋势正反应方向吸热反应的方向气体体积增大的反应方向减弱生成物浓度减小的趋势减弱温度升高的趋势减弱压强降低的趋势\n催化剂对化学平衡的影响催化剂同等程度的加快或减慢正、逆反应速率(V正=V逆);对化学平衡无影响。t时间(b)V速率V正V逆0V逆V正′′催化剂能缩短平衡到达的时间\n4、催化剂对于化学平衡的影响请用v-t图来表示催化剂对化学平衡的影响加入正催化剂vtV正V逆V’正=V’逆加入负催化剂vtV正V逆V’正=V’逆加入(正)催化剂能同等程度的加快反应速率,所以平衡不移动,但能缩短达到平衡的时间。