- 156.50 KB
- 2022-08-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
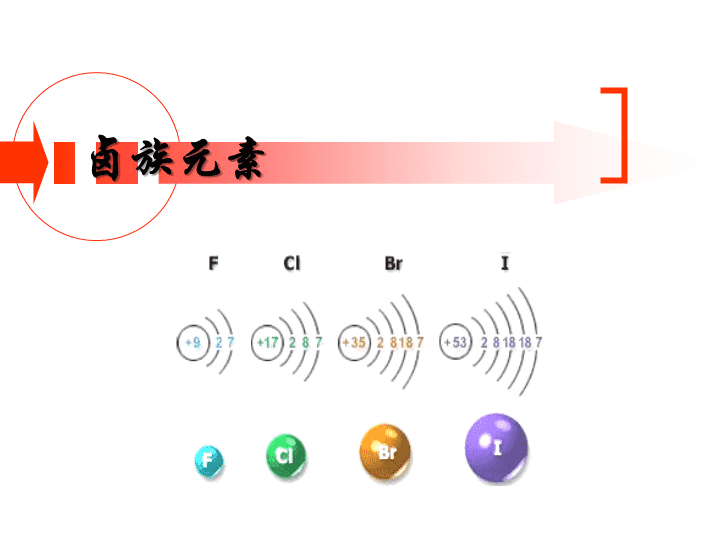
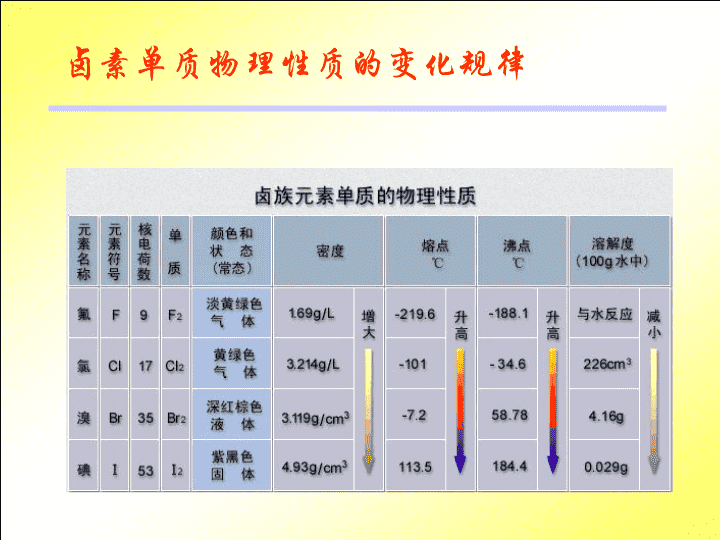
卤族元素\n为什么卤素单质是双原子分子?卤素原子最外层都是7个电子获得一个电子才能形成稳定结构两个卤素原子共用一对电子就能形成8电子所以卤素单质是双原子分子的稳定结构\n卤素单质物理性质的变化规律\n保存溴时,常往盛溴的试剂瓶中加入一些水。请观察盛溴的试剂瓶,根据现象,描述溴的物理性质溴是深红棕色液体密度比水大有刺激性气味可溶于水在水中的溶解度不大溴水呈橙色易挥发溴的蒸气红棕色\n认真观察碘升华实验后,试描述碘的物理性质碘是一种紫黑色固体具升华性质(固态物质不经过转变成液态而直接变成气态的现象)碘的蒸气呈紫色\n溴的溶解性实验CCl4Br2汽油水溴水溴的汽油溶液(橙色)(橙红色)Br2水溴水溴的四氯化碳溶液(橙色)(橙红色)\n碘的溶解性实验CCl4I2汽油水碘水上层:碘的汽油溶液(褐色)(紫红色)I2水碘水下层:碘的四氯化碳溶液(褐色)(深紫色)\n水汽油(苯)四氯化碳溴碘黄至橙色橙至橙红橙至橙红黄至褐色淡紫至紫红紫至深紫溴和碘在不同溶剂中所生成溶液(由稀至浓)的颜色变化碘酒就是碘的酒精溶液,呈棕褐色。\n卤素氟氯溴碘氧化性逐渐减弱相同点:最外层7个电子易得一个电子,不同点:核电荷数递增电子层数递增原子半径依次增大得电子能力逐渐减弱核电荷数电子层排布元素符号FClBrI91735532,72,8,72,8,18,72,8,18.18,7原子结构性质决定具氧化性\n卤素单质结构相似卤素原子的最外层均有七个电子卤素单质均是通过一对共用电子形成的双原子分子结构决定性质化学性质相似课堂练习:请完成下列反应的化学方程式Cl2+CU==H2+Cl2==Cl2+NaOH=Cl2+H2O=点燃点燃CUCl22HClHCl+HClONaCl+NaClO+H2O2\n2.卤素都能跟氢气反应,生成卤化氢请阅读试比较反应的相似点和差异点,找出递变规律。H2+F2=2HFH2+Cl2=2HClH2+Br2=2HBrH2+I2=2HI冷暗处就能爆炸化合,HF很稳定强光照射爆炸化合,HCl较稳定500度,较慢地化合,HBr较不稳定持续加热,缓慢化合,HI同时分解卤化氢氧化剂反应能力渐弱稳定性渐弱\nH2+I22HI可逆反应在同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应.思考:下面这两个反应是不是可逆反应?为什么?2H2O==2H2+O2通电2H2+O2==2H2O点燃\n卤素单质与水的反应氟与水发生剧烈的反应,生成氟化氢和氧气。请你写出反应的化学方程式,标出电子的转移情况,指出氧化剂和还原剂。2F2+2H2O=4HF+O24e氧化剂还原剂溴跟水反应比氯气跟水的反应更弱一些Br2+H2O=HBr+HBrOCl2+H2O=HCl+HClO(碘跟水只有很微弱的反应)(氟气的特殊性)\n练习:1.卤素单质中,常温下密度最小的是(),受热易升华的是(),熔沸点最高的是(),常温下呈液态的是(),颜色最深的是(),遇水能放出气体的是().2.下列变化远规律不正确的是()A.微粒半径FCl2>Br2>I2D.稳定性HF