- 2.04 MB
- 2022-08-02 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
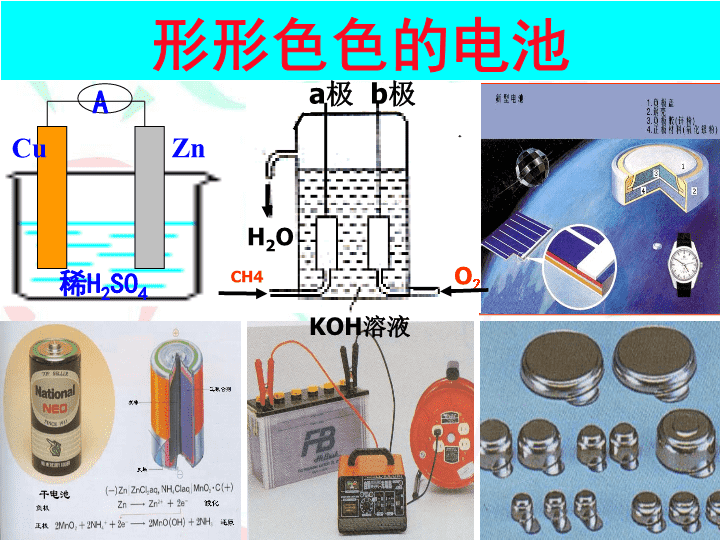
专题1化学反应与能量变化第二单元化学能与电能的转化第二课时\n化学电源\n形形色色的电池ACuZn稀H2SO4KOH溶液CH4O2H2Oa极b极\n用途广泛的电池用于汽车的铅蓄电池和燃料电池化学电池\n用途广泛的电池用于“神六”的太阳能电池笔记本电脑专用电池手机专用电池摄像机专用电池各式各样的纽扣电池\n化学电池一次电池二次电池燃料电池碱性锌锰电池铅蓄电池氢氧燃料电池锂离子电池银锌蓄电池普通锌锰干电池锌银纽扣电池一、化学电池的分类\n二、一次电池普通锌锰电池碱性电池锌筒石墨棒MnO2和C普通锌-锰干电池的结构NH4Cl、ZnCl2和H2O等1、普通干电池负极正极电池反应:氢氧化氧锰(Zn):Zn–2e-=Zn2+(MnO2和C):优点:制作简单、价格便宜。缺点:放电时间短,电压下降快。\n2、碱性锌-锰干电池电解质:KOH负极:——ZnZn+2OH--2e-=Zn(OH)2正极:——MnO22MnO2+2H2O+2e-=2MnOOH+2OH-缺点:多数只能一次使用,不能充电;价格较贵优点:比能量和储存时间有所提高,适用于大电流和连续放电电池反应:Zn+2MnO2+2H2O=2MnOOH+Zn(OH)2\n3、锌银钮扣电池正极:Ag2O+H2O+2e-=2Ag+2OH-负极:Zn+2OH--2e-=ZnO+H2O总反应:Zn+Ag2O=ZnO+2Ag\n三、二次电池1、铅蓄电池\n放电过程总反应:Pb+PbO2+2H2SO4=2PbSO4+2H2OPb+SO42--2e-=PbSO4正极:PbO2+4H++SO42-+2e-=2PbSO4+2H2O氧化反应还原反应负极:①放电过程铅蓄电池充电的反应则是上述反应的逆过程\n②充电过程PbSO4+2e-=Pb+SO42-还原反应阴极:阳极:PbSO4+2H2O-2e-=PbO2+4H++SO42-氧化反应接电源负极接电源正极充电过程总反应:2PbSO4+2H2O=Pb+PbO2+2H2SO4铅蓄电池的充放电过程:Pb+PbO2+2H2SO42PbSO4+2H2O放电充电\n缺点:比能量低、笨重、废弃电池污染环境优点:可重复使用、电压稳定、使用方便、安全可靠、价格低廉其它二次电池镍镉电池、镍氢电池、锂离子电池、聚合物锂离子蓄电池……\n四、燃料电池:燃料电池是一种连续地将燃料和氧化剂的化学能直接转换成电能的化学电池。(氢气、烃、肼、甲醇、氨、煤气燃料电池……)氢氧燃料电池酸性电解质:碱性电解质负极:2H2-4e-+4OH-==4H2O正极:O2+2H2O+4e-==4OH-总反应:2H2+O2==2H2O负极:2H2-4e-==4H+正极:O2+4H++4e-==2H2O总反应:2H2+O2==2H2O\n书写电极反应式应注意以下几点:2.负极失电子所得氧化产物和正极得电子所得还原产物,与溶液的酸碱性有关(如+4价的C在酸性溶液中以CO2形式存在,在碱性溶液中以CO32-形式存在);1.将两极反应的电子得失数配平后,相加得到总反应,总反应减去一极反应即得到另一极反应;3.溶液中不存在O2-:在酸性溶液中它与H+结合成H2O、在碱性或中性溶液中它与水结合成OH-;\n练习1:2004年江苏高考)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌-锰碱性电池以氢氧化钾溶液为电解液,电流总反应式为:Zns+2MnO2s+H2Ol=ZnOH2s+Mn2O3s下列说法错误的是()A电池工作时,锌失去电子B电池正极电极反应式为:2MnO2s+H2Ol+2e=Mn2O3s+2OHaqC电池工作时,电子由正极通过外电路流向负极D外电路中每通过02mol电子,锌的质量理论上减小65gC\n练习2:航天技术上使用的氢氧燃料电池具有高能、轻便、无污染的优点。氢氧燃料电池有酸式和碱式两种,它们放电时的总反应都可以表示为2H2+O2=2H2O,酸式电池中电解质是酸,其负极反应可表示为2H2-4e-=4H+,则其正极反应式为。碱式电池的电解质是碱,其正极反应式为O2+2H2O+4e-=4OH-,则其负极反应可表示为。O2+4e-+4H+=2H2O2H2-4e-+4OH-=4H2O\n练习3:氢气是燃料电池最简单的燃料,虽然使用方便,却受到价格和来源的限制。常用的燃料往往是某些碳氢化合物,如:甲烷、汽油等。请写出将图中氢气换成甲烷时所构成的甲烷燃料电池中a极的电极反应式:,此时电池内总的反应式:。KOH溶液CH4O2H2OabCH4+10OH--8e-=CO32-+7H2OCH4+2O2+2KOH=K2CO3+3H2O\n小结:化学电源1、一次电池2、二次电池3、燃料电池——锌锰干电池——铅蓄电池——氢氧燃料电池掌握每一类典型电池的正负极、电极反应;了解每一类电池的优缺点;对其它电池有初步的认识\n减少污染节约资源\n