- 410.50 KB
- 2022-08-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
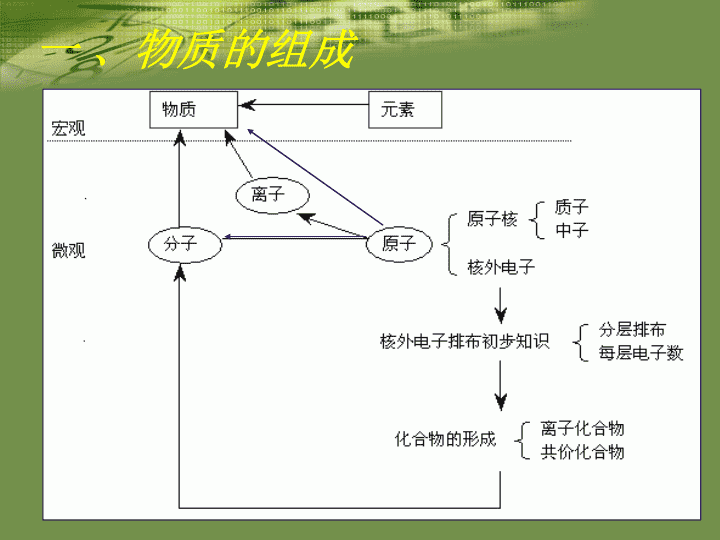
初高中化学衔接\n专题一基本概念及原理黄沙百战穿金甲,不破楼兰终不还。\n一、物质的组成\n注意点一、分子、原子、离子都是构成物质的基本粒子由分子构成的物质:水、二氧化硫、硫酸等由原子构成的物质:金刚石、石墨、金属等由离子构成的物质:多数碱、盐等二、分子是保持物质化学性质的一种粒子三、原子是化学变化中的最小粒子\n易错易混概念之间的联系与区别分 子原 子定义保持物质化学性质的一种粒子化学变化中的最小粒子区别在化学变化中可以再分在化学变化中不可再分,但在核变化中可以再分联系分子由原子构成,分子在化学变化中可以分成原子,这些原子又可构成新的分子\n\n\n\n俄罗斯科学家最近合成了核电荷数为114的元素的原子,经测定该原子的相对原子质量为289,则其中质子数与电子数的差是___________。\n核外电子排布规律能量最低原则:核外电子总是尽先排布在能量最低的电子层里,然后再由里往外,依次排布在能量逐步升高的电子层里。排布规律:a.各电子层最多容纳的电子数为2n2。b.最外层电子数目不超过8个(K层为最外层时不超过2个)。c.次外层电子数目不超过18个,倒数第三层电子数目不超过32个。\n[练习]分别写出He、Ne、Ar、K、Mg、Al、F、S、P的原子结构示意图。写出下列离子的离子结构示意图:\n1996年科学家在宇宙深处发现了H3+离子和H3分子,请回答:(1)1个H3+离子中有________个质子_________个电子。(2)构成H3分子的原子的结构示意图是___________(填序号)(3)H3属于__________。(填混合物或单质或化合物)\n●离子化合物:阴阳离子相互作用形成的化合物
例如:NaCl、MgO、K2S、NaOH、Na2SO4等
注意:离子化合物由阴阳离子直接构成,晶体中不存在分子。
例如:NaCl晶体由Na+和Cl-构成。
●共价化合物:通过共用电子对形成分子的化合物
形成规律:非金属元素之间形成的化合物一般属共价化合物
例如:HCl、H2O、CO2等\n[练习]请表示下列粒子的电子式:K、Mg、Al、F、S、P判断下列物质哪些是离子化合物?哪些是共价化合物?并写出它们的电子式。NaCl、MgCl2、HCl、CO2\n金属非金属物质混合物纯净物单质化合物无机物有机物酸碱盐氧化物元素的存在状态:游离态、化合态二、物质的分类\n\n易错、易混概念之间的联系与区别\n\n\n酸性氧化物:能与碱反应生成盐和水的氧化物包括:大多数非金属氧化物如:CO2、SO2、SO3、SiO2、P2O5等碱性氧化物:能与酸反应生成盐和水的氧化物包括:大多数金属氧化物如:Na2O、CaO、Fe2O3、CuO、MgO等氧化物酸性氧化物碱性氧化物1.氧化物分类\n无氧酸:HClH2S含氧酸:H2SO4HNO3H2CO3H2SO3H3PO4CH3COOH强酸:HClH2SO4HNO3酸酸弱酸:H2CO3H2SO3H3PO4CH3COOHH2S2.酸分类\n3.碱分类碱碱强碱:NaOHKOHCa(OH)2Ba(OH)2弱碱:Mg(OH)2Fe(OH)3Cu(OH)2NH3.H2O……不溶性碱:Mg(OH)2Fe(OH)3Cu(OH)2可溶性碱:NaOHKOHCa(OH)2Ba(OH)2NH3.H2O\n4.盐分类盐正盐:NaClCaCO3BaSO4Na2CO3CuSO4Ba(NO3)2……酸式盐:NaHCO3NaHSO4NaHSNaH2PO4Na2HPO4碱式盐:Cu2(OH)2CO3含氧酸盐:CaCO3BaSO4Ba(NO3)2NaHCO3NaHSO4……无氧酸盐:NaClK2SKIAgCl盐\n[练习]1、下列物质:①含CaO99%的生石灰②CaO刚好与水反应的生成物③水银④浓盐酸⑤含铁70%的三氧化二铁,用编号填入下列空格:属混合物的是,属单质的是,属化合物的是。2、从H、C、O、Na四种元素种,选择适当的元素,按要求写出各物质的化学式。①金属单质、非金属单质;②酸性氧化物、碱性氧化物;③酸、碱、盐。\n.“垃圾是放错了位置的资源”,应该分类回收,生活中废弃的铁锅、铅制易拉罐,铜导线等可以归为一类加以回收,它们属于( )A、氧化物B、盐C、金属或合金D、碱\n三、物质的性质和变化\n物质物理性质化学性质(写出化学反方程式)备注O2通常状况下,氧气是一种无色无味的气体,密度比空气略大。助燃性强氧化性CO2无色无味的气体,比空气重,通常情况下1体积的水能溶解1体积的二氧化碳。不能燃烧,也不能支持燃烧,可用澄清的石灰水来检验。\nH2通常情况下,氢气是一种无色无味的气体,密度很小,约是空气的1/14。H2、C、CO具有相似的化学性质:可燃性和还原性。C具有多种同素异形体:金刚石、石墨、无定形碳CO无色无味气体,难溶于水,密度比空气略小。物质物理性质化学性质(写出化学反应方程式)备注\n物理性质酸、碱、盐的溶解性钾钠铵硝皆可溶、盐酸盐不溶银亚汞;
硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠氨钡溶。\n化学性质1金属的化学性质2碱性氧化物通性3酸性氧化物通性4.盐的通性5.酸的通性6.碱的通性\n1.金属的化学性质:(1)与非金属反应:
(2)与酸反应:
(3)与盐溶液反应:
金属活动顺序表应用:
在金属活动顺序表中,只有排在氢前面的金属才能置换出酸中的氢
(金属越活泼,反应越剧烈)②在金属活动顺序表中,排在前面的金属一般能把排在后面的金属从它们的盐溶液中置换出来\n2.碱性氧化物通性(1)与酸反应:Na2O+2HCl=2NaCl+H2O(2)与水反应:CaO+H2O=Ca(OH)2(3)与酸性氧化物:Na2O+CO2=Na2CO3注意:一般可溶性的碱对应的碱性氧化物才能与水反应
(常见的有:Na2O、K2O、CaO、BaO)\n3.酸性氧化物通性(1)与碱反应:CO2+Ca(OH)2=CaCO3+H2O(2)与水反应:CO2+H2O=H2CO3(3)与碱性氧化物反应:K2O+CO2=K2CO3注意:大多数酸性氧化物能与水反应生成相应的酸,但SiO2不能与水反应\n先介绍电离的概念酸:电离产生的阳离子全都是氢离子HCl==H++Cl-H2SO4==2H++SO42-因为酸的溶液中都含有氢离子所以酸具有相同的化学性质酸的化学性质实质是溶液中氢离子和酸根离子的性质4酸的通性\n酸①酸碱指示剂②金属③碱性氧化物④碱⑤盐盐+氢气盐+水盐+酸石蕊变红、酚酞不变色盐+水\n碱:电离产生的阴离子全都是氢氧根离子NaOH==Na++OH-Ca(OH)2==Ca2++2OH-因为碱的溶液中都含有氢氧根离子所以碱具有相同的化学性质碱的化学性质实质是溶液中金属离子和氢氧根离子的性质5碱的通性\n碱①酸碱指示剂②酸性氧化物③酸④盐盐+水盐+碱石蕊变蓝、酚酞变红盐+水\n6.盐的通性与酸反应酸与盐反应的一般规律:强酸+弱酸盐=强酸盐+弱酸②与碱反应注意:碱和盐反应不仅要求生成物中有沉淀、气体、水三者之一,还要求反应物均溶于水③与盐反应注意:盐和盐反应不仅要求生成物中有沉淀、气体、水三者之一,还要求反应物均溶于水④与金属反应\n下列物质的用途与该物质的物理性质有关的是( )A、用硫酸除去金属表面的锈B、用一氧化碳冶炼生铁C、用氢气作高能燃料D、用干冰进行人工降雨\n下列自然现象的过程中,存在化学变化的是( )A、冰雪融化B、形成酸雨C、发生沙尘暴天气D、二氧化碳物质使地球表面气温升高\n四种反应基本类型表 达 式例 子化合反应A+B=AB分解反应AB=A+B置换反应A+BC=AC+B复分解反应AB+CD=AD+BC\n[练习]写出化学方程式并注明基本反应类型1、铁丝在点燃的条件下在氧气中剧烈燃烧2、氢氧化钡与硫酸钠反应3、氢气能使氧化铜发生还原反应生成铜4、硫酸氢铵受热易分解5、一氧化碳还原氧化铁\n四种基本反应类型与氧化还原反应的关系\n\n1、下列反应属于氧化还原反应的是()2、下列说法中错误的是:()化合反应不一定是氧化还原反应分解反应不一定是氧化还原反应置换反应一定是氧化还原反应复分解反应一定是氧化还原反应[练习]\n[练习]3、下列变化需要还原剂才能实现的是:()(A)CaCO3CO2(B)Fe2+Fe3+(C)H+H2(D)SO42-BaSO44、下列分子、原子或离子中,既具有氧化性又具有还原性的是:()(A)Al3+(B)Cl-(C)Fe(D)Cl25、氧化还原反应的实质是。\n在化学反应中,物质所含元素的化合价发生变化的反应就是氧化还原反应。例如:反应前后,Na、Cl的化合价发生了变化,该反应是氧化还原反应。(1)根据化合价是否变化分析,下列反应属于氧化还原反应的是(填序号):__________(A)2Mg+O2=2MgO(B)CaO+H2O=Ca(OH)2(C)2KClO3=2KCl+3O2↑(D)CaCO3=CaO+CO2↑(E)H2+CuO=Cu+H2O(F)HCl+NaOH=NaCl+H2O\n根据上面的分析和推理,对四种基本反应类型是否属于氧化还原反应,作出恰当概括:
置换反应:____________________________化合反应:_____________________________分解反应:_____________________________复分解反应:_____________________________\n四、化学用语\n写出由碳、氢、氧、钠中的某些元素组成的符合下列要求的物质的化学式:(1)常用作还原剂的气态化合物:_____________;(2)酸性氧化物______________;(3)碱性氧化物________________;(4)正盐___________;(5)酸式盐_______________。\n判断下列化学符号中数字“2”所表示的意义,将其序号填在相应的横线上:
①Ca2+②NO2③2NO④+2MgO(1)表示分子个数的是_____________;
(2)表示一个离子所带电荷数的是___________;
(3)表示元素化合价的是__________________;
(4)表示一个分子中所含原子个数的是______________。\n五、溶液\n下列有关溶液的说法中,正确的是( )A、不饱和溶液转化为饱和溶液,其溶质的质量分数一定增大B、饱和溶液中析出晶体后,溶质的质量分数一定减小C、只要温度不变,某饱和溶液中溶质的质量分数一定不变D、降温时,饱和溶液可能不析出晶体\n盛有浓硫酸和浓盐酸的两个试剂瓶,均敞口放置段时间后(不考虑水分蒸发),则两瓶溶液的( )A、质量都变小了B、体积都变小了C、质量分数都变大了D、质量分数变小了\n例1、下列变化中,属于化学变化的是()。A、由干冰得到二氧化碳气体B.烧瓶中盛有二氧化氮气体,加入活性炭后红棕色逐渐消失C、熟石膏与水混合得到石膏D.电解质溶液导电CD\n例2、下列物质中,有固定沸点的是()。A、碘酒B.花生油C、石蜡D.重水例3、下列各组物质的主要成分,皆为同一种酸所对应的盐是()。A、大理石、重晶石、光卤石B.小苏打、苏打、大苏打C.绿矾、胆矾、明矾D.铝土矿、硫铁矿、磁铁矿DC\n例4下列变化中,属于物理变化的是()。A.淡蓝色的臭氧变为无色的氧气B.苯酚在空气中变为粉红色C、碘升华D.用纯碱溶液去油污C例5将下列物质按酸、碱、盐分类,依次排列,正确的是()。A.硫酸、纯碱、石灰石D.氢硫酸、烧碱、绿矾C.石炭酸、熟石膏、醋酸钠D.磷酸、乙醇钠、苛性钾B\n—、选择题(只有一个选项符合题意)1、城市生活垃圾需实行分类投放,其中废纸、废塑料、废橡胶制品都属于()。A.无机物B.高分子化合物C盐类D.糖类B2、将下列各组物质按酸、碱、盐分类顺序排列,正确的是()。A、硫酸纯碱石膏B.氢硫酸烧碱氯化钠C.石炭酸乙醇醋酸钠D。磷酸熟石灰苛性钾B习题训练\n3、正电子、负质子等都属于反粒子,它们跟普通电子、质子的质量、电量均相等,而电性相反。科学家设想,在宇宙的某些部分可能存在完全由反粒子构成的物质——反物质。1997年底,欧洲和美国的科研机构宣布,他们已制造出7个反氢原子,这是人类探索反物质的一大进步。推测反氢原子的结构是()。A、由1个带正电荷的质子与1个带负电荷的电子构成B.由1个带负电荷的质子与1个带正电荷的电子构成C、由1个不带电的中子与1个带负电荷的电子构成D.由1个带负电荷的质子与1个带负电荷的电子构成B\n4、目前,科学界拟合成一种“二重构造”的球形分子,即把足球形的C60分子熔进Si60印的分子中,外面的硅原子与里面的碳原子以共价键结合。下列说法中,正确的是()A.它是由两种单质组成的混合物B.它是一种单质C、它是一种新型的化合物D、它的相对分子质量是2400g/molC\n5、随着人们生活节奏的加快,方便的袋装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,常在袋装食品内放人一小袋固体,在该小袋中应放人的化学物质是()。A、无水硫酸铜、蔗糖B.硅胶、硫酸亚铁C、食盐、硫酸亚铁D.生石灰、食盐B\n7、只含有一种元素的物质()。A、可能是纯净物也可能是混合物B.可能是单质也可能是化合物C.一定是纯净物D.一定是一种单质6、下列过程中,不涉及化学变化的是()。A、甘油加水做护肤剂B.用明矾净化水C.烹鱼加入少量的料酒和食醋可减少腥味,增加香味D.烧莱用过的铁锅,经放置常出现红棕色斑迹AA\n8、下列各组物质中:①C12O7、HClO3;②SO2、H2SO4;③NO、HNO2;④SiO2、H2SiO3;⑤Mn2O7、HMnO4;⑥CO2、H2C2O4;⑦NO2、HNO2;⑧A12O3、HAlO2,前者是后者的酸酐,正确的是()。A、①②③⑥B.②③⑤⑦C.④⑤D.①③④⑧[解析]HClO3的酸酐是C12O5,H2SO4的酸酐是SO3,HNO2的酸酐是N2O3,H2C2O3的酸酐是C2O3,A12O3为金属氧化物,是两性氧化物。C\n9、t0C时,Na2CO3溶解度为Ag,现有饱和Na2CO3溶液(100+A)g,溶质质量分数为a%。向该溶液中投入无水碳酸钠Ag,静置后析出碳酸钠晶体(Na2CO3·10H2O)Bg。加水使晶体全部溶解,所得溶液质量分数为a%,则加入水的质量为()。A.(100+A)gB.100gC、(100—180A/286)gD.(100-A·o%)gB\n二、填空题10、下列物质:①过氧化氢②次氯酸③石英④氯仿⑤金刚石⑥苯甲酸钠⑦硫黄⑧氯化铝⑨氩气⑩胆矾⑾氧气⑿单质碘由分子构成的物质是;由原子构成的物质是;由离子构成的物质是。①②④⑦⑧⑨⑾⑿③⑤⑥⑩\n11、下列物质中属于纯净化合物的是。①福尔马林②水③纤维素④石蜡⑤石墨⑥干冰⑦硫铁矿⑧醋酸酐②⑥⑧[解析]福尔马林是甲醛的水溶液;纤维素为高分子化合物,肯定为混合物;石蜡、硫铁矿含有丰富的杂质;石墨是单质;以上都不属于纯净的化合物。\n12、下列变化:①氧气在放电条件下变为臭氧;②氯化钠在灼烧时发出黄色火焰;③漂白的草帽日久变黄;④氢氧化铁胶体加入硫酸镁溶液后产生沉淀;⑤热碱溶液洗涤油污;⑥鸡蛋白溶液加入硫酸铜溶液析出沉淀;⑦白纸沾上浓硫酸后变黑;⑧浓氨水挥发出氨气;⑨木材干馏;⑩苏打晶体在空气中变成白色粉末;⑾胆矾受热变为白色粉末;⑿五氧化二磷干燥二氧化硫气体⒀浓硝酸发烟;⒁生产水泥;⒂铁矿石炼铁;⒃石蜡裂化;⒄油脂的氢化;⒅蛋白质的盐析。属于物理变化的是。②④⒀⒅[解析]②是焰色反应,属于物理变化;④是胶体的聚沉,只是分散质粒子的直径变大了,不发生分子的改变;⒀是由于浓硝酸的挥发性,形成硝酸小液滴;⒅蛋白质的盐析是物理变化。\n13、已知A、B两元素的单质气体,在同温同压下能以2:1的体积比完全化合成C气体,且反应后的气体比反应前的气体体积减小1/3。试证明B元素的单质一定不是单原子分子。[解析]设A、B两元素的单质化学式分别为Ax、By生成物C的体积为:(2+1)x(1—1/3)=2体积。根据阿伏加德罗定律可知:2Ax+By=2C。由等号两边质量守恒可知,C的化学式为AxBy/2,因为分子中原子的个数为正整数,所以:y/2≥1y≥2,因此,B元素的单质一定不是单原子分子。