- 694.00 KB
- 2022-08-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
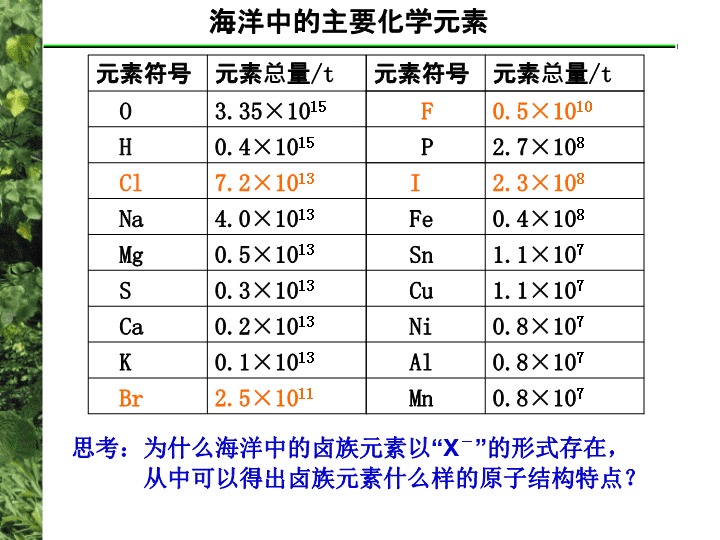
高中化学总复习___玉环楚门中学柯友良卤族元素\n海洋中的主要化学元素2.5×1011Br0.1×1013K0.2×1013Ca0.3×1013S0.5×1013Mg4.0×1013Na7.2×1013Cl0.4×1015H3.35×1015O元素总量/t元素符号元素总量/t元素符号0.8×107Mn0.8×107Al0.8×107Ni1.1×107Cu1.1×107Sn0.4×108Fe2.3×108I2.7×108P0.5×1010F思考:为什么海洋中的卤族元素以“X-”的形式存在,从中可以得出卤族元素什么样的原子结构特点?\nFClBrI最外层电子上都只有7个电子原子半径逐渐增大原子结构原子结构相似性递变性化学性质单质具有氧化性X2+H2O=HX+HXO易溶于有机溶剂化学性质单质物理性质元素的非金属性逐渐减弱单质颜色逐渐减弱变深熔沸点逐渐增大单质物理性质密度逐渐增大X2+2OH-=X-+XO-+H2O化学史递变性特殊性碘遇淀粉变篮色巩固反馈F元素氯化碘海水提碘\n问题1:下层显蓝色证明浸取液有什么微粒,写出离子方程式法国化学家巴拉尔将海中黑角菜燃烧成灰浸泡得浸取液,往浸取液中加入氯水和淀粉,溶液分为两层:下层显蓝色;上层显棕黄色。巴拉尔用乙醚将棕黄色的物质提出,加苛性钾棕黄色褪掉,加热蒸发结晶物得氯化钾相似固体。将结晶物与硫酸、二氧化锰共热,则产生红棕色有恶臭的气体,冷凝为棕红色液体。巴拉尔判断这是与氯和碘相似的一种新元素命名为muride,后命名为溴。溴的发现史问题2:你认为什么实验事实使巴拉尔判断上层显棕黄色溶液是一种与氯、碘相似的新元素(已知:H2SO4+2NaCl==Na2SO4+2HCl)△\n1、乙醚将棕黄色的物质提出-----易溶于有机溶剂问题2:你认为什么实验事实使巴拉尔判断上层显棕黄色溶液是一种与氯、碘相似的新元素2、与KOH反应3、与硫酸、二氧化锰共热,则产生红棕色的有恶臭的气体,冷凝为棕红色液体---与氯气、碘相似Br2+2KOH→KBr+KBrO+H2O4HBr+MnO2=MnBr2+Br2↑+H2O△△2KBr+2H2SO4=K2SO4+2HBr↑相似性(已知:H2SO4+2NaCl==Na2SO4+2HCl)△\n法国化学家巴拉尔将海中黑角菜燃烧成灰浸泡得浸取液,往浸取液中加入氯水和淀粉,溶液分为两层:下层显蓝色;上层显棕黄色。巴拉尔用乙醚将棕黄色的物质提出,加苛性钾棕黄色褪掉,加热蒸发结晶物得氯化钾相似固体。将结晶物与硫酸、二氧化锰共热,则产生红棕色有恶臭的气体,冷凝为棕红色液体。巴拉尔判断这是与氯和碘相似的一种新元素命名为muride,后命名为溴。溴的发现史问题3:巴拉尔的实验变化中有没有体现卤族元素单质性质的递变性与特殊性?\nCl2+2Br-==2Cl-+Br2Cl2+2I-==2Cl-+I2氧化性:Cl2﹥Br2Cl2﹥I2讨论1:你认为化学家们可以研究哪些实验事实来证明溴与碘的非金属性的相对强弱。递变性问题3:巴拉尔的实验变化中有没有体现卤族元素单质性质的递变性与特殊性?特殊性碘遇淀粉变篮色结论:非金属性逐渐减弱结论:Cl非金属性比Br强,Cl非金属性比I强溴与碘\n溴的发现史德国著名化学家李比希为分析一瓶浸泡过海藻植物灰的溶液成分,在分离出盐类后,加入氯水和淀粉试剂,母液中出现蓝色。第二天一早,他发现蓝色溶液上层还有少量棕色溶液,他不假思索地断定这是氯与碘生成的化合物氯化碘。当他知道巴拉尔制得溴非常懊悔。氯化碘是与溴相似的一种物质,称为拟卤素,写出氯化碘分子式与电子式讨论1:推测氯化碘可能的化学性质1、强氧化性2、与H2O反应3、与碱反应思考:等物质的量的氯化碘与溴氧化SO2的量是否相等\n碘是国防、工业、农业、医药等部门和行业所依赖的重要原料,海水提碘是从海水中将元素碘提取。海洋水体蕴藏的碘极其丰富,总数估计达800亿吨,世界上有许多国家从事海水提碘。海水提碘问题4:从巴拉尔发现溴的实验中能否得到工业上从海水中得到碘基本化学原理。方案1:电解法方案1:氧化法含I-的水溶液含碘的水溶液氧化剂海水中碘的富集盐卤的综合应用\n讨论:食盐中加入的碘的可能成分是什么?如何设计实验方案来验证?猜测碘晶体(I2)碘化物(KI)碘的含氧酸盐(KIOn)结论食盐中加入的碘的成分是KIO3碘的含量测定\n1.检验是否含I2的实验方案:方案1:溶于水所得溶液是否有黄色?方案2:溶于水所得溶液中加入CCl4振荡,CCl4层是否呈紫红色?方案3:溶于水所得溶液中滴加淀粉试液是否出现蓝色。评价:方案1I2含量很少可能观察不到黄色。方案3简单又灵敏。结论:不含I2\n2.检验是否含碘化物的实验方案:方案1:溶于水所得溶液中滴加AgNO3溶液,是否产生黄色沉淀方案2:溶于水所得溶液滴加氯水和CCl4,CCl4层是否呈紫红色评价:方案1生成的AgCl沉淀会对AgI沉淀中观察发生干扰。方案3现象明显、灵敏。结论:不含碘化物方案3:溶于水所得溶液中滴加氯水及淀粉试液是否出现蓝色。\n3.检验是否含有碘的含氧酸盐的实验方案:方案:溶于水在所得溶液中加入KI溶液和几滴淀粉溶液,然后滴加稀硫酸,观察溶液是否变蓝结论:含有碘酸盐结合其它事实方程式:IO3-+5I-+6H+=3I2+3H2O\n国家规定每千克食盐中含有该含KIO3为40—50mg为合格。为检验某碘盐是否合格,某同学称取食盐0.215kg,溶解、酸化、加淀粉及足量的另一种含碘物质,充分反应后溶液呈蓝色,再加0.015mol·L—1的硫代硫酸钠溶液滴定,用去18.00mL时,蓝色刚好褪去。有关反应如下:IO3-+5I-+6H+===3I2+3H2OI2+2S2O32-===2I-+S4O62-通过计算判断碘盐是否合格?碘的含量测定KIO3→6Na2S2O3含KIO3:0.015mol/L×18.00mL×l0-3L/mL×1/6×214g/mol×1000mg/0.215kg==45mg/kg该食盐合格\nFClBrI最外层电子上都只有7个电子原子半径逐渐增大原子结构原子结构相似性递变性化学性质单质具有氧化性X2+H2O=HX+HXO易溶于有机溶剂化学性质单质物理性质元素的非金属性逐渐减弱单质颜色逐渐减弱变深熔沸点逐渐增大单质物理性质密度逐渐增大X2+2OH-=X-+XO-+H2O特殊性碘遇淀粉变篮色F元素\n1、下列关于卤素的叙述正确的是:()A、其单质都能与水反应,通式为X2+H2O=HX+HXOB、HX易溶于水,其水溶液都是强酸C、SO2通到BaCl2水溶液无现象,加溴水产生沉淀D、都能形成通式为HXO4最高价含氧酸,且酸性减弱巩固反馈:卤素单质的氧化性F元素的特殊性卤素氢化物的递变水溶液酸性稳定性最高价含氧酸酸性递变\n2.通过分析周期中各族元素性质的变化趋势,下列关于砹及其化合物的叙述中正确的是()A.砹常温下是一种颜色较深的有色固体,在水中溶解度不大,也难溶于有机溶剂B.AgAt是一种可溶于水的砹化物,具有感光性。C.相同条件下,HAt比HI更稳定D.将浓硫酸滴加固体KAt上,能产生单质At2巩固反馈:卤族单质物理性质的递变性卤族性质的相似性卤离子的还原性还原性增强Fe3+与I-能反应而与Br-不反应\n讨论1:你认为化学家们可以研究哪些实验事实来证明溴与碘的非金属性的相对强弱。1、单质的氧化性强弱2、HBr与HI的稳定性3、HBrO4与HIO4酸性强弱4、Br-与I-的还原性强弱溴与碘\n巩固反思:3、痕迹是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中的一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心地涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。用下列化学式表示这3种物质都正确的是()A、①AgNO3②NaBr③AgBrB、①AgNO3②NaCl③AgClC、①AgCl②AgNO3③NaClD、①AgNO3②NaI③AgI