- 1011.00 KB
- 2022-08-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
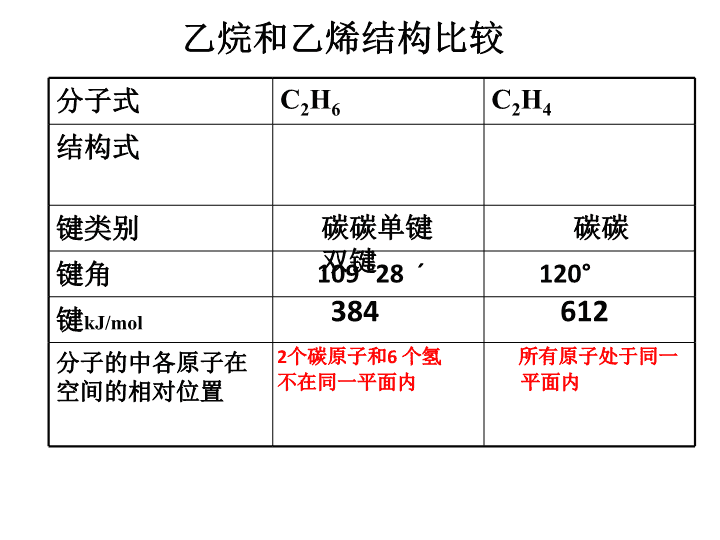
第二节来自石油和煤的两种基本化工原料乙烯是石油化工的基本有机原料,目前约有75%的石油化工产品由乙烯生产,它主要用来生产聚乙烯、聚氯乙烯、环氧乙烷/乙二醇、二氯乙烷、苯乙烯、聚苯乙烯、乙醇、醋酸乙烯等多种重要的有机化工产品,乙烯产量已成为衡量一个国家石油化工工业发展水平的标志。因此,乙烯行业也对中国经济发展产生巨大的影响。\n苯在工业上用途很广,接触的行业主要有染料工业,用于农药生产及香料制作的原料等,苯又作为溶剂和粘合剂用于造漆、喷漆、制药、制鞋及苯加工业、家具制造业等。\n乙烷和乙烯结构比较分子式C2H6C2H4结构式键类别键角键kJ/mol分子的中各原子在空间的相对位置碳碳单键碳碳双键109°28´120°3846122个碳原子和6个氢所有原子处于同一不在同一平面内平面内\n一、乙烯6个原子共平面键角120°思考:①、碳碳双键的键能小于碳碳单键键能的2倍,这说明了什么问题?碳碳双键中的2个键不同1.乙烯的组成和结构\n2、物理性质:无色、稍有气味的气体;难溶于水;密度略小于空气(标况1.25g/L)\n石蜡油的分解实验石蜡油:17个C以上的烷烃混合物①②碎瓷片:催化剂③加热位置:碎瓷片④将生成气体通入酸性高锰酸钾溶液中。⑤生成的气体通入溴的四氯化碳溶液⑥点燃气体\n3、化学性质:⑴氧化反应:现象:火焰明亮、伴有黑烟规律:含碳量越高,黑烟越大。C2H4+3O22CO2+2H2O点燃①可燃性(点燃前验纯)\n②乙烯与酸性KMnO4溶液现象:紫红色褪去结论:乙烯能使酸性高锰酸钾溶液褪色——鉴别乙烯和甲烷CH2=CH2+KMnO4+H2SO4CO2+MnSO4+K2SO4+H2O练习:配平下列方程式:思考:甲烷中混有乙烯,应如何除去?\n将乙烯通入溴的CCl4溶液中现象:橙色褪去H—C=C—H+Br—BrH—C—C—HHHBrBrHH1,2-二溴乙烷⑵加成反应:碳碳双键中有一个键易断\n加成反应:不饱和键断开,其他原子或原子团连在原不饱和碳原子上。CH2=CH2+H2CH3CH3催化剂乙烯水化法制乙醇CH3—CH2Cl(氯乙烷)CH2=CH2+H—Cl催化剂△CH2=CH2+H—OHCH3CH2—OH(乙醇)催化剂△要获得CH3CH2Cl有两种方法,方法一:CH3CH3和Cl2取代,方法二:CH2=CH2和HCl加成,哪种方法好?\n(3)聚合反应nCH2=CH2[CH2—CH2]n催化剂(聚乙烯)小分子有机物变大分子有机物——聚合反应以加成的方式聚合为加成聚合反应,简称加聚反应链节聚合度单体说明:1、聚乙烯无固定熔沸点。2、聚乙烯、聚氯乙烯等白色塑料废弃物,微生物不能降解,是白色污染物。现在用可降解塑料聚乳酸来代替,它可以被乳酸菌分解为无毒物质。\n⑴石油化学工业最重要的基础原料⑵植物生长调节剂乙烯常用作果实催熟剂4、乙烯的用途\n名称结构简式沸点相对密度乙烯CH2=CH2-103.70.566丙烯CH2=CHCH3-47.40.51931-丁烯CH2=CHCH2CH3-6.30.59511-戊烯CH2=CH(CH2)2CH3300.64051-己烯CH2=CH(CH2)3CH363.30.67311-庚烯CH2=CH(CH2)4CH393.60.6970部分烯烃的沸点和相对密度\n苯的发现19世纪初,欧洲许多国家都已普遍使用了煤气照明,它带动了煤炭工业的迅速发展。而从生产煤气的原料中制备出煤气后,剩下一种油状液体却长期无人问津。油状物的大量废弃,造成了严重的环境污染。英国科学家法拉第是第一位对这种油状液体感兴趣的科学家,他想要将它们变废为宝,就必须对油状物进行分离提纯。煤焦油焦臭黑粘,化学家忍受着烧烤熏蒸,在炉前塔旁辛勤工作。法拉第花了整整五年的时间,终于利用蒸馏的方法将油状液体成功分离,于1825年6月16日向伦敦皇家学会报告,发现一种新的碳氢化合物,当时,法拉第将这种无色液体称之为“氢的重碳化合物”。1834年,德国化学家米希尔里希通过蒸馏苯甲酸和碱石灰的混合物,得到了与法拉第所制液体相同的一种液体,并命名为\n一、苯的物理性质:无色、有特殊气味、比水轻、难溶于水、易挥发(沸点:80.1℃熔点:5.5℃)有毒的透明液体,良好的有机溶剂。【思考】苯分子的结构是怎样的呢?石狮地区小作坊制鞋业很多,占半数以上的女职工都患有不同程度的四肢麻木,肌肉萎缩,头晕、浑身乏力,牙龈、鼻孔经常出血,个别严重的已瘫痪在床。造成这种现状的主要原因是:使用苯胶造成的苯中毒。\n凯库勒(1829—1896)是德国化学家,经典有机化学结构理论的奠基人之一。1847年考入吉森大学建筑系,由于听了一代宗师李比希的化学讲座,被李比希的魅力所征服,结果成为化学家,他擅长从建筑学的观点研究化学问题,被人称为“化学建筑师”。“化学建筑师”凯库勒的主要贡献:1.用现代语言把有机化学定义为研究碳化合物的化学。2.提出有机化合物中碳的四价理论。3.提出有机物的碳链学说。4.提出苯分子环状结构理论。\n●苯分子具有平面的正六边形结构。●各个键角都是120°●碳碳之间键长都是1.40×10-10米。它不同于一般的单键(C—C键键长是1.54×10-10m也不同于一般的双键(C=C键键长是1.33×10-10m)。从苯跟高锰酸钾溶液和溴水都不起反应的事实和测定的碳碳间键长的实验数据来看,充分说明苯环上碳碳间的键应是一种介于单键和双键之间的独特的键。\n简写为凯库勒式【思考】苯分子是否为单双键交替结构?\nC-C1.54×10-10mC=C1.33×10-10m\n二、苯的分子组成和结构C6H6六个碳原子和六个氢原子在同一平面上,形成正六边形键角:120°分子内不是单双键相间,存在着大π键\n苯的结构:【思考】请你推测苯应该具有什么样的化学性质?\n三、苯的化学性质1、稳定性:苯不与酸性KMnO4溶液和溴水反应2、取代反应(1)卤代反应:(苯与溴的反应)苯环上的H原子被卤素原子所代替的反应+Br2FeBr3+HBrBrBr+Br2FeBr3+HBrC6H6+Br2FeBr3C6H5Br+HBr\n(1).苯与溴的取代反应[实验1]苯和液溴在铁粉作用下反应[现象]锥形瓶中有淡黄色沉淀导管口有白雾溶液沸腾烧瓶内有褐色不溶于水的油状液体产生如何证明苯和溴的反应是取代而不是加成?\n制溴苯实验的有关问题1.加入药品的顺序:苯、液溴、铁粉2.左烧瓶上方长导管的作用:冷凝、回流苯和溴、导气3.导管末端贴近液面:防止倒吸5.溴苯的颜色和状态如何?怎样除去溴苯中的溴?溴苯是无色液体,实验得到的溴苯呈红褐色是因为溶解了溴的缘故。用稀碱液除去溴苯中的溴,然后分液。6.根据什么现象证明发生的是取代反应而不是加成反应?(1)产物有两种。(除生成溴苯还有气体产生)(2)有HBr生成(遇硝酸银溶液产生淡黄沉淀)4.烧瓶的胶塞最好用锡萡包起来:防止胶塞被溴、苯腐蚀。\n溴苯溴苯为无色液体,比水重A.苯与液溴发生取代反应,和溴水发生萃取B.长导管起冷凝、回流、导气的作用C.挥发出的HBr气体用水吸收,导气管在液面之上D.溴苯是无色液体,被溴染成褐色。加NaOH溶液,通过分液法除溴E.以铁做催化剂,苯也能与其他卤素发生取代-卤代\n(2)苯的硝化反应:被-NO2取代有黄色油状物产生注意:A.药品顺序B.水浴加热C.浓硫酸作用D.长导管的作用温度计的位置E.硝基苯溶有NO2而显黄色,用水除杂硝基苯是有苦杏仁味、无色、比水重、有毒的油状液体。\n②水浴:a.温度要控制在100℃以下b.受热均匀注意:①浓硝酸和浓硫酸的混合酸要冷却到50-60℃以下,再慢慢滴入苯,边加边振荡,因为反应放热,温度过高,苯易挥发,且硝酸也会分解,同时苯和浓硫酸在70-80℃时会发生反应。③温度计的位置,必须放在悬挂在水浴中。④长导管的作用:冷凝回流。⑤不纯的硝基苯显黄色,因为溶有NO2,而纯净硝基苯是无色,有苦杏仁味,比水重油状液体。\n3、苯的加成反应:与氢气的加成反应:跟氯气的加成反应\n4、可燃性[实验]在小坩锅内倒入少量苯点燃[现象]明亮火焰,大量黑烟[原因]苯分子中含碳量较大[方程式]2C6H6+15O212CO2+6H2O点燃\n小结:苯中的化学键是一种介于单键和双键之间独特的键,大π键饱和性不饱和性不能使KMnO4酸性溶液和溴水褪色能与纯溴、浓硝酸、浓硫酸等发生取代反应—能与氢气、氯气发生加成反应推广:含有苯环的物质均应具有此种性质用途:合成橡胶;制造农药、医药、染料、香料的原材料、是一种常用的有机溶剂