- 1.68 MB
- 2022-08-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
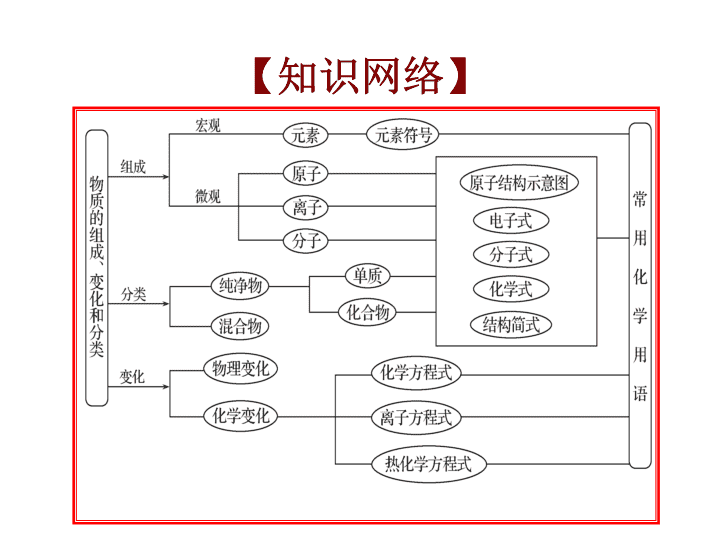
高中化学专题讲座课件物质的组成、分类和性质河南省太康县第一高级中学----乔纯杰\n1.理解混合物和纯净物、单质和化合物、金属和非金属的概念。2.理解酸、碱、盐、氧化物的概念及其相互联系。3.理解物理变化与化学变化的区别与联系。4.正确书写常见元素的名称、符号、离子符号,熟悉常见元素的化合价,能根据化合价正确书写化学式,或根据化学式正确判断化合价。5.了解原子结构示意图、分子式、结构式和结构简式的表示方法。6.了解常见的分散系--胶体。【基本要求】\n【知识网络】\n一、物质的分类\n溶液、浊液、胶体、空气、土壤、石油、煤、天然气、钢铁、所有高分子化合物外及下面一些常见的混合物:水泥:3CaO·SiO2、2CaO·SiO2、3CaO·Al2O3,玻璃:Na2SiO3、CaSiO3、SiO2,漂白粉:Ca(ClO)2、CaCl2,碱石灰:CaO、NaOH,焦炉气:CH4、CO、C2H2、H2,高炉气:CO、N2、CO2,水煤气:CO、H2,裂解气:乙烯、丙烯、丁二烯,福尔马林:35~40%HCHO水溶液,天然油脂:高级脂肪酸甘油酯等。(一)混合物\n分散系溶液浊液胶体分散质直径小于1nm大于100nm1nm~100nm分散质粒子单个小分子或离子巨大数目分子的集合体许多分子的集合体或高分子实例氯化钠溶液石灰乳、油水烟、云、雾,豆奶、牛奶、蛋清水溶液性质外观均一、透明不均一透明均一、透明稳定性稳定不稳定稳定透过滤纸能不能能透过半透膜能不能不能鉴别无丁达尔现象无丁达尔现象有丁达尔现象1、几种分散系及比较:\n2、胶体内容主要应用性质丁达尔效应一束光通过胶体时产生一条“光路”鉴别胶体和溶液布朗运动胶粒在胶体中做不停的、无秩序的运动——电泳胶粒在外加电场作用下做定向移动[胶粒带电:金属氢氧化物、金属氧化物胶粒带正电;非金属氧化物、金属硫化物、硅酸胶粒带负电;高分子胶粒一般不带电]工厂高压电除尘聚沉胶体微粒在外界条件的作用下,形成沉淀从分散剂里析出的过程必要时需破坏胶体\n内容主要应用分类按分散剂的状态分类分散剂是液体——液溶胶。如Al(OH)3胶体,蛋白质胶体分散剂是气体——气溶胶。如雾、云、烟分散剂是固体——固溶胶。如烟水晶、有色玻璃按分散质的粒子分类粒子胶体——胶粒是许多“分子”的集合体。如Fe(OH)3胶体分子胶体——胶粒是高分子。如淀粉溶胶,蛋白质胶体等制备方法水解法FeCl3+3H2O=Fe(OH)3(胶体)+3HCl——复分解法Ag++I-=AgI(胶体)SiO32-+2H+=H2SiO3(胶体)——\n1.下列关于胶体制备及胶体性质的叙述正确的是()A.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同B.用激光笔检验淀粉溶液的丁达尔效应C.向煮沸的0.1mol·L-1NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体D.制备Fe(OH)3胶体,通常是将Fe(OH)3固体溶于热水【练习1】【答案】B\n【答案】B2.下列与含氯化合物有关的说法正确的是()A.H2CO3是弱酸,所以Na2CO3是弱电解质B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物D.电解NaCl溶液得到22.4LH2(标准状况),理论上需要转移NA个电子(NA表示阿伏加德罗常数)\n(二)纯净物【说明】酸性氧化物不一定为非金属氧化物,如Mn2O7;非金属氧化物不一定为酸性氧化物,如CO;碱性氧化物一定为金属氧化物;金属氧化物不一定为碱性氧化物,如Al2O3为两性氧化物,Mn2O7为酸性氧化物;酸性氧化物一定为酸酐;酸酐不一定为酸性氧化物,如乙酸酐[(CH3CO)2O]不属于氧化物。1.\n2.\n3.碱4.盐\n1.下列与化学概念有关的说法正确的是()A.化合反应均为氧化还原反应B.金属氧化物均为碱性氧化物C.催化剂能改变可逆反应达到平衡的时间D.石油是混合物,其分馏产品汽油为纯净物【答案】C【练习2】\n2.下列分类方法正确的是()①根据元素原子最外层电子数多少将元素分为金属和非金属②根据电解质在水溶液中能否完全电离将电解质分为强电解质和弱电解质③依据组成元素的种类,将纯净物分为单质和化合物 ④根据酸分子中含有的氢原子个数,将酸分为一元酸、二元酸等⑤根据氧化物中是否含有金属元素,将氧化物分为碱性氧化物、酸性氧化物⑥根据分散系稳定性大小,将分散系分为胶体、浊液和溶液A.②③B.③④⑥C.只有①③D.全部正确【答案】A\n二、化学反应的分类\n物理变化化学变化三色焰色反应①颜色反应②显色反应五解潮解①分解②裂解③水解④电解十八化①熔化②汽化③液化④酸化①氢化②氧化③水化④风化⑤钝化⑥皂化⑦炭化⑧催化⑨硫化⑩酯化⑪硝化⑫裂化⑬卤化⑭(油脂)硬化【物理变化与化学变化的比较】\n【说明】:(1)化学变化中常伴有发光、放热现象,但有发光、放热现象的变化不一定属于化学变化,如电灯泡发光、放热。(2)化学变化中一定存在化学键的断裂和形成,但存在化学键断裂的变化不一定是化学变化,如熔融NaCl的电离等。(3)原子的裂变、聚变虽有新物质生成,但它不属于中学化学意义上的化学变化。\n【答案】B1.下列有关化学研究的正确说法是()A.同时改变两个变量来研究反应速率的变化,能更快得出有关规律B.对于同一个化学反应,无论是一步完成还是分几步完成,其反应的焓变相同C.依据丁达尔现象可将分散系分为溶液、胶体与浊液D.从HF、HCI、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增的规律【练习3】\n2.下列叙述正确的是()A.CO和CaO分别属于酸性氧化物和碱性氧化物B.蒸馏和蒸发分别可以从海水中得到淡水和粗盐C.自然固氮和人工固氮分别是物理变化和化学变化D.石油的裂化和煤的干馏得到的产物分别是纯净物和混合物【答案】B\n1.元素符号、电子式、原子(或离子)结构示意图三、化学用语\n\n2.化学式、分子式、实验式、结构式、结构简式概念举例化学式用元素符号表示单质或化合物组成的式子水:H2O;氯化钠:NaCl;铁:Fe;二氧化硅:SiO2分子式用元素符号表示物质分子组成的式子只有由分子组成的物质的化学式才称为分子式,如乙酸:C2H4O2实验式(最简式)表示物质组成元素最简单的原子整数比的式子乙炔的实验式为CH;乙酸的实验式为CH2O\n\n【练习4】【答案】B\n【答案】C\n1.简单阳离子最外层电子已全部失去,所以其电子式就是其离子符号;阴离子和复杂阳离子(如NH4+)要加“[]”括起来,并在右上角注明该离子所带的电荷数,如:【说明】\nMgCl2形成过程的电子式为:Na2O形成过程的电子式为:\n\n1.下列有关化学用语的表示正确的是()A.N2的电子式:N⋮⋮NB.S2-的结构示意图:【练习5】【答案】C\n2.下列各项表达中正确的是()A.Na2O2的电子式为B.106g的乙醇和丙醇混合液完全燃烧生成的CO2为112L(标准状况)C.在氮原子中,质子数为7而中子数一定为7D.Cl-的结构示意图为【答案】A\n【答案】B\n设计说明为高三学生复习提供学习思路和方法,紧密联系高考,讲练结合,总结规律,提升能力。本课件讲练相结合,使物质分类及反应分类知识更加系统。在使用过程中,可以根据学生的水平更换练习内容。