- 824.00 KB
- 2022-08-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
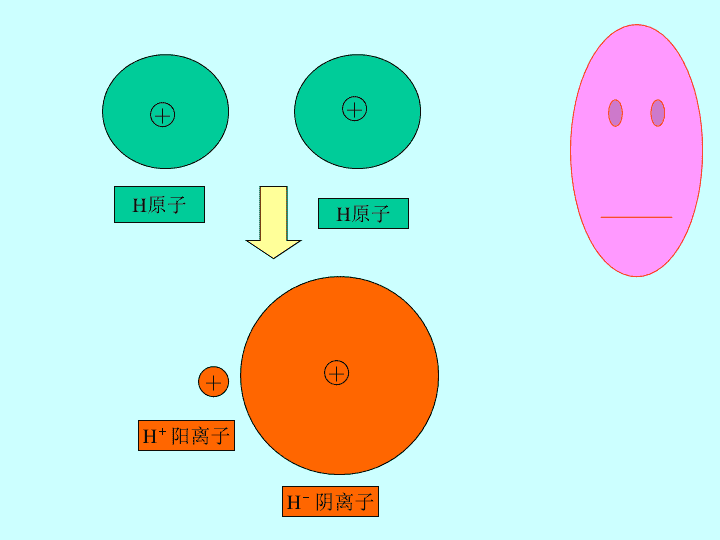
共价键\n1、什么是化学键?离子键是怎样形成的?原子得失电子形成阴阳离子静电作用而形成2、离子键的强弱决定因素有哪些?(静电作用强弱)离子半径电荷数\n++H原子H原子++H+阳离子H-阴离子\n一、共价键1、概念2、形成条件3、类型4、存在二、共价键的参数1、键长2、键能3、键角\n一、共价键氢气分子的形成共价键的实质原子间通过共用电子对所形成的化学键1、概念:\n非极性健H-HCl-ClN三N极性键H-ClH-OH-S3、类型:一般是非金属原子之间H2N2HClH2OHF等均以共价键形成分子2、形成条件:H-HN三NH-ClH-O-HH-F电子式书写\n4、存在:不仅存在于非金属单质和共价化合物中,也存在于有些离子化合物中H2HClNaOHNH4ClNa2O2二、共价键的参数1、键长数量级(10-10m)H-H键长:2、键能:(KJ·mol-1)3、键角:思考常见键角形成或拆开1mol共价键时放出或吸收的热量进入判断\n返回\n返回下一张\n有关键长数据H-H0.74×10-10mC-C1.54×10-10mCl-Cl1.98×10-10m:思考:如何定性判断键的长短?返回可用成键原子半径的大小定性判断键的长短\n180o109o28`60o120o返回\n思考:键能与键长的关系键越长键能越小键越短键能越大键能与分子稳定性的关系例2结构相似的分子,其中含有键能大的共价键的分子,其越稳定键能与物质熔点高低的关系例3需要破坏共价键才能使其熔解的物质,其键能越大熔点越高键能与反应热效应的关系例4返回\n例1有关键长数据:相应键能数据H-H436KJ·mol-1C-C346KJ·mol-1Cl-Cl247KJ·mol-1:返回H-H0.74×10-10mC-C1.54×10-10mCl-Cl1.98×10-10m\n例2根据键的参数分析卤素气态氢化物HF、HCl、HBr、HI的稳定性。返回稳定性HF>HCl>HBr>HI\n例3根据键的参数分析金刚石和晶体硅的熔点高低(金刚石和晶体硅熔化时均需要破坏共价键)。返回熔点金刚石>晶体硅\n例4根据键能数据判断H2+Cl2=2HCl反应是吸热还是放热?(H-H436KJ·mol-1Cl-Cl247KJ·mol-1H-Cl431KJ·mol-1)演示反应热=2mol×431KJ·mol-1-1mol×436KJ·mol-1-1mol×247KJ·mol-1=179KJ\n返回\n含有共价键的化合物一定是共价化合物全部由非金属元素组成的化合物一定是共价化合物在气态单质分子里一定有非极性共价键共价键的键能越大则键长越短错,如NH4Cl等铵盐错,如:NaOHNa2O2错,He、Ne等稀有气体对,键长与键能成反比判断:返回存在\n书写电子式,并在指出其中的化学键的类型:(极性共价键)CS2Na2O2HClONaClO四核10电子的分子三核18电子的分子(离子键非极性共价键)(极性共价键)(离子键极性共价键)NH3(极性共价键)H2S(极性共价键)返回存在\n2、课本p1533、p15441、1、返回\n复习挑战题:下列分子中所有原子都满足最外层8电子结构的是(A)SF6(B)XeF2(C)BF3(D)PCl3(E)PCl5预习导入题:下列物质熔化时需要破坏共价键的是:(A)金刚石(B)食盐(C)干冰DA