- 2.45 MB
- 2022-08-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
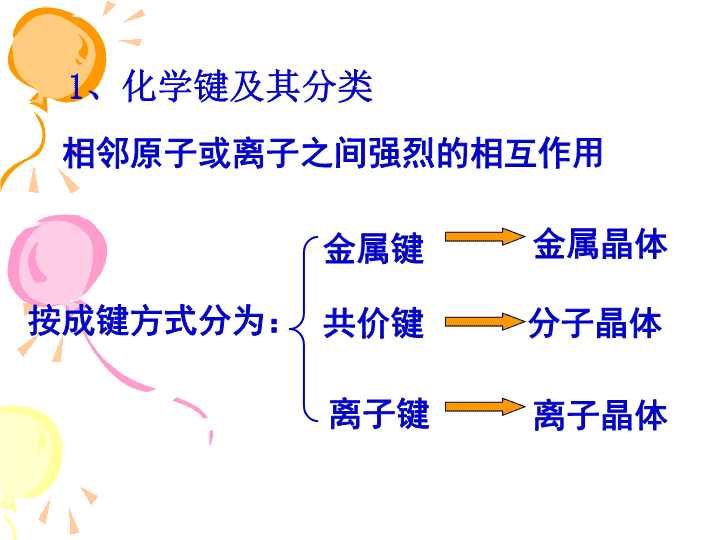
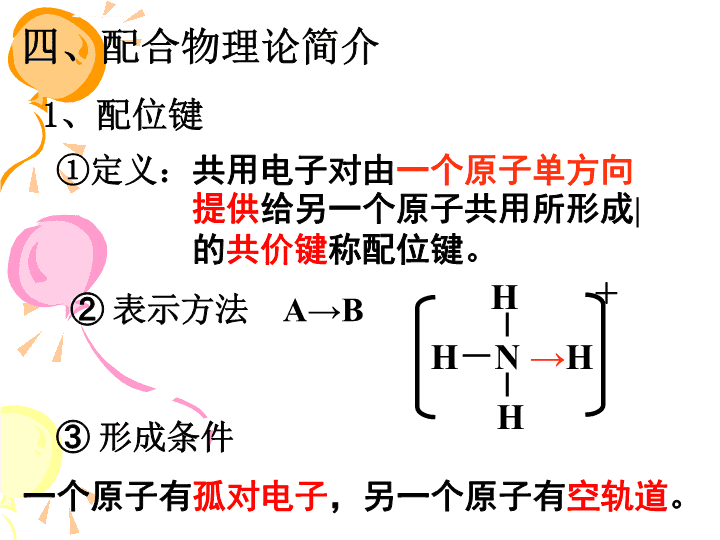
化学选修三原子结构与性质分子结构与性质晶体结构与性质原子结构原子结构与元素的性质共价键分子的立体结构分子的性质晶体的常识分子晶体与原子晶体金属晶体离子晶体\n1、化学键及其分类相邻原子或离子之间强烈的相互作用按成键方式分为:金属键共价键离子键金属晶体分子晶体离子晶体\n四、配合物理论简介1、配位键①定义:共用电子对由一个原子单方向提供给另一个原子共用所形成|的共价键称配位键。②表示方法③形成条件A→BH-N→HHH+一个原子有孤对电子,另一个原子有空轨道。\n2、配位化合物①配合物的形成天蓝色溶液蓝色沉淀深蓝色溶液Cu(OH)2H2OCuH2OH2OOH22+深蓝色晶体[Cu(NH3)4]SO4•H2O加乙醇
并静置NH3CuH3NH3NNH32+CuSO4溶液滴加氨水继续滴
加氨水\nCu(OH)2+4NH3=[Cu(NH3)4]2++2OH—蓝色沉淀深蓝色溶液Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+蓝色溶液蓝色沉淀\nH2OCuH2OH2OOH22+NH3CuH3NH3NNH32+1Cu与4O形成的结构为平面正方形1Cu与4N形成的结构为平面正方形\n第三章晶体的结构与性质第一节晶体的常识\n一、晶体与非晶体1、晶体与非晶体晶体——具有规则几何外形的固体非晶体——没有规则几何外形的固体
又称玻璃体晶体离子晶体原子晶体分子晶体金属晶体\n2、晶体与非晶体性质对比自范性微观结构各向异性熔沸点晶体非晶体有无原子在三维空间里呈周期性有序排列原子排列相对无序强度、导热性、光学性质等无有固定熔沸点无固定
熔沸点自范性晶体能自发地呈现多面体外形的性质自范性前提:晶体生长的速率适当本质差异各向异性不同方向上,性质有差异\n3、晶体形成的途径①熔融态物质凝固②气态物质冷却不经液态直接凝固(凝华)③溶质从溶液中析出\n3、晶体的鉴别①物理性质差异如:外形、硬度、熔点、折光率②最科学的方法是对固体进行X-射线衍射实验\n1、下列关于晶体与非晶体的说法正确的是A、晶体一定比非晶体的熔点高B、晶体有自范性但排列无序C、非晶体无自范性而且排列无序D、固体SiO2一定是晶体2、区别晶体与非晶体最可靠的科学方法是A、熔沸点B、硬度C、颜色D、x-射线衍射实验CD[课堂练习]\n二、晶胞1、晶胞:描述晶体结构的基本单元晶胞是无形的,是人为划定的\n2、晶胞特征一般是平行六面体晶体由晶胞“无隙并置”而成平行六面体无隙并置\n3、三种典型立方晶体结构\n4.晶胞中原子个数的计算晶胞顶角原子为8个晶胞共用,每个晶胞占1/8晶胞棱上原子为4个晶胞共用,每个晶胞占1/4晶胞面上原子为2个晶胞共用,每个晶胞占1/2晶胞内部的原子为1个晶胞独自占有,即为1\n1、现有甲、乙、丙、丁四种晶胞,可推知:甲晶体中A与B的离子个数比为;乙晶体的化学式为;丙晶体的化学式为______;丁晶体可能的化学式为______。1:1C2DEFXY3Z\n2、下图依次是金属钠(Na)、金属锌(Zn)、碘(12)、金刚石(C)晶胞的示意图,数一数,它们分别平均含有几个原子?NaZnI2金刚石\n3、钙-钛矿晶胞结构如图所示。观察钙-钛矿晶胞结构,求该晶体中,钙、钛、氧的微粒个数比为多少?\n(8×+6×)×3=124、下图是CO2分子晶体的晶胞结构示意图,其中有多少个原子?\n5、最近发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式是。Ti14C13\n第三章晶体的结构与性质第二节分子晶体与原子晶体\n一、分子晶体1、分子晶体概念:只含分子的晶体组成微粒:分子粒子间作用力:分子内原子间以共价键结合相邻分子间靠分子间作用力(范德华力、氢键)相互吸引化学式就是分子式\n2、常见的分子晶体①所有非金属氢化物②部分非金属单质③部分非金属氧化物④几乎所有的酸⑤绝大多数有机物的晶体\n3、结构特征分子间作用力范德华力氢键①若分子间只有范德华力时以1个分子为中心,周围有12个紧邻分子,即分子密堆积结构\nCO2干冰晶胞\n②若分子间主要为氢键时以1个分子为中心,周围有4个相邻分子,即分子非密堆积结构。如:HF、NH3、冰等氢键具有方向性\n4、物理性质熔沸点较低;易升华硬度很小固态和熔融状态时都不导电只有酸的水溶液中有的导电相似相溶原理\n1.下列性质适合于分子晶体的是()A.熔点1070℃,易溶于水,水溶液导电B.熔点10.31℃,液态不导电、水溶液能导电C.易溶于CS2、熔点112.8℃,沸点444.6℃D.熔点97.81℃,质软、导电、密度0.97g/cm3BC2.共价键、离子键和范德华力是构成物质粒子间的不同作用方式,下列物质中,只含有上述一种作用的是()A.干冰B.氯化钠C.氢氧化钠D.碘B练习:3.下列分子晶体:①H2O②HCl③HBr④HI⑤CO⑥N2⑦H2熔沸点由高到低的顺序是()A.①②③④⑤⑥⑦B.④③②①⑤⑥⑦C.①④③②⑤⑥⑦D.⑦⑥⑤④③②①C\n5.下列过程中,共价键被破坏的是()A.碘升华B.溴蒸气被木炭吸附C.酒精溶于水D.HCl气体溶于水4.当S03晶体熔化或气化时,下述各项中发生变化的是()A.分子内化学键B.分子间距离C.分子构型D.分子间作用力BDD6.下列有关共价化合物的说法:①具有较低的熔、沸点②不是电解质③固态时是分子晶体④都是由分子构成⑤液态时不导电,其中一定正确的是()A.①③④B.②⑤C.①②③④⑤D.⑤D\n7.已知氯化铝的熔点为190℃(2.202×lO5Pa),但它在180℃即开始升华。(1)氯化铝是____________。(填“离子化合物”“共价化合物”)(2)无水氯化铝在空气中强烈的“发烟”,其原因是__________________________________________________________________________________________。(3)设计一个可靠的实验,判断氧化铝是离子化合物还是共价化合物。你设计的实验是______________________________________________。(4)在500K和1.01×105Pa时,它的蒸气密度(换算为标准状况时)为11.92g·L-1,试确定氯化铝在蒸气状态时的化学式为____________。共价化合物Al2Cl6氯化铝与空气中的水蒸气发生水解反应产生HCl气体,HCl在空气中形成酸雾而“发烟”。在其熔融状态下,试验其是否导电;若不导电是共价化合物。\n1、下列物质属于分子晶体的化合物是()A、石英B、硫磺C、干冰D、食盐C练习2、干冰气化时,下列所述内容发生变化的是A、分子内共价键B、分子间作用力C、分子键距离D、分子间的氢键BC3、冰醋酸固体中不存在的作用力是()A、离子键B、极性键C、非极性键D、范德华力A\n4、水分子间存在着氢键的作用,使水分子彼此结合而成(H2O)n。在冰中每个水分子被4个水分子包围形成变形的正四面体,通过“氢键”相互连接成庞大的分子晶体,其结构如图:试分析:①1mol冰中有mol氢键?②H2O的熔沸点比H2S高还是低?为什么?2氢键\n二、原子晶体1、原子晶体概念:原子间以共价键相结合而形成空间网状结构的晶体,又称共价晶体组成微粒:原子粒子间作用力:共价键无分子式化学式表示原子最简整数比\n2、常见原子晶体①某些非金属单质:②某些非金属化合物:硼(B)、硅(Si)锗(Ge)、金刚石(C)等SiC、BN、SiO2、Al2O3等\n3、结构特征晶体中只存在共价键,无单个分子存在;晶体为空间网状结构。金刚石二氧化硅\n4、原子晶体的物理性质熔沸点高硬度大一般不导电难溶于溶剂\n在SiO2晶体中,每个Si原子和()个O原子形成()个共价键即每个Si原子周围结合()个O原子;同时,每个O原子和()个Si原子相结合。在SiO2晶体中,最小的环是()元环。()单个的SiO2分子存在。444212没有\n第三章晶体的结构与性质第三节金属晶体\n一、金属键1、金属键金属离子与自由电子之间强烈的相互作用①定义②本质电子气理论金属原子的价电子发生脱落,形成金属阳离子和自由电子自由电子被所有原子所共用从而把所有的金属原子维系在一起无饱和性无方向性\n2、金属晶体金属离子与自由电子通过金属键结合而成的晶体叫做金属晶体粒子间的作用力:金属键构成金属晶体的粒子:金属离子、自由电子常见金属晶体:金属、合金\n3、金属性质与电子气理论①金属导电性电子气的运动是没有一定方向的,但在外加电场的条件下,自由电子定向运动形成电流,所以金属容易导电\n②金属的导热性自由电子在运动时与金属离子碰撞,把能量从温度高的部分传到温度低的部分,从而使整块金属达到相同的温度。高温下热运动剧烈,因此电子的定向移动程度减弱,所以,随着温度的升高,金属的导电性减弱\n③金属的延展性金属离子和自由电子间相互作用没有方向性,在外力作用下各原子层就会发生相对滑动,但不会改变原来的排列方式,而且弥漫在金属原子间的电子气可以起到类似轴承中滚珠之间润滑剂的作用\n金属键的强弱与离子半径、离子电荷有关④金属的熔点、硬度金属的熔点、硬度与金属键的强弱有关离子半径越小或离子所带电荷越多,则金属键越强,金属的熔沸点越高、硬度越大。\n二、金属晶体的原子堆积模型1、几个概念配位数:在晶体中与每个微粒紧密相邻且距离相等的微粒个数空间利用率:晶体的空间被微粒占满的体积百分数用来表示紧密堆积程度\n金属的二维堆积方式非密置层配位数为4密置层配位数为6\n2、金属的三维堆积方式①简单立方堆积唯一金属——钋\n简单立方堆积的配位数=6\n简单立方堆积的空间占有率=52%球半径为r正方体边长为a=2r\n②体心立方堆积(钾型)K、Na、Fe\n体心立方堆积的配位数=8\n体心立方堆积的空间占有率=68%体对角线长为c面对角线长为b棱线长为a球半径为rc2=b2+a2b2=a2+a2c=4r(4r)2=3a2\n\n③六方最密堆积(镁型)Mg、Zn、TiABABA123456\n六方最密堆积的配位数=12\n六方最密堆积的晶胞\n六方最密堆积的晶胞\n六方最密堆积的空间占有率=74%上下面为菱形边长为半径的2倍2r高为2倍正四面体的高\n\n④面心立方最密堆积(铜型)Cu、Ag、AuABCAABC\n123456\n立方面心最密堆积的配位数=12\n立方面心最密堆积的空间占有率=74%\n第三章晶体的结构与性质第四节离子晶体\n一、离子晶体1、离子晶体概念:由阳离子和阴离子通过离子键结合而成的晶体叫做离子晶体组成微粒:阴阳离子粒子间作用力:离子键无分子式化学式表示离子最简整数比配位数(缩写为C.N.)一个离子周围最邻近的异电性离子的数目\n2、常见离子晶体强碱、金属氧化物、部分盐类①NaCl晶体阴离子配位数阳离子配位数66\nNaCl晶体每个Cl—周围最近且等距离的Cl—有个每个Na+周围最近且等距离的Na+有个1212每个晶胞中Cl—有个Na+有个44\n②CsCl晶体阴离子配位数阳离子配位数88\n每个Cl—周围最近且等距离的Cl—有个每个Cs+周围最近且等距离的Cs+有个66每个晶胞中Cl—有个Cs+有个11\nCsCl晶胞NaCl晶胞\n阴离子配位数阳离子配位数48③CaF2晶体CaF2晶胞\n每个F—周围最近且等距离的F—有个每个Ca2+周围最近且等距离的Ca2+有个612每个晶胞中F—有个Ca2+有个84CaF2晶胞\n3、影响离子晶体配位数的因素①几何因素:晶体中正负离子的半径比②电荷因素:正负离子的电荷比③键性因素:离子键的纯粹程度\n4、离子晶体的物理性质熔沸点较高,硬度较大,难挥发难压缩。一般易溶于水,而难溶于非极性溶剂固态不导电,水溶液或者熔融状态下能导电\n二、晶格能1、定义:气态离子形成1摩离子晶体时释放的能量2、晶格能的大小的影响因素电荷、离子半径随着离子电荷的增加或者核间距离的缩短晶格能增大晶格能越大,离子晶体越稳定熔点越高,硬度越大