- 294.50 KB
- 2022-08-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
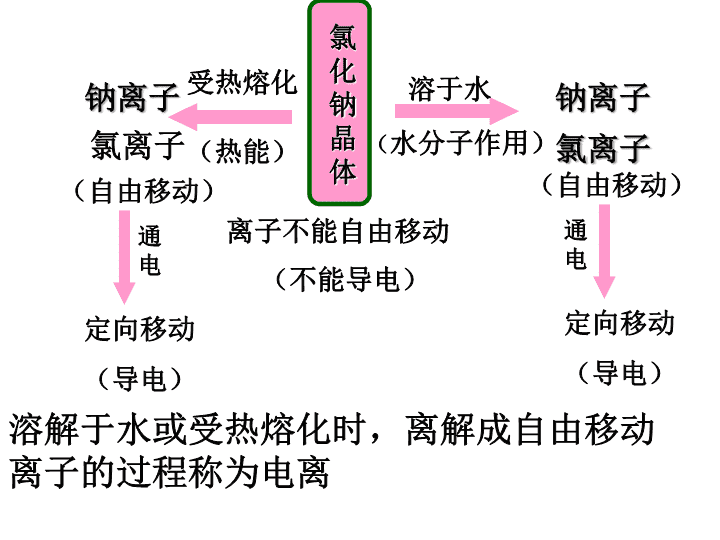
第二节离子反应\n氯化钠晶体钠离子氯离子钠离子氯离子受热熔化溶于水(热能)(水分子作用)(自由移动)(自由移动)离子不能自由移动(不能导电)定向移动(导电)通电定向移动(导电)通电溶解于水或受热熔化时,离解成自由移动离子的过程称为电离\n思考1:下列物质中哪些能导电?为什么能导电?盐酸、NaOH溶液、NaCl固体、铁、蔗糖溶液、酒精溶液、K2SO4溶液、Cu。①铁、铜能导电因为其中有自由移动的电子存在。②盐酸、NaOH溶液、K2SO4溶液能导电因为它们的溶液中有自由移动的离子存在。思考2:在盐酸、NaOH溶液、K2SO4溶液里的自由移动的离子是怎样产生的?是否所有溶液都能导电?自由移动的离子是电离产生,并不是所有溶液都能导电一、酸碱盐在水溶液中的电离\n思考3:氯化钠、K2SO4、NaOH固体是否只有在溶于水后才能导电?并非如此,在熔融状况下也能导电。只要能够电离出自由移动的离子就能导电。一、酸碱盐在水溶液中的电离\n一、电解质和非电解质:电解质:在水溶液里或熔融状态下能够导电的化合物。非电解质:在水溶液里和熔融状态下都不导电的化合物如:酸、碱、盐等如:蔗糖、酒精等\n想一想:下列物质哪些是电解质?哪些是非电解质?哪些能导电?①金属铜②固态NaCl③O2④H2SO4⑤碳棒⑥酒精⑦CO2⑧熔融状态的KNO3⑨NaCl溶液电解质:非电解质:能导电:②④⑧⑥⑦①⑤⑧⑨\n归纳小结(2)电解质、非电解质都是。单质、溶液既不是电解质,也不是非电解质。(3)电解质应是在一定条件下的化合物。某些化合物,像SO3、SO2、CO2、NH3,它们溶于水生成了电解质而导电,但本身是。(1)电解质溶液导电的原因:存在。自由移动的离子化合物本身电离非电解质\n判断正误:1、铜和石墨都能导电,它们都是电解质;Cl2不能导电,故Cl2是非电解质2、液态HCl不导电,则液态HCl为非电解质;盐酸能导电,所以盐酸是电解质3、把SO3溶于水所得的溶液能导电,所以SO3是电解质4、电解质都能够导电,能导电的物质都是电解质5、非电解质都不能导电,不能导电的物质不一定是非电解质。√XXXX\n例1、下列叙述正确的是()A.NaCl溶液在电流作用下电离成Na+与Cl_B.溶于水后能电离出H+的化合物都是酸C.氯化氢溶于水能导电。但液态氯化氢不能导电C\n例2、下列说法正确的是()A、C02溶于水得到的溶液能导电.所以CO2是电解质B、金属能导电,所以所有的金属都是电解质C、固态的NaCI不导电,熔融态的NaCI可以导电C\n例3、仅能在水溶液中导电的电解质是()A.KOHB.KNO3C.酒精D.NH4HCO3D\n思考:你怎样证明等浓度的盐酸和醋酸哪个导电能力强?说明了什么?三、强电解质和弱电解质强电解质:在水溶液里全部电离成离子的电解质。弱电解质:在水溶液里只有一部分分子电离成离子的电解质。强电解质溶液的导电能力一定比弱电解质溶液的导电能力强吗?\n强电解质:强酸强碱大部分盐H2SO4、HCl、HNO3、HBr、HICa(OH)2、NaOH、KOH、Ba(OH)2NH4Cl(氨盐)、Na2SO4、BaSO4等\n弱电解质弱酸:弱碱小部分盐H3PO4、H2SO3、HF、CH3COOH、H2S、H2CO3、HClO等氨水、不溶性碱(课本后面附录)CH3COO)2Pb、HgCl2(H2O\n强电解质弱电解质电离程度完全部分溶液里粒子离子分子离子同条件下导电性强弱物质类别强碱、强酸、大多数盐弱酸、弱碱、水强弱电解质的比较\n1、带Na的都为强电解质注意规律2、所有的硝酸盐、碳酸氢盐、醋酸盐都溶于水3、碳酸根、亚硫酸根、磷酸根、形成的盐容于水的只有钾、钠、氨\n写出下列电解质的电离方程式HCl、CH3COOH、H2SO3、Fe(OH)3、NaHSO4、NaHCO3注意:强电解质完全电离用等号,弱电解质部分电离用多元弱酸分步电离分步写,多元弱碱也是分步电离,但一步写\n请同学们观察下列两组化合物,它们有什么区别?我们怎样制得它们的?Na2SO4Na2CO3NaHSO4NaHCO3正盐和酸式盐写出电离方程式\n二、酸、碱、盐在水溶液中的电离写出H2SO4、HCl、HNO3的电离方程式H2SO4=2H++SO42-HCl=H++Cl-HNO3=H++NO3-电离时生成的阳离子全部是氢离子的化合物叫做酸。\n写出NaOH、Ba(OH)2、KOH的电离方程式NaOH=Na++OH-Ba(OH)2=Ba2++2OH-KOH=K++OH-电离时生成的阴离子全部是OH-的化合物叫碱\n用电离方程式表示NaCl、Na2SO4和Al2(SO4)3电离:NH4Cl=NH4++Cl-Na2SO4=2Na++SO42-Al2(SO4)3=2Al3++3SO42-电离时能生成金属阳离子(或者NH4+)和酸根阴离子的化合物叫做盐。\n书写电离方程式时,要注意以下几点:(1)式子左边书写电解质化学式,右边书写离子符号,表示电解质电离产生的离子。(2)离子所带的电荷数应等于元素或原子团的化合价数,原子团并不拆散。(3)在电解质溶液中,阳离子所带的正电荷总数等于阴离子所带的负电荷总数。如:\n四、离子反应:用实际参加反应的离子符号表示离子反应的式子叫离子方程式。定义:有自由移动离子参加或生成的反应都属于离子反应实质:反应物中某些离子浓度的减少\n书写离子方程式的步骤:1、写出化学方程式:例:2AgNO3+CuCl2==2AgCl↓+Cu(NO3)22、拆把易溶于水且易电离的物质写成离子形式;难溶于水、难电离的物质以及单质、气体、氧化物等仍用化学式表示。2Ag++2NO3-+Cu2++2Cl-==2AgCl↓+Cu2++2NO3-\n3、删去方程式两边相同的离子:2Ag++2NO3-+Cu2++2Cl-==2AgCl↓+Cu2++2NO3-4、整理方程式并检查两边各元素的原子个数和电荷总数是否相等:2Ag++2Cl-==2AgCl↓Ag++Cl-==AgCl↓\n练一练:用离子方程式表示下列反应:1、盐酸与氢氧化钠溶液中和H++OH-==H2O2、硫酸中加入氢氧化钾溶液H++OH-==H2O3、氢氧化钡中滴入硝酸H++OH-==H2O4、氢氧化铜溶于盐酸Cu(OH)2+2H+==Cu2++2H2O\n启示:离子方程式不仅可表示一定物质间的某个反应,而且可表示所有同一类型的离子反应。\n练:把下列化学方程式改写成离子方程式:1.2FeCl2+Cl2==2FeCl32Fe2++Cl2==2Fe3++2Cl-2.Br2+SO2+2H2O==2HBr+H2SO4Br2+SO2+2H2O==4H++2Br-+SO42-3.KClO3+6HCl==3Cl2↑+KCl+3H2OClO3-+5Cl-+6H+==3Cl2↑+3H2O\n4.CaCO3+2HCl==CaCl2+H2O+CO25.CH3COOH+NaOH==CH3COONa+H2O6.MnO2+4HCl==MnCl2+2H2O+Cl27.CH3COOH+NH3·H2O==CH3COONH4+H2OCaCO3+2H+==Ca2++H2O+CO2CH3COOH+OH-==CH3COO-+H2OMnO2+4H++2Cl-==Mn2++2H2O+Cl2CH3COOH+NH3·H2O==CH3COO-+NH4++H2O\n书写离子方程式应注意的问题:⑴凡非溶液中进行的反应一般不能写离子方程式。如:NH4Cl固体与Ca(OH)2固体混合加热,只能写化学方程式。即:2NH4Cl(固)+Ca(OH)2(固)=CaCl2+2NH3↑+2H2O△\n⑵单质、氧化物在离子方程式中一律写化学式;弱酸(HF、H2S、HClO、H2SO3等)、弱碱(NH3·H2O)等难电离物质写化学式;难溶于水的物质(如CaCO3、BaSO3、FeS、BaSO4、Fe(OH)3等)写化学式。\n练:写出下列反应的离子方程式:1、SO2气体溶于足量氢氧化钠溶液SO2+2OH-==SO32-+H2O2、向氨水中加入稀盐酸NH3·H2O+H+==NH4++H2O3、碳酸氢钠溶液与盐酸反应HCO3-+H+==H2O+CO2↑\n⑶多元弱酸的酸式盐的酸根离子在离子方程式中不能拆开写。例:1、NaHCO3与盐酸反应:HCO3-+H+==H2O+CO2↑2、KHSO4与BaCl2反应:SO42-+Ba2+==BaSO4↓\n⑷对于微溶物的处理:①在生成物中有微溶物,微溶物用化学式。②当反应物里有微溶物处于溶液状态(稀溶液),应写成离子形式。③当反应物里有微溶物处于浊液或固态,应写化学式。\n(5)对氨水的处理:氨水做为反应物写NH3·H2O;做为生成物若加热或浓溶液写NH3,若稀溶液写NH3·H2O\n(6)酸式盐与碱反应考虑量的关系例:1、少量烧碱滴入Ca(HCO3)2溶液Ca2++HCO3-+OH-==CaCO3↓+H2O2、足量烧碱滴入Ca(HCO3)2溶液Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O思考:NaHCO3溶液与Ca(OH)2溶液混合?KHSO4溶液与Ba(OH)2溶液混合?\n1、⑴NaHCO3少量时:Ca2++HCO3-+OH-==CaCO3↓+H2O⑵NaHCO3过量时:Ca2++2HCO3-+2OH-==CaCO3↓+CO32-+2H2O2、⑴KHSO4少量时:Ba2++SO42-+H++OH-==BaSO4↓+H2O⑵KHSO4过量时:Ba2++SO42-+2H++2OH-==BaSO4↓+2H2O\n离子共存问题:1、同一溶液中若离子间符合下列任意一个条件就会发生离子反应,离子之间便不能在溶液中大量共存。⑴生成难溶物或微溶物:如:Ba2+与CO32-、Ag+与Br-、Ca2+与SO42-等\n⑵生成气体或挥发性物质:如:NH4+与OH-、H+与CO32-、HCO3-、S2-HS-、SO32-、HSO3-等⑶生成难电离物质:如:H+与Ac-、CO32-、S2-、SO32-等生成弱酸;OH-与NH4+生成的弱碱;H+与OH-生成水\n知识点1:离子共存的判断例2下列各组离子中,能在溶液中大量共存的是( )A.K+、Ag+、H+、Cl-B.Ba2+、Na+、CO32-、OH-C.H+、K+、CO32-、SOD.Al3+、Fe3+、SO42-、Cl-跟踪练习2在无色透明的强酸性溶液中,能大量共存的离子组是( )A.K+、Cu2+、NO3-、SO42-B.K+、Na+、Cl-、CO32-C.Zn2+、NH4+、NO3-、Cl-D.K+、Na+、MnO4-、SO42-