- 1.01 MB
- 2022-08-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
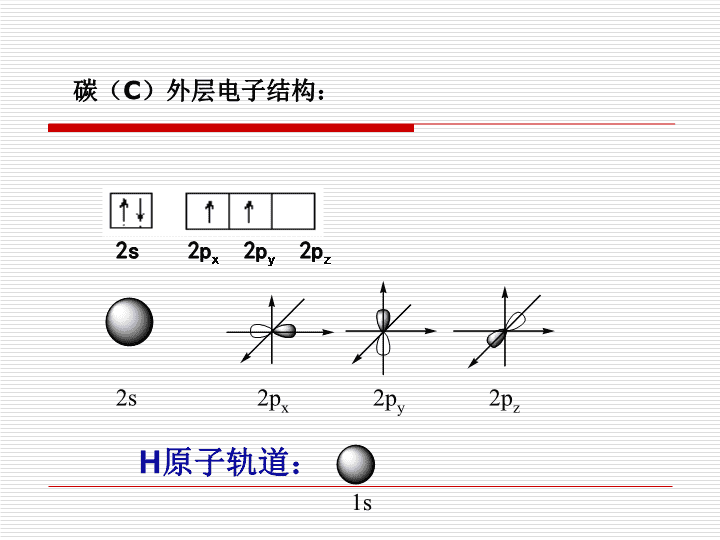
第二节分子的立体结构(第二课时)\n2s2px2py2pz2s2px2py2pzH原子轨道:1s碳(C)外层电子结构:\n思考:价层电子对互斥模型只能解释化合物分子的空间构形,却无法解释许多深层次的问题,如无法解释甲烷中四个C-H的键长、键能相同及H-C-H的键角为10928′。因为按照我们已经学过的价键理论,甲烷的4个C-H单键都应该是σ键,然而,碳原子的4个价层原子轨道是3个相互垂直的2p轨道和1个球形的2s轨道,用它们跟4个氢原子的1s原子轨道重叠,不可能得到四面体构型的甲烷分子。这是为什么呢?\n鲍林在价键理论基础上提出了“杂化”假设,补充了价键理论的不足。\nsp3CH4分子(sp3杂化)三、杂化轨道理论\n1、基本要点:在形成多原子分子的过程中,中心原子的若干能量相近的原子轨道重新组合形成一组新轨道。这种轨道重新组合的过程叫做轨道的杂化,所形成的新轨道就称为杂化轨道。(一)、杂化轨道2、特点:杂化前后轨道数目不变杂化后的轨道能量相同,形状相同(电子云一头大,一头小)主族元素的ns、np轨道,过渡元素ns、np、(n-1)d轨道\n\n同一个原子的1个ns轨道与3个np轨道进行杂化组合为4个sp3杂化轨道(含1/4原s轨道成份和3/4原p轨道成份)。sp3杂化轨道间的夹角是:10928’,杂化轨道空间构型:正四面体形。(二)杂化类型1、sp3杂化\nC2H4(sp2杂化)\n(二)杂化类型2、sp2杂化平面正三角形120同一原子中s轨道与p轨道杂化形成sp2杂化轨道。sp2杂化轨道间的夹角是:杂化轨道空间构型:1个2个3个\n+例:5B2p2p2sSp2sp2杂化BF3\n\n(二)杂化类型3、sp杂化:同一原子中s轨道与p轨道杂化形成sp杂化轨道。sp杂化轨道夹角为:杂化轨道空间构型:直线形180°1个1个2个\n2S6Csp杂化2Pspppsp杂化例:4Be2p2p2s两个SP杂化轨道BeCl2\n4.sp3d杂化:由中心原子的一个s轨道、三个p轨道和一个d轨道杂化组合成五个新的sp3d杂化轨道。杂化轨道夹角:90°、120°杂化轨道空间构型:三角双锥如:PCl5中的磷原子\n5.sp3d2杂化:由中心原子的一个s轨道、三个p轨道和两个d轨道杂化组合成六个新的sp3d2杂化轨道。杂化轨道夹角:90°杂化轨道空间构型:正八面体2、杂化轨道的类型如:SF6中的硫原子\n杂化类型参加杂化的轨道杂化轨道数分子空间构型实例价层电子对数s+ps+(2)ps+(3)p243四面体234spsp2sp3小结:杂化轨道的类型与分子的空间构型杂化轨道间的夹角直线形平面三角形三角锥V型109.5°'\n3、杂化轨道类型与分子构型的判断⑵杂化轨道类型与分子构型的判断⑴计算中心原子价电子对★杂化轨道数中心原子孤对电子对数+中心原子结合的原子数=价电子对数\n结合上述信息完成下表:杂化轨道只用于形成σ键或者用来容纳未成键孤对电子0+2=2SP直线形0平面三角形0+3=3SP200+4=4SP3正四面体形0平面形0+3=3SP2000+2=2SP直线形1+3=4SP3三角锥形1V形2+2=4SP32化学式杂化轨道数杂化轨道类型分子结构CO2CH2OCH4C2H4中心原子孤对电子对数C2H2NH3H2O★杂化轨道数中心原子孤对电子对数+中心原子结合的原子数=中心原子的价电子对数\n含C元素的化合物通过看中心原子C有没有形成双键或三键来判断中心原子的杂化类型。规律:如果有1个三键或两个双键,则其中有2个π键,用去2个P轨道,形成的是SP杂化;如:CO2C2H2HCN如果有1个双键和2个单键则其中必有1个π键,用去1个P轨道,形成的是SP2杂化;如:C2H4CH2O如果有4个单键,则形成SP3杂化。如:CH4C2H6\n试用杂化轨道理论分析乙烯和乙炔分子的成键情况交流讨论\nC原子在形成乙烯分子时,碳原子的2s轨道与2个2p轨道发生杂化,形成3个sp2杂化轨道,伸向平面正三角形的三个顶点。每个C原子的2个sp2杂化轨道分别与2个H原子的1s轨道形成2个相同的σ键,各自剩余的1个sp2杂化轨道相互形成一个σ键,各自没有杂化的l个2p轨道则垂直于杂化轨道所在的平面,彼此肩并肩重叠形成π键。所以,在乙烯分子中双键由一个σ键和一个π键构成。\nC原子在形成乙炔分子时发生sp杂化,两个碳原子以sp杂化轨道与氢原子的1s轨道结合形成σ键。各自剩余的1个sp杂化轨道相互形成1个σ键,两个碳原子的未杂化2p轨道分别在Y轴和Z轴方向重叠形成π键。所以乙炔分子中碳原子间以叁键相结合。\n练习:用杂化轨道理论分析下列物质的杂化类型、成键情况和分子的空间构型。(1)CO2(2)H2O(3)HCHO(4)HCN(5)SO3\n练习:1.下列分子中中心原子的杂化轨道类型与其他三个都不一样的是()A.HCNB.CO2C.BeCl2D.PCl32、用Pauling的杂化轨道理论解释甲烷分子的四面体结构,下列说法不正确的是()A、C原子的四个杂化轨道的能量一样B、C原子的sp3杂化轨道之间夹角一样C、C原子的4个价电子分别占据4个sp3杂化轨道D、C原子有1个sp3杂化轨道由孤对电子占据DD\n3、根据杂化轨道理论,请预测下列分子或离子的几何构型:CO2、CO32-、H2S、PH34、乙炔分子中4个原子位于一条直线上,对其结构分子如下:(1)分子中的两个碳原子都发生了杂化,所得杂化轨道在空间位置的关系是;(2)除了杂化轨道外,碳原子还有个未参与杂化的P轨道,它们与杂化轨道在空间位置的关系是;(3)碳原子通过轨道分别与氢原子和另一个碳原子形成键,两个碳原子间通过未参与杂化的P轨道形成个键;练习:SP直线形2互相垂直2个SPσ2