- 2.11 MB
- 2022-08-03 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
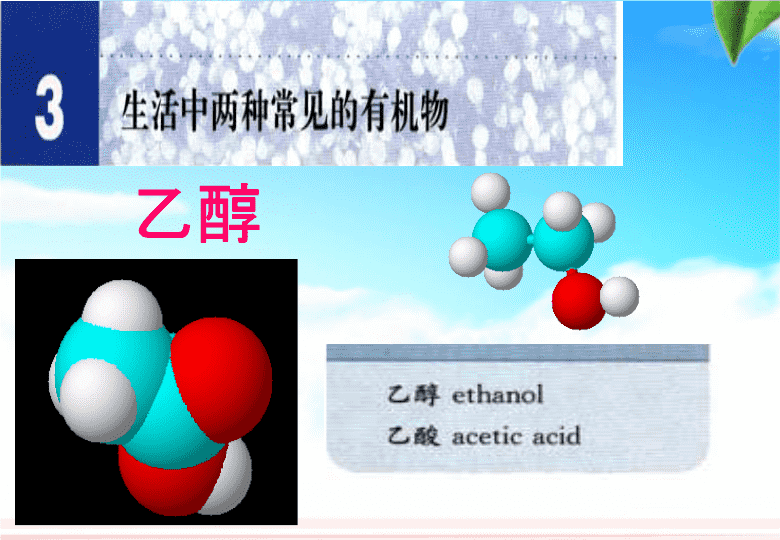
乙醇\n乙醇的用途乙醇饮料化工原料溶剂医药燃料消毒剂(75%的乙醇溶液)饮料\n药酒、料酒、碘酒等。乙醇是一种优良的溶剂。可以溶解多种有机物和无机物。\n含酒精:3%-5%含酒精:6%-20%含酒精:38%-65%75%95%含酒精:8%-15%身边的乙醇请大家,从颜色、气味、状态、水溶性等方面观察总结说说乙醇的物理性质。\n颜色:气味:状态:密度:挥发性:溶解性:无色透明特殊香味液体比水小200C时的密度是0.7893g/cm3和水可以以任意比互溶能够溶解多种无机物和有机物沸点78℃,易挥发一、乙醇的物理性质\n分子式:C2H6O结构式:结构简式:CH3CH2OH或C2H5OH羟基(-OH)H-C-C-OH-H---HHH球棍模型比例模型二、乙醇的分子结构\n〖实验探究〗乙醇与钠的反应先向试管中滴加适量无水乙醇,然后投入一小块金属钠,观察并与钠与水反应的现象比较,填写下列表格反应现象燃气体烧现象水乙醇浮熔游响红钠沉在试管底部有气泡产生淡蓝色火焰淡蓝色火焰\n1、乙醇与钠的反应222[练习]其它活泼金属如钾、镁等也可与乙醇反应,均可产生H2,请写出钾与乙醇反应的化学方程式。2CH3CH2OH+2K2CH3CH2OK+H2↑乙醇钾三、乙醇的化学性质H—C—C—O—H,HHHH①处O—H键断开①CH3CH2OH+Na→CH3CH2ONa+H2↑乙醇钠取代反应\nCH3—CH2—OH醇的官能团-羟基(-OH)烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物称为烃的衍生物。烃的衍生物:官能团:决定有机物化学特性的原子或原子团。例如:卤素原子(—X)、羟基(—OH)、硝基(—NO2)等都是官能团,烯烃中的碳碳双键也是官能团。\n实验3-3P74Δ插入乙醇溶液中(2)乙醇的催化氧化(很重要)2.氧化反应(1)燃烧C2H5OH+3O2→2CO2+3H2O点燃(彻底氧化)变黑有刺激性气味又变红铜丝现象:\n铜丝变黑2Cu+O22CuO△又变红产生刺激性气味ΔC2H5OH+CuO+CuCH3CHO乙醛+H2O总反应方程式:2CH3CH2OH+O22CH3CHO+2H2OCu(2)乙醇的催化氧化Cu或Ag作催化剂\nH—C—C—HOHHHH31同时断键13乙醇催化氧化的断键位置22HH—C—C—HOH\n交警判断驾驶员是否酒后驾车的方法K2Cr2O7Cr2(SO4)3(橙红色)(绿色)乙醇酒精检测仪(3)被酸性KMnO4、K2Cr2O7溶液氧化为乙酸\n酒精的快速检测C2H5OH应用生活Cr2(SO4)3K2Cr2O7\n4)、分子内脱水浓H2SO41700CCH3CH2OH CH2=CH2+H2OH2OC—C—HHHHHO—H(消去反应)实验制取乙烯\n点拨提升乙醇分子中不同的化学键如图所示:当乙醇与钠反应时,_____键断裂;当乙醇与氧气反应(Cu作催化剂)时,_______键断裂。①③①\n四、乙醇的用途乙醇饮料化工原料溶剂医药燃料12345\n焊接银器、铜器时,表面会生成黑色的氧化膜,银匠说,可以先把铜、银在火上烧热,马上蘸一下酒精,铜银会光亮如初。乙醇的氧化反应\n一、乙醇的物理性质:二、乙醇的结构:三、乙醇的化学性质:1.乙醇与活泼金属反应(取代反应)2C2H5OH+2Na→2C2H5ONa+H2↑2.乙醇的氧化反应①燃 烧:②催化氧化:3.被酸性KMnO4、K2Cr2O7溶液氧化为乙酸四、乙醇的用途:小结H—C—C—O—H︱︱︱︱HHHH2CH3CH2OH+O22CH3CHO+2H2O乙醛Cu2CO2+3H2OC2H5OH+3O2点燃\n1.下列有关乙醇的物理性质的应用中不正确的()A、由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中草药的有效成分C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒D.由于乙醇容易挥发,所以才有俗语“酒好不怕巷子深”的说法【随堂巩固】A\n世界卫生组织的事故调查显示,大约50%-60%的交通事故与酒后驾驶有关。友情提示:珍爱生命,杜绝酒驾!X