- 289.59 KB
- 2022-08-04 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
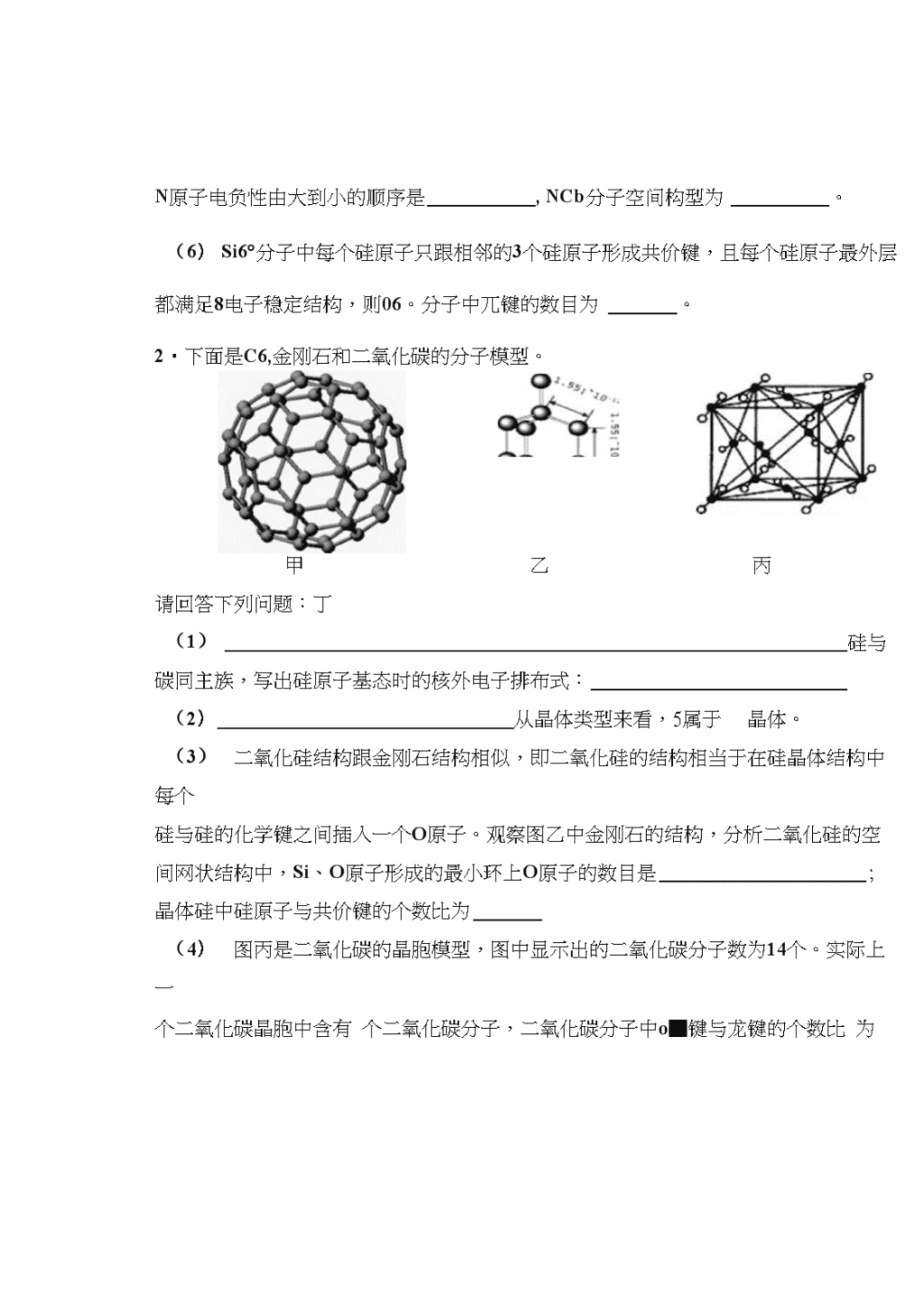
期末总复习一高中化学选修3高考题型专项练习1.纳米技术制成的金属燃料、非金属固体燃料氢气等已应用到社会生活和高科技领域。单位质量的A和B单质燃烧时均放出大量热,可用作燃料。已知A和B为短周期元素,电离能(kJ/mol)/1厶hA93218211539021771B7381451773310540其原子的第一至第四电离能如下表所示:(1)某同学根据上述信息,推断B的核外电子排布如右图所示,该同学所画的电子排3sH2sIs个1I蚀时2p布图违背了。(2)ACb分子中A的杂化类型为。(3)氢气作为一种清洁能源,必须解决它的储存问题,可用作储氢材料。已知金刚石中的C-C的键长为154.45pm,C“中C-C键长为145〜140pm,有同学据此认为的熔点高于金刚石,你认为是否正确,并阐述理由。质在低温时是一种超导体。写出基态钾原子的价电子排布式,该物质的K原子和分子的个数比为o'C60(4)科学家把C6。和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物\n(5)继C&0后,科学家又合成了Sis。、NqC、Si、\nN原子电负性由大到小的顺序是,NCb分子空间构型为。(6)Si6°分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则06。分子中兀键的数目为。2•下面是C6,金刚石和二氧化碳的分子模型。甲乙丙请回答下列问题:丁(1)硅与碳同主族,写出硅原子基态时的核外电子排布式:(2)从晶体类型来看,5属于晶体。(3)二氧化硅结构跟金刚石结构相似,即二氧化硅的结构相当于在硅晶体结构中每个硅与硅的化学键之间插入一个O原子。观察图乙中金刚石的结构,分析二氧化硅的空间网状结构中,Si、O原子形成的最小环上O原子的数目是;晶体硅中硅原子与共价键的个数比为(4)图丙是二氧化碳的晶胞模型,图中显示出的二氧化碳分子数为14个。实际上一个二氧化碳晶胞中含有个二氧化碳分子,二氧化碳分子中o■键与龙键的个数比\n为。(5)有机化合物中碳原子的成键方式有多种,这也是有机化合物种类繁多的原因之一。丙烷分子中2号碳原子的杂化方式是,丙烯分子中2号碳原子的杂化方式是,丙烯分子中最多有个原子共平面。\n3.铜是垂要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答以下问题:(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为;(2)CuSO4粉末常用来检验一些有机物中的微量水分,其原因是;(3)SO/的立体构型是,其中S原子的杂化轨道类型是;O原子的价电子排布图为,这两种元素形成的气态氢化物的熔点较高的是(写化学式),原因为o(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为;一种铜合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心,Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为;该晶体中,原子之间的作用力是4.2010年上海世博会场馆,大量的照明材料或屏幕都使用了发光二极管(LED)。目前市售LED晶片,材质基本以GaAs(碎化镣)、AlGalnP(磷化铝稼钢)、InGaN(氮化钢稼)为主…已知稼是铝同族下一周期的元素。碎化稼的晶胞结构如右图。试回答:⑴傢的基态原子的电子排布式是。⑵碑化掾晶胞中所包含的碑原子(白色球)个数为,与同一个稼原子相连的碎原子构成的空间构型为。⑶N、P、As处于同一主族,其氢化物沸点由高到低的顺序是。(用氢化物分子式表示)⑷碎化稼可由(CH3)3Ga和ASH3在700*C时制得。(CH3)\n3Ga中稼原子的杂化方式为o⑸比较二者的第一电离能:AsGa(填“v”、“〉”或“=”)。⑹下列说法正确的是(填字母)。\nC.电负性:As>GaD.碎化掾晶体中含有配位键5.三氟化氮(NFs)是一种无色、无味、无毒且不可燃的气体,在半导体加工、太阳能电池制造和液晶显示器制造中得到广泛应用。它可在铜的催化作用下由F2和过量的NHs反应得到,该反应另一种产物为盐。(1)该反应的化学方程式为,生成物NFs中氮原子的杂化方式为,NFs分子空间构型为;(2)N、F两种元素的氢化物稳定性比较,NHsHF(选填“〉”或“v”)(3)N$被称为类卤离子,写出2种与2-互为等电子体的分子的化学式;;(4)元素A基态原子的核外电子排布式为ls22s22p63s23p64s2,A跟氟可形成离子化合物,其晶胞结构如上图,该离子化合物的电子式为。6.—项科学研究成果表明,铜镭氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化>碳和甲醛(HCHO)o⑴向一定物质的量浓度的Cu(NO3)2和Mn(N()3)2溶液中加入Na2CO3溶液,所得沉淀经高温灼烧,可制得CuMnzOqo①Mi?+基态的电子排布式可表示为o②NO?的空间构型是(用文字描述)。(2)在铜猛氧化物的催化下,CO被氧化为CO?,HCHO被氧化为CO?和H2O。①根据等电子体原理,CO分子的结构式为o②H2O分子中O原子轨道的杂化类型为。③1molCO2中含有的6键数目为。⑶向CuSO4溶液中加入过量NaOH溶液可生^[Cu(OH)4]2_o不考虑空间构型,[Cu(OH)4]2~的结构可用示意图表示为o\n7・(1)元素的第一电离能:A1Si瀕““或“V”)。⑵基态Mi?+的核外电子排布式为。⑶硅烷(Si“H2"+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是O(4)硼砂是含结晶水的四硼酸钠,其阴离子X"(含臥O.H三种元素)的球棍模型如下图所示:①在X"中,硼原子轨道的杂化类型有;配位键存在于原子之间(填原子的数字标号);加=(填数字)。②硼砂晶体由Na+、X"和比()构成,它们之间存在的作用力有(填序号)。A・离子键B.共价键C・金属键D.范德华力E.氢键8-(1)可正确表示原子轨道的是oA.2sB.2dC.3pxD.3f⑵写出基态傢(Ga)原子的电子排布式。(3)下列物质变化,只与范德华力有关的是A・干冰熔化B・乙酸汽化0CHII/「H—C—N\C.乙醇与丙酮混溶D・CII.溶于水E.碘溶于四氯化碳F.石英熔融(4)下列物质中,只含有极性键的分子是,既含离子键又含共价键的化合物是;只存在。键的分子是,同时存在<7键和7:键的分子是。A.N2B.CO2C.CH2CI2D.C2H4E.C2H6F.CaCl2G.NH4C1⑸用“〉”、“V”或“=”填空:第一电离能的大小:MgAl;熔点的高低:KC1MgOo\n9.VIA族的氧、硫、硒(Se)、硏(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化合物在研究和生产中有许多重要用途。请回答下列问题:(1)S单质的常见形式为S8,其环状结构如右图所示,S原子采用的轨道杂化方式是;(2)原子的第一电离能是指气态电中性基态原子失去一个电子转化为气态基态正离子所需要的最低能量,O、S、Se原子的第一电离能由大到小的顺序为;(3)Se原子序数为,其核外M层电子的排布式为;⑷FhSe的酸性比H2S(填“强"或“弱”)。气态SeOs分子的立体构型为,SO亍离子的立体构型为;⑸H2ScO3的&和£分别为2.7x10-3和2.5x10-8,H2SeO4第一步几乎完全电离,&为1.2x10—2,请根据结构与性质的关系解释:①HzSeOs和HzSeOq第一步电离程度大于第二步电离的原因:②H2SeO4比H2ScO3酸性强的原因:;(6)ZnS在荧光体、光导体材料、涂料、颜料等行业中应用广泛。立方ZnS晶体结构如右图所示,其晶胞边长为540.0pm,密度为・cmT(列式并计算),a位置S"离子与b位置+离子之间的距离为pm(列式表示)°10.金属鎳在电池、合金、催化剂等方面应用广泛。(1)下列关于金属及金属键的说法正确的是。a.金属键具有方向性与饱和性b.金属键是金属阳离子与自由电子间的相互作用c.金属导电是因为在外加电场作用下产生自由电子d.金属具有光泽是因为金属阳离子吸收并放出可见光\n(1)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是0\n(3)过滤金属配合物Ni(CO)”的中心原子价电子数与配体提供电子总数之和为18,则〃=。CO与2结构相似,CO分子内键与;r键个数之比为。⑷甲醛(H2C=O)在Ni催化作用下加氢可得甲醇(CH3OH)o甲醇分子内C原子的杂化方式为,甲醇分子内的O-C—H键角(填“大于”“等于”或“小于”)甲醛分子内的O—C一H键角。11・原子序数依次增大的短周期元素a、b、c、d和e中,a的绘外层电子数为其周期数的二倍;b和d的A?B型氢化物均为V形分子,c的+1价离子比e的一1价离子少8个电子。回答下列问题:(1)元素a为,c为(2)由这些元素形成的双原子分子为,(3)由这些元素形成的三原子分子中,分子的空间结构属于直线形的是,非直线形的是;(写2种)(4)这些元素的单质或由它们形成的AB型化合物中,其晶体类型属于原子晶体的是,离子晶体的是,金属晶体的是,分子晶体的是;(每空填一种)(5)元素a和b形成的一种化合物与c和b形成的一种化合物发生的反应常用于防毒面具中,该反应的化学方程式为o12.过渡金属元素氧化物的应用研究是目前科学研究的前沿之一,试回答下列问题:I.二氧化钛作光催化剂能将居室污染物甲醛.苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛.苯.二氧化碳及水说法正确的是。A.苯与B3N3H6互为等电子体B.甲醛.苯分子中碳原子均采用sp?杂化C.苯.二氧化碳是非极性分子,水和甲醛是极性分子D.水的沸点比甲醛高得多,是因为水分子间能形成氢键\nn.2007年诺贝尔物理学奖为法国科学家阿尔贝•费尔和德国,科学家彼得•格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合\n氧化物(如右图),以A原子为晶胞的顶点,A位可以是Ca・Sr.Ba或Pb,当B位是V.Cr.Mn.Fe时,这种化合物具有CMR效应。⑴用A.B.()表示这类特殊晶体的化学式:⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物LaB.A.MnOj,(x<0.1),此时一部分猛转变为+4价。导致材料在某一温度附近有反铁磁.铁磁.铁磁.顺磁转变及金属-半导体的转变,则La】.AMnO3中三价锈与四价镭的物质的量之比为:。(用含x的代数式表示)⑶Mn的核外电子排布式为o⑷下列有关说法正确的是。A.镉.镭.氧分别位于周期表f.d.p区B.氧的第一电离能比氮的第一电离能大;铜晶C.猛的电负性为1.59,Cr的电负性为1.66,说明镭的金属性比铅强12.铜合金是人类使用最早的金属材料。铜在化合物中的常见化合价有+1、+2等,故能形成多种铜的化合物。(1)基态Cu原子的电子排布式是体晶胞如图所示,该晶胞实际拥有个铜原子;(2)①某+1价铜的配离子为[Cu(CN)4]A,与配体互为等电子体的一种微粒是(写化学式)。②许多+1价铜的配合物溶液能吸收CO和烯炷(如C2H4>CH3CH=CH2等),CH3CH=CH2分子中3个C原子采取的杂化方式依次为。(3)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。写出此蓝色沉淀溶解的离子方程式;根据价层电子对互斥模型,预测SO?-的空间构型为。\n12.已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的原子序数依次增大。其中A、C原子的L层有2个未成对电子。D与E同主族,D的二价阳离子与C的阴\n离子具有相同的电子层结构。F"离子M层3d轨道电子为半满状态。请根据以上情况,回答下列问题:(答题时,用所对应的元素符号表示)(1)写出F原子的电子排布式,F位于周期表区。(2)A、B、C的第一电离能由小到大的顺序为。(3)F和M(质子数为25)两元素的部分电离能数据列于下表:元素MF电能(kJ・mo「)11717759【215091561I332482957比较两元素的【2、b可知,气态M2+再失去一个电子比气态F?+再失去一个电子难。对此,你的解释是;(4)已知F晶体的堆积方式与金属钾相同,则F晶胞中F原子的配位数为,一个晶胞中F原子的数目为。(5)H2S和C元素的氢化物(分子式为H2C2)的主要物理性质比较如下:熔点/K沸点/K标准状况时在水中的溶解度h2s1872022.6H2C2272423以任意比互溶h2s和H2C2的相对分子质最基本相同,造成上述物理性质差异的主要原因\n请回答下列问题:(1)表中属于d区的元素是(填编号)。(2)科学发现,②、④、⑨三种元素的原子形成的晶体具有超导性,其晶胞的结构特点如右图所示(图中②、④、⑨分别位于晶胞的体心、顶点、面心),则该化合物的化学式为(用对应的元素符号表示)。②⑨④一--•O•15.下表为长式周期表的一部分,其中的编号代表对应的元素。①②③④⑤⑥⑦⑧⑨⑩(3)元素②的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石•油化工发展水平的标志。有关该氢化物分子的说法正确的是。A・分子中含有分子间的氢键B.属于含有极性键的非极性分子C.只含有4个sp・s的(7键和1个p・p的7:键D.该氢化物分子中②原子采用sp2杂化(4)某元素的价电子排布式为nsnnpn+1,该元素原子的核外撮外层电子的孤对电子数为;该元素与元素①形成的18电子的X分子(分子量32)的电子式为;该元素还可与元素①形成10电子的气体分子Y(分子量17),将过量的Y气体通入盛有硫酸铜水溶液的试管里,现象为(5)下表为原子序数依次增大的短周期元素A〜F的第一到第五电离能数据。电离能I(eV)ABCDEFIi11.314.513.65.27.66.0I224.429.635.149.315.01&8\nIs47.947.454.971.680.12&4Li64.577.577.49&9109.2112.0I5392.197.9113.9138.3141.3153.7请回答:表中的金属元素是(填字母);若A、B、C为原子序数依次增大的同周期相邻元素,表中显示B比A和C的第一电离能都略大,其原因是—16.(1)C、Si、Ge、Sn是同族元素,该族元素单质及其化合物在材料、医药等方面有重要应用。请回答下列问题:①Ge的原子核外电子排布式为②C、Si、Sn三种元素的单质中,能够形成金属晶体的是③按要求指出下列氧化物的空间构型、成键方式或性质a・CO2分子的空间构型及碳氧之间的成键方式;b.SiO2晶体的空间构型及硅氧之间的成键方式;c.己知SnO2是离子晶体,写出其主要物理性质(写出2条即可)d.CO可以和很多金屈形成配合物,如Ni(CO)4,Ni与CO之间的键型为(2)将0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,该反应的热化学方程式已知:H?O(l)=H?O(g).AH=+44kJ/mol,则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是kJ。17.A、B、C、D、E、F、G七种元素,除E为第四周期元素外,其余均为短周期元素。A\n、E、G位于元素周期表的s区,其余元素位于p区。A、E的原子最外层电子数相同,A的原子中没有成对电子;B元素基态原子中电子占据三种能最不同的原子轨道,且每种轨道中的电子总数相同;C元素原子的外围电子层排布式为nsMnpn+:;D元素的电负性为同周期元素第二高;F的基态原子核外成对电子数是成单电子数的3倍;G的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数均相同。回答下列问题:(1)写出下列元素的元素符号:D,G(2)原子序数比D小1的元素的第一电离能高于D的原因是(3)由A、B、C形成的ABC分子中,含有个b键,个龙键。(4)由D、E、F、G形成的E2DF4xGDF4的共熔体在冷却时首先析出的物质是(填化学式),原因是o17.铜合金是人类使用最早的金属材料。铜在化合物中的常见化合价有+1、+2等,故能形成多种铜的化合物。基态Cu原子的电子排布式是铜晶体晶胞如图所示,该晶胞实际拥有个铜原子;(2)①某+1价铜的配离子为[Cu(CN)4]3-,与配体互为等电子体的一种微粒是(写化学式)。\n②许多+1价铜的配合物溶液能吸收CO和烯炷(如C2H4等),CH3CH=CH2分子中3个C原子采取的杂化方式依次为。(3)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。写出此蓝色沉淀溶解的离子方程式:;根据价层电子对互斥模型,预测SO/一的空间构型为。17.决定物质性质的重要因素是物质结构。请回答下列问题。(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:电离能/kJ・mo「III2I3hA5781817274511578B7381451773310540A通常显价,A的电负性B的电负性a真“〉y”或“=”)。(2)紫外光的光子所具有的能量约为399kJ・mo】T。根据下表有关蛋白质分子中重要化学键的信息,说明人体长时间照射紫外光后皮肤易受伤害的原因:。组成蛋白质的最简单的氨基酸中的碳原子杂化类型是。共价键c-cC-Nc-s键能/kJ-moF1347305259(3)实验证明:KCkMgO、CaO、TiN这4种晶体的结构与NaCl晶体\n-Q••-离子晶体NaClKCICaO晶格能/kJ・mo「7867153401个。叭2结构相似(如右图所示),已知3种离子晶体的晶格能数据如下表:则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是:其中MgO晶体中一个周围和它城邻近且等距离的M尹有(4)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是。(5)某配合物的分子结构如右图所示,其分子内不含有(填序号)。A.离子键B.极性键C.金属键D.配位键E.氢键F.非极性键20•现有六种元素,其中A、B、C、D为短周期主族元素,E、F为第四周期元素,它们的原子序数依次增大。请根据下列相关信息,回答问题.A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同B元素原子的核外p电子总数比s电子总数少1C原子p轨道上成对电子数等于未成对电子数,且与A同周期D元素的主族序数与周期数的差为4,且不与A元素在同一周期E是第七列元素F是第29号元素(1)A的基态原子中能最最高的电子,其电子云在空间有个方向,原子轨道呈形。(2)E?+的基态核外电子排布式为。\n(3)A、B、C三种元素的最简单氢化物的熔点由低到高的顺序是。A、B、C三种元素中与AC?互为等电子体的分子的结构式为。(用元素符号表示)\n(3)用晶体的x射线衍射法对F的测定得到以下结果:F的晶胞为面心立方最密堆积(如右图),又知该晶体的密度为9.00g/cm\晶胞中该原子的配位数为;F的原子半径是cm;(阿伏加徳罗常数为Na,要求列式计算)。21.已知A、B、C、D、E、F为元素周期表中原子序数依次增大的前20号元素,A与B;C、D与E分别位于同一周期。A原子L层上有2对成电子,B、C、D的核外电子排布相同的简单离子可形成一种C3DB6型离子晶体X,,CE、FA为电子数相同的离子晶体。(1)写出A元素的基态原子价电子排布式;F离子电子排布式O(2)写出X的化学式和化学名称o(3)写出X涉及化工生产中的一个化学方程式o(4)试解释工业冶炼D不以DEs而是以DzAj为原料的原因:。(5)CE、FA的晶格能分别为786KJ/molk3401KJ/mo,试分析导致两者晶格能差异的主要原因是:(6)F与B可形成离子化合物,其晶胞结构如图所示:F与B形成离子化合物的化学式为;该离子化合物晶体的密度为ag/cm3,则晶胞的体积是(只要求列出算式)。22.A、B、C、D四种短周期元素,原子序数依次增大,原子半径按C、D、B、A顺序\n逐渐减小。A、C同主族,B、D同主族;A、C的原子核内质子数之和为B、D的原子核内质子数之和的一半;C元素与其它三种元素均能形成离子化合物。试回答下列问\n(1)B的离子符号;D基态原子的核外电子排布式;C、D形成化合物的电子式;(2)同时含有上述四种元素的化合物有多种,试写出其中两种的化学式(要求:其中有一种水溶液显中性)、;(3)A、B、C三元索中各由两种组成的两种化合物,相互反应生成A的单质的化学方程式为;<4)B、C、D三元素中各由两种组成的两种化合物,发生化合反应且属于氧化还原反应的化学方程式为o21.已知:A、B、C、D、E是周期表中前36号元素,A是原子半径故小的元素,B元素基态原子的2P轨道上只有两个电子,C元素的基态原子L层只有2对成对电子,D元素在第三周期元素中电负性故大,E?+的核外电子排布和Ar原子相同。请回答下列问题:(1)分子式为BC2的空间构型为;D元素原子的核外电子排布式为o(2)B第一电离能比C(填“大”或“小”);A与B形成的最简单化合物的分子空间构型为,其中心原子的杂化为o(3)A?C所形成的晶体类型为;E单质所形成的晶体类型为o(4)若向由A、C组成某种化合物的稀溶液中加入少量二氧化镭,有无色气体生成。则该化合物的分子式是,属于分子(填:“极性”或“非极性”),该反应的化学方程式是:\n(5)C跟E可形成离子化合物,其晶胞结构与NaCl的晶胞相似,同为面心立方结构。该离子化合物晶体的密度为pg-cm'3,Na表示阿伏加德罗常数,则该离子化合物晶胞的体积是(用含"、Na的代数式表示)。24•甲、乙、丙、丁、戊为原子序数依次增大的短周期元素。甲、丙处于同一主族,丙、\n丁、戊处于同一周期,戊原子的敲外层电子数是甲、乙、丙原子域外层电子数之和。甲、乙组成的常见气体X能使湿润的红色石蕊试纸变蓝;戊的单质与X反应能生成乙的单质,同时生成两种溶于水均呈酸性的化合物Y和Z,o.lmol/L的Y溶液pH>l;丁的单质既能与丙元索最高价氧化物的水化物的溶液反应生成盐L,也能与Z的水溶液反应生成盐;丙、戊可组成化合物M。请回答下列问题:⑴戊离子的结构示意图为:o(2)写出乙的单质的电子式:。丁原子的核外电子排布式:o将充分电解后所得溶液逐滴加入到酚酥试液中,观察到的现象是。25.【化学——选修物质结构与性质】(15分)X、Y、T、Q四种元素,位于元素周期表前四周期,元素的性质或结构信息见下表。请根据上述信息回答下列问题:(1)写出X3■的一种等电子体的化学式:X的气态氢化物易液化的原因是。(2)写出T元素基态原子的核外电子排布图;Q元素的原子核外有种运动状态不同的电子。\n元素性质或结构信息X单质为双原子分子,分子中含有3对共用电子对,常温下单质气体性质稳定,但其原子较活泼Y二价阳离子的外围电子层排布为3d9T原子核外s轨道电子总数等于p轨道电子总数;人体内含量绘多的元素,且其单质是常见的助燃剂Q第三周期主族元素中原子半径最小(3)元素X、T的电负性相比,的小(填元素名称);元素X的第一电离能与T相比较,T的(填“大”或“小”)。(1)甲醛(CH2O)分子中"键与兀键的个数之比为。(2)Y元素在周期表中位于区。Y单质晶体的晶胞如右图所示,该晶胞中实际拥有个原子,该晶体中Y原子在三维空间里的堆积方式为堆积。(3)在Y的硫酸盐溶液中通入X的气态氢化物至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。此蓝色沉淀溶解的离子方程式为(4)元素X与Q可形成化合物XQs,根据价层电子对互斥理论判断XQ3的空间构型为,分子中X原子的杂化方式为杂化。25.能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。(1)太阳能热水器中常使用一种以鎳或鎳合金空心球为吸收剂的太阳能吸热涂层,写出基态線原子的外围电子排布式,它位于周期表区。(2)富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为;1mol\n示。晶胞中Cu原子的配位数为,一个晶胞中Cu(1)Cu单质晶体中原子的堆积方式如下图甲所示,其晶胞特征如下图乙所示,原子之间相互位置关系的平面图如下图丙所原子的数目为(1)Cu单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中Cu原子的配位数为,一个晶胞中Cu原子的数目为。(2)Fe(CO)5常温下呈液态,熔点为一20.5°C,沸点为103°C,易溶于非极性溶剂,据此可判断Fc(CO)s晶体属于(填晶体类型);Fe(CO)5是配合物,配体.配位数分别是.。(3)下列说法正确的是。A.第一电离能大小:S>P>SiB・电负性顺序:C