- 612.00 KB
- 2022-08-04 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
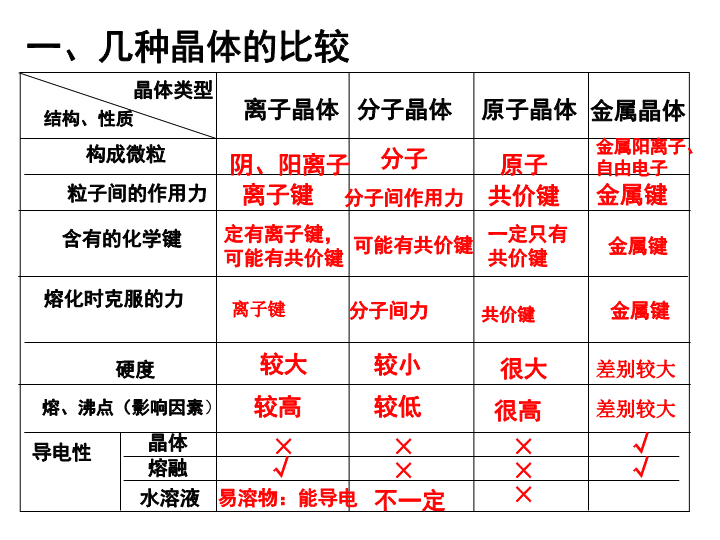
一、几种晶体的比较导电性熔、沸点(影响因素)硬度粒子间的作用力原子晶体分子晶体离子晶体晶体类型构成微粒结构、性质金属晶体晶体熔融水溶液含有的化学键熔化时克服的力阴、阳离子分子原子金属阳离子、自由电子离子键分子间作用力共价键金属键较大较小很大较高较低很高差别较大差别较大定有离子键,可能有共价键可能有共价键一定只有共价键金属键分子间力共价键√×易溶物:能导电×××××√√离子键金属键不一定\n二、晶体类型的判断1、从组成上判断是否属于“四种原子晶体”?有无阴、阳离子?(有:离子晶体)以上皆否定,则多数是分子晶体。2、从性质上判断:熔沸点和硬度;(高:原子晶体;中:离子晶体;低:分子晶体)一般情况下,分子晶体的熔点在200~300℃以下,离子晶体的熔点在几百至一千多度之间,而原子晶体的熔点通常在1000℃以上。熔融状态的导电性。(导电:离子晶体)3、看构成晶体的粒子及粒子间的相互作用\n2、离子晶体:一般地说,阴阳离子的电荷数越多,离子半径越小,则离子间的作用就越强,其离子晶体的熔、沸点就越高比较离子键的强弱MgO>MgCl2NaCl>CsCl[例题]:MgO和MgCl2;NaCl和CsCl的熔、沸点由高到低三、物质熔、沸点高低比较规律1、不同晶体类型的物质:一般:原子晶体>离子晶体>分子晶体;金属晶体的熔沸点差别较大\nA—组成和结构相似的物质:相对分子质量越大,熔、沸点越高B—氢键使熔、沸点升高如:HI>HBr>HClC—在同分异构体中:一般地说,支链数越多,熔、沸点越低如:H2O>H2S3、分子晶体:如:正戊烷>异戊烷>新戊烷\n4、原子晶体:原子半径越小,晶体的熔、沸点越高金刚石>石英>碳化硅>晶体硅[例题]:金刚石、碳化硅、晶体硅、石英的熔、沸点由高到低的顺序为____________________(5)金属晶体:如熔、沸点:Na