- 1.03 MB
- 2022-08-04 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
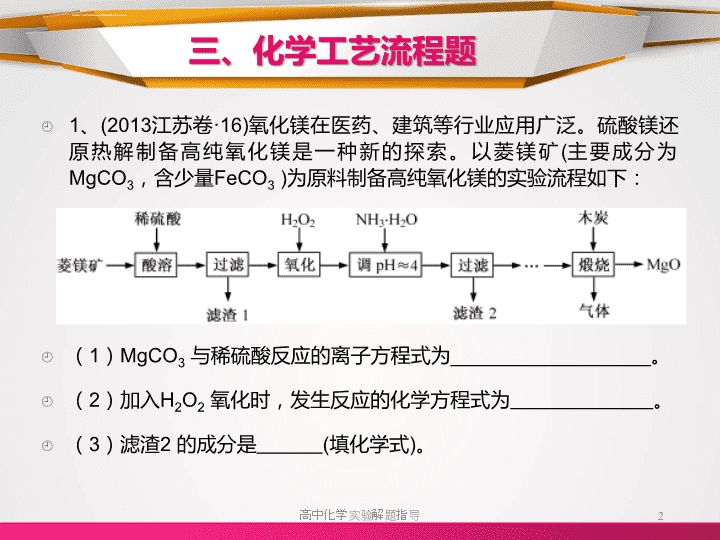
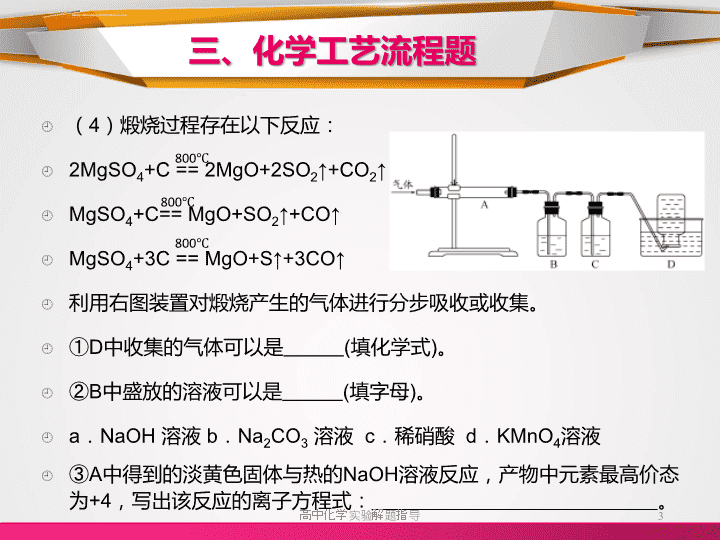
提升巩固练习题三、化学工艺流程题\n三、化学工艺流程题1、(2013江苏卷·16)氧化镁在医药、建筑等行业应用广泛。硫酸镁还原热解制备高纯氧化镁是一种新的探索。以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:(1)MgCO3与稀硫酸反应的离子方程式为__________________。(2)加入H2O2氧化时,发生反应的化学方程式为。(3)滤渣2的成分是(填化学式)。高中化学实验解题指导2\n三、化学工艺流程题(4)煅烧过程存在以下反应:2MgSO4+C==2MgO+2SO2↑+CO2↑MgSO4+C==MgO+SO2↑+CO↑MgSO4+3C==MgO+S↑+3CO↑利用右图装置对煅烧产生的气体进行分步吸收或收集。①D中收集的气体可以是(填化学式)。②B中盛放的溶液可以是(填字母)。a.NaOH溶液b.Na2CO3溶液c.稀硝酸d.KMnO4溶液③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式:。高中化学实验解题指导3800℃800℃800℃\n三、化学工艺流程题[答案](1)MgCO3+2H+===Mg2++CO2+H2O(2)2FeSO4+H2O2+H2SO4===Fe2(SO4)3+2H2O(3)Fe(OH)3(4)①CO②d③3S+6OH-===2S2-+SO32-+3H2O高中化学实验解题指导4∆\n三、化学工艺流程题2、(2013广东卷·32)银铜合金广泛用于航空工业。从切割废料中回收银并制备铜化工产品的工艺如下:(注:Al(OH)3和Cu(OH)2开始分解的温度分别为450℃和80℃)(1)电解精炼银时,阴极反应式为________________________;滤渣A与稀HNO3反应,产生的气体在空气中迅速变为红棕色,该气体变色的化学方程式为____________________________________。(2)固体混合物B的组成为;在生成固体B的过程中,需控制NaOH的加入量,若NaOH过量,则因过量引起的反应的离子方程式_____________________________________________高中化学实验解题指导5\n三、化学工艺流程题(3)完成煅烧过程中一个反应的化学方程式:____CuO+____Al2O3===CuAlO2+_______↑(4)若银铜合金中铜的质量分数为63.5%,理论上5.0kg废料中的铜可完全转化为________molCuAlO2,至少需要1.0mol·L-1的Al2(SO4)3溶液_______L。(5)CuSO4溶液也可用于制备胆矾,其基本操作是、过滤、洗涤和干燥。高中化学实验解题指导6高温\n三、化学工艺流程题[答案](1)Ag++e-=Ag;2NO+O2==2NO2(2)CuO和Al(OH)3;Al(OH)3+OH-=AlO2-+2H2O(3)4CuO+2Al2O3====4CuAlO2+O2↑(4)25(5)蒸发浓缩、冷却结晶高中化学实验解题指导7高温\n三、化学工艺流程题3、(2013全国卷·29)铝是一种应用广泛的金属,工业上用Al2O3和冰晶石(Na3AlF6)混合熔融电解制得。①铝土矿的主要成分是Al2O3和SiO2等。从铝土矿中提炼Al2O3的流程如下:②以萤石(CaF2)和纯碱为原料制备冰晶石的流程如下:高中化学实验解题指导8\n三、化学工艺流程题(1)写出反应1的化学方程式_____________________________;(2)滤液Ⅰ中加入CaO生成的沉淀是__________,反应2的离子方程式为_______________________________________________;(3)E可作为建筑材料,化合物C是________,写出由D制备冰晶石的化学方程式;(4)电解制铝的化学方程式是,以石墨为电极,阳极产生的混合气体的成分是。高中化学实验解题指导9\n三、化学工艺流程题[答案](1)2NaOH+SiO2==Na2SiO3+H2O;2NaOH+Al2O3==2NaAlO2+H2O;(2)CaSiO3;2AlO2-+CO2+3H2O==2Al(OH)3↓+CO32-(3)浓H2SO4;12HF+3Na2CO3+2Al(OH)3==2Na3AlF6+3CO2+9H2O(4)2Al2O3=========4Al+3O2↑;O2,CO2(CO)高中化学实验解题指导10高温通电,Na3AlF6\n三、化学工艺流程题4、(2013新课标1·27)锂离子电池的应用很广,其正极材料可再生利用。某离子电池正极材料有钴酸锂(LiCoO2),导电剂乙炔黑和铝箔等。充电时,该锂离子电池负极发生的反应为6C+xLi++xe-=LixC6。现欲利用以下工艺流程回收正极材料中的某些金属资源(部分条件未给出)。高中化学实验解题指导11\n三、化学工艺流程题(1)LiCoO2中,Co元素的化合价为_________。(2)写出“正极碱浸”中发生反应的离子方程式_____________________________________________________。(3)“酸浸”一般在80℃下进行,写出该步骤中发生的所有氧化还原反应的化学方程式______________________________;可用盐酸代替H2SO4和H2O2的混合液,但缺点是_____________________________________________________。(4)写出“沉钴”过程中发生反应的化学方程式_____________________________________________________。(5)充放电过程中,发生LiCoO2与Li1-xCoO2之间的转化,写出放电时电池反应方程式______________________________________。高中化学实验解题指导12\n三、化学工艺流程题(6)上述工艺中,“放电处理”有利于锂在正极的回收,其原因是_____________________________________。在整个回收工艺中,可回收到的金属化合物有________________________________(填化学式)。高中化学实验解题指导13\n三、化学工艺流程题[答案](1)+3(2)2Al+2OH-+6H2O==2Al(OH)4-+3H2↑(3)2LiCoO2+2H2SO4+H2O2===Li2SO4+2CoSO4+O2+4H2O2H2O2===2H2O+O2↑;Cl-被Co3+氧化,产生污染气体Cl2(4)CoSO4+2NH4HCO3==CoCO3↓+(NH4)2SO4+H2O+CO2↑(5)Li1-xCoO2+LixC6==LiCoO2+6C(6)Li+从负极中脱出,经由电解质向正极移动并进入正极材料中Al(OH)3、CoCO3、Li2SO4高中化学实验解题指导14∆∆\n三、化学工艺流程题5、(2013新课标2·27)氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。纯化工业级氧化锌(含有Fe(Ⅱ),Mn(Ⅱ),Ni(Ⅱ)等杂质)的流程如下:提示:在本实脸条件下,Ni(Ⅱ)不能被氧化:高锰酸钾的还原产物是MnO2(1)反应②中除掉的杂质离子是,发生反应的离子方程式为______________________________________________________加高锰酸钾溶液前,若pH较低,对除杂的影响是________________高中化学实验解题指导15\n三、化学工艺流程题(2)反应③的反应类型为____________,过滤得到的滤渣中,除了过量的锌外还有_______________存在(3)反应④形成的沉淀要用水洗,检验沉淀是否洗涤干净的方法是_____________________________________________________。(4)反应④中产物的成分可能是ZnCO3·xZn(OH)2.取干操后的滤饼11.2g,煅烧后可得到产品8.1g。则x等于_______。高中化学实验解题指导16\n三、化学工艺流程题解析:以工艺流程为形式考察化学知识,涉及反应原理、除杂方法、影响因素、反应类型、产物分析、洗涤干净的检验方法、计算等。(1)Fe2+被MnO4-氧化以Fe(OH)3形式沉淀下来,根据价态规律:Mn2+与MnO4-发生归中反应,以MnO2的形式沉淀下来,因此除去的杂质离子是Fe2+和Mn2+;反应离子方程式为:MnO4-+3Fe2++7H2O===MnO2↓+3Fe(OH)3↓+5H+;3Mn2++2MnO4-+2H2O===5MnO2↓+4H+;在加高锰酸钾溶液前,若pH较低,不会形成Fe(OH)3和MnO2沉淀。(2)上述步骤中,由于Ni2+并未被氧化,因而为除去,由题意可得还原性:Fe2+>Ni2+,则氧化性:Ni2+>Fe2+,因而可发生:Zn+Ni2+==Zn2++Ni,置换反应;还有Ni。(3)洗涤主要是除去SO42-和CO32-离子。检验洗净可检验SO42-离子。取最后一次洗涤液少量,滴入稀盐酸,加入氯化钡溶液,没有白色沉淀生成,证明洗涤干净。(4)令ZnCO3为amol,Zn(OH)2为bmol125a+99b=11.2;81(a+b)=8.1解之,a:b=1:x=1:1,x=1高中化学实验解题指导17\n三、化学工艺流程题[变式]活性氧化锌常用作橡胶制品的硫化活性剂.工业上用粗氧化锌(含少量CuO、FeO、MnO、Fe2O3等)生产活性氧化锌,生产工艺流程如下:高中化学实验解题指导18Fe(OH)2Fe(OH)3Cu(OH)2Zn(OH)2Mn(OH)2开始沉淀的pH7.52.25.26.48.6沉淀完全的pH9.03.26.78.010.1\n三、化学工艺流程题(1)“废渣1”的主要成分是_____________(2)完成“反应器2”中反应之一的离子方程式:____MnO4−+____Mn2++_____===_____MnO2↓+_____(3)蘸取“反应器2”中的溶液点在_____________试纸上,如果观察到试纸变蓝,说明KMnO4过量。(4)“废渣2”分离出的MnO2可用于制取MnO,已知:2MnO2(s)+C(s)==2MnO(s)+CO2(g)∆H=-174.6kJ•mol-1C(s)+CO2(g)==2CO(g)∆H=+283.0kJ•mol-1试写出MnO2(s)与CO(g)反应制取MnO(s)的热化学方程式:_____________________________________________________(5)“反应器3”中加入锌粉的作用是_______________________高中化学实验解题指导19\n三、化学工艺流程题(6)“反应器4”得到的废液中,含有的主要离子除了Na+外,还有__________________(7)从“反应器4”中经过滤等操作得到碱式碳酸锌.取碱式碳酸锌3.41g,在400~450℃下加热至恒重,得到ZnO 2.43g和标准状况下CO20.224L,碱式碳酸锌的化学式为_________________________高中化学实验解题指导20\n三、化学工艺流程题[答案](1)Fe(OH)3(2)2MnO4−+3Mn2++2H2O===5MnO2↓+4H+(3)淀粉碘化钾;(4)MnO2(s)+CO(g)==MnO(s)+CO2(g)∆H=-228.8kJ•molˉ1(5)除去Cu2+(6)K+、SO42-(7)ZnCO3·2Zn(OH)2·H2O或Zn3(OH)4CO3·H2O高中化学实验解题指导21\n三、化学工艺流程题6、(2013浙江卷·28)利用废旧锌铁皮制备磁性Fe3O4胶体粒子及副产物ZnO。制备流程图如下:已知:Zn及化合物的性质与Al及化合物的性质相似。(1)用NaOH溶液处理废旧锌铁皮的作用有。A.去除油污B.溶解镀锌层C.去除铁锈D.钝化(2)调节溶液A的pH可产生Zn(OH)2沉淀,为制得ZnO,后续操作步骤是。高中化学实验解题指导22\n三、化学工艺流程题(3)由溶液B制得Fe3O4胶体粒子的过程中,须持续通入N2,原因是_____________________________________________________。(4)Fe3O4胶体粒子能否用减压过滤发实现固液分离?(填“能”或“不能”),理由是。(5)用重铬酸钾法(一种氧化还原滴定法)可测定产物Fe3O4中的二价铁含量。若需配制浓度为0.01000mol·L-1的K2Cr2O7标准溶液250mL,应准确称取gK2Cr2O7(保留4位有效数字,已知M(K2Cr2O7)=294.0g·mol-1)。配制该标准溶液时,下列仪器中不必要用到的有(用编号表示)①电子天平②烧杯③量筒④玻璃棒⑤容量瓶⑥胶头滴管⑦移液管(6)滴定操作中,如果滴定前装有K2Cr2O7标准溶液的滴定管尖嘴部分有气泡,而滴定结束后气泡消失,则测定结果将(填“偏大”、“偏小”或“不变”)。高中化学实验解题指导23\n三、化学工艺流程题[答案](1)A、B(2)抽滤、洗涤、灼烧(3)N2气氛下,防止Fe2+被氧化(4)不能,胶体粒子太小,抽滤时容易透过滤纸(5)0.7350;③⑦(6)偏大高中化学实验解题指导24\n三、化学工艺流程题7、(2013·安徽理综,27)二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:(1)洗涤滤渣A的目的是为了除去________(填离子符号),检验该离子是否洗净的方法是____________________________。(2)第②步反应的离子方程式是_____________________________,滤渣B的主要成分是________。高中化学实验解题指导25\n三、化学工艺流程题(3)萃取是分离稀土元素的常用方法。已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP________(填“能”或“不能”)与水互溶。实验室进行萃取操作时用到的主要玻璃仪器有________、烧杯、玻璃棒、量筒等。(4)取上述流程中得到的Ce(OH)4产品0.536g,加硫酸溶解后,用0.1000mol·L-1FeSO4标准溶液滴定至终点时(铈被还原为Ce3+),消耗25.00mL标准溶液。该产品中Ce(OH)4的质量分数为_________。高中化学实验解题指导26\n三、化学工艺流程题[答案](1)Fe3+取最后一次洗涤液少许,加入适量KSCN溶液,若不出现红色,则已洗净;反之,未洗净(2)2CeO2+H2O2+6H+===2Ce3++O2↑+4H2OSiO2(其他合理答案均可)(3)不能分液漏斗(4)97%高中化学实验解题指导27\n三、化学工艺流程题1、碳酸锂用途广泛,可用作陶瓷、药物、催化剂,也是常用的锂离子电池的原料。工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:已知:①Li2O·Al2O3·4SiO2+H2SO4(浓)=====Li2SO4+Al2O3·H2O↓+4SiO2高中化学实验解题指导28250~300℃\n三、化学工艺流程题②某些物质的溶解度(S)如下表所示。(1)从滤渣1中分离出Al2O3的部分流程如图Z3-3所示,括号表示加入的试剂,方框表示所得到的物质。则步骤Ⅰ中反应的离子方程式是_______,步骤Ⅱ应通入一种气体试剂为________,步骤Ⅱ反应完之后需要的操作是________。(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。向滤液1中加入石灰乳的作用是(用离子方程式表示)_______。(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是_______________。高中化学实验解题指导29T/℃20406080S(Li2CO3)/g1.331.171.010.85S(Li2SO4)/g34.232.831.930.7\n三、化学工艺流程题(4)工业上,将Li2CO3粗产品制备成高纯Li2CO3的部分工艺如下:a.将Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。b.电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。①a中,阳极的电极反应式是_________。②b中,生成Li2CO3反应的化学方程式是_______。高中化学实验解题指导30\n三、化学工艺流程题[答案](1)Al2O3+6H+===2Al3++3H2ONH3过滤(2)Ca(OH)2+2H+===Ca2++2H2O、Ca(OH)2(s)+Mg2+Mg(OH)2(s)+Ca2+(3)Li2CO3的溶解度随温度升高而减小,热水洗涤可减少Li2CO3的损失(4)①2Cl--2e-===Cl2↑②2LiOH+2NH4HCO3===Li2CO3↓+(NH4)2CO3+2H2O高中化学实验解题指导31\n三、化学工艺流程题2、三氧化二镍是一种重要的电子元件材料、蓄电池材料。工业上利用含镍废料(镍铁钙镁合金为主)制取草酸镍,再高温煅烧草酸镍制取三氧化二镍。已知草酸的钙、镁、镍盐难溶于水。(1)生产过程中多次进行过滤。实验室进行过滤操作中用到玻璃棒,玻璃棒的作用是___________。(2)加入过氧化氢后缓慢加入碳酸钠溶液调pH至4.0~4.5左右,加入碳酸钠溶液的作用是________。再加入NH4F的目的是______。高中化学实验解题指导32\n三、化学工艺流程题(3)草酸镍(NiC2O4·2H2O)在热空气中干燥脱水后在高温下煅烧三小时,制得三氧化二镍,同时获得一种混合气体。写出草酸镍受热分解的化学方程式____________________。(4)工业上还可用电解法制取三氧化二镍。用NaOH溶液调节NiCl2溶液pH至7.5,加入适量硫酸钠后采用惰性电极进行电解。电解过程中产生的Cl2有80%在弱碱性条件下生成ClO-,再把二价镍氧化为三价镍。写出ClO-氧化Ni(OH)2生成三氧化二镍的离子方程式_____________。amol二价镍全部转化为三价镍时,外电路中通过电子的物质的量是________。(5)电解法制取三氧化二镍实际过程中,有时获得一种结晶水合物,已知1mol该物质中含有0.5mol结晶水。取该化合物20.2g进行充分加热,而获得三氧化二镍固体和0.2mol水,则该结晶水合物的化学式为________。高中化学实验解题指导33\n三、化学工艺流程题[答案](1)引流(2)调节pH,促进铁离子水解沉淀完全;除去钙离子、镁离子(3)2NiC2O4====Ni2O3+3CO↑+CO2↑(4)ClO-+2Ni(OH)2===Cl-+Ni2O3+2H2O;1.25amol(5)NiOOH·1/2H2O或2NiOOH·H2O高中化学实验解题指导34高温\n三、化学工艺流程题3、聚合硫酸铁又称聚铁,化学式为[Fe2(OH)n(SO4)3-0.5n]m,广泛用于污水处理。实验室利用硫酸厂烧渣(主要成分为铁的氧化物及少量FeS、SiO2等)制备聚铁和绿矾(FeSO4·7H2O)过程如下:(1)验证固体W焙烧后产生的气体含有SO2的方法是___________。(2)制备绿矾时,向溶液X中加入过量________,充分反应后,经________操作得到溶液Y,再经浓缩,结晶等步骤得到绿矾。高中化学实验解题指导35\n三、化学工艺流程题(3)溶液Z的pH影响聚铁中铁的质量分数,用pH试纸测定溶液pH的操作方法为__________。若溶液Z的pH偏小,将导致聚铁中铁的质量分数偏______。(4)古代将绿矾煅烧可制绿矾油(也叫镪水,即硫酸)和红色颜料(Fe2O3),请写出有关的化学方程式:_________。(5)绿矾还可用以下方法生产红色颜料(Fe2O3),其具体操作流程是:将5560kg绿矾(摩尔质量为278g/mol)溶于水中,加入适量氢氧化钠溶液恰好完全反应,鼓入足量空气搅拌,产生红褐色胶体;再向红褐色胶体中加入16680kg绿矾和560kg铁粉,鼓入足量空气搅拌,反应完成后,有大量Fe2O3附着在胶体粒子上以沉淀形式析出;过滤后,沉淀经高温灼烧得红色颜料。若所得滤液中溶质只有硫酸钠和硫酸铁,则理论上可生产红色颜料________kg。高中化学实验解题指导36\n三、化学工艺流程题[答案](1)将气体通入品红溶液中,如品红褪色,加热后又变红,说明有二氧化硫(2)铁粉;过滤(3)将试纸放到表面皿上,用玻璃棒蘸取溶液,点到试纸的中央,然后与标准比色卡对比;低(4)2FeSO4·7H2O====Fe2O3+SO2↑+SO3↑+14H2OSO3+H2O===H2SO4(5)4000高中化学实验解题指导37∆\n三、化学工艺流程题4、氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗食盐水(含Ca2+、Mg2+、SO42-等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:高中化学实验解题指导38\n三、化学工艺流程题(1)反应Ⅰ中加Na2CO3溶液的作用是__________。(2)反应Ⅲ在电解条件下进行,电解时阳极发生的电极反应可表示为_______。(3)①写出反应Ⅴ的化学方程式______。②写出反应Ⅵ的离子反应方程式_____。(4)在整个合成过程中可以循环利用的物质是________。(5)反应Ⅳ加入的Cu必须过量,其目的是_____。(6)反应Ⅵ后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是_____。高中化学实验解题指导39\n三、化学工艺流程题[答案](1)除去Ca2+和过量的Ba2+(2)2Cl--2e-==Cl2↑(3)①2Cu+O2+2H2SO4===2CuSO4+2H2O②2CuSO4+2NaCl+SO2+2H2O===2CuCl↓+2NaHSO4+H2SO4或2CuSO4+2NaCl+SO2+2H2O===2CuCl↓+Na2SO4+2H2SO4(4)H2SO4、NaOH(5)防止生成CuCl2(6)加快乙醇和水的蒸发,防止CuCl被空气氧化高中化学实验解题指导40\n三、化学工艺流程题5、硫酸工业中废渣称为硫酸渣,其成分为SiO2、Fe2O3、Al2O3、MgO。某探究性学习小组的同学设计以下方案,进行硫酸渣中金属元素的提取实验。已知溶液pH=3.7时,Fe3+已经沉淀完全;一水合氨电离常数Kb=1.8×10-5,其饱和溶液中c(OH-)约为1×10-3mol·L-1。请回答:高中化学实验解题指导41\n三、化学工艺流程题(1)写出A与氢氧化钠溶液反应的化学方程式:________。(2)上述流程中两次使用试剂①,推测试剂①应该是________(填以下字母编号)。A.氢氧化钠B.氧化铝C.氨水D.水(3)溶液D到固体E过程中需要控制溶液pH=13,如果pH过小,可能导致的后果是_____________________;(任写一点)(4)H中溶质的化学式:________;(5)计算溶液F中c(Mg2+)=________(25℃时,Ksp[Mg(OH)2]=5.6×10-12)。高中化学实验解题指导42\n三、化学工艺流程题[答案](1)SiO2+2NaOH===Na2SiO3+H2O(2)A(3)镁离子沉淀不完全或氢氧化铝溶解不完全等(4)NaHCO3(5)5.6×10-10mol/L高中化学实验解题指导43\n三、化学工艺流程题6、磷矿石的主要成分是Ca5F(PO4)3,含少量MgO、Fe2O3等杂质。工业上以磷矿石为原料制备H3PO4的常用流程如下:已知:Ca5F(PO4)3+7H3PO4→5Ca(H2PO4)2+HF(1)采用这种方法在实验室溶解磷矿石________(填“能”或“不能”)用玻璃仪器,原因是________________________________。高中化学实验解题指导44\n三、化学工艺流程题(2)操作Ⅰ的名称是________。(3)在实验室中实现操作Ⅱ和Ⅲ所需要的玻璃仪器有________,推测该萃取剂一定具有的性质是________。a.该萃取剂与水互不相溶b.相同条件下,该萃取剂的密度比水小c.磷酸在该萃取剂中的溶解度很小d.某些磷酸二氢盐在该萃取剂中的溶解度很小(4)采用该流程除制取磷酸外,还有_________________等副产品产生,请说出其中一种副产品的用途______________________。(5)与直接用硫酸溶解磷矿石的工艺相比,该工艺的优点是_____。高中化学实验解题指导45\n三、化学工艺流程题[答案](1)不能;HF会腐蚀玻璃(2)过滤(3)分液漏斗、烧杯;a、d(4)氟化氢、石膏(用途略,只要答出氟化氢或氢氟酸或石膏的任一用途均可)(5)磷矿石更易溶解高中化学实验解题指导46\n三、化学工艺流程题7、过氧化氢(H2O2)有广泛的用途。工业上用电解硫酸氢铵水溶液的方法制备过氧化氢,其反应原理是2NH4HSO4===(NH4)2S2O8+H2↑,(NH4)2S2O8+2H2O===2NH4HSO4+H2O2。其流程如下:回答下列问题:(1)根据以上反应原理可知,电解硫酸氢铵溶液时,阴极的电极反应方程式是________________________________________。高中化学实验解题指导47高温\n三、化学工艺流程题(2)在上流程图中,采用减压蒸馏的原因是____________________。可循环利用的物质是________。(3)过氧化氢具有的化学性质是______________。A.不稳定性B.弱碱性C.氧化性D.还原性(4)硫酸铜溶液中混有少量硫酸亚铁。在除去杂质的过程中,使用过氧化氢时反应的离子方程式是_______________________________。(5)在硫酸的存在下,用过氧化氢与乙酸作用制备过氧乙酸(CH3COOOH)的化学方程式是_____________________________。高中化学实验解题指导48\n三、化学工艺流程题[答案](1)2H++2e-===H2↑(2)过氧化氢不稳定,受热容易分解,减小气压,使液体沸点降低;NH4HSO4或残液(3)ACD(4)2Fe2++H2O2+2H+===2Fe3++2H2O(5)CH3COOH+H2O2CH3COOOH+H2O高中化学实验解题指导49H2SO4\n三、化学工艺流程题8、电镀含铬废水的处理方法较多。Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用,通常采用如下流程处理:高中化学实验解题指导50\n三、化学工艺流程题已知:a.Cr(OH)3→NaCrO2→Na2CrO4→Na2Cr2O7b.Cu(OH)2能溶于氨水:Cu(OH)2+4NH3·H2O===[Cu(NH3)4]2++2OH-+4H2O(1)操作Ⅰ的名称为________,上述操作Ⅰ、Ⅱ、Ⅲ相同,进行该实验操作所需要的主要玻璃仪器除烧杯、漏斗外,还有________。(2)滤渣Ⅰ的主要成分为________(写化学式),试剂乙的名称为__________。(3)加入试剂甲的目的是__________________________________。(4)废水处理流程中生成滤渣Ⅲ的离子方程式为________________。高中化学实验解题指导51\n三、化学工艺流程题Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在。工业上用以下方法处理含Cr2O72-的废水:①往废水中加入适量的NaCl,搅拌均匀;②用Fe为电极进行电解,经过一段时间,最后有Cr(OH)3和Fe(OH)3沉淀产生;③过滤回收沉淀,废水达到排放标准。(5)电解时能否用Cu电极来代替Fe电极________(填“能”或“不能”),理由是___________________________________。(6)已知某含Cr2O72-的酸性工业废水中铬元素的含量为104.5mg·L-1,处理后铬元素最高允许排放浓度为0.5mg·L-1。处理该废水1000m3并达到排放标准至少消耗铁的质量为________kg。高中化学实验解题指导52\n三、化学工艺流程题[答案](1)过滤;玻璃棒(2)Cu(OH)2、Fe(OH)3;氨水(3)将Fe2+氧化成Fe3+(4)AlO2-+CO2+2H2O===Al(OH)3↓+HCO3-(5)不能;因阳极产生的Cu2+不能还原Cr2O72-(6)336高中化学实验解题指导53\n三、化学工艺流程题9、绿矾(FeSO4·7H2O)是治疗缺铁性贫血药品的重要成分。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:查询资料,有关物质的数据如右表:高中化学实验解题指导5425℃时pH值饱和H2S溶液3.9SnS沉淀完全1.6FeS开始沉淀3.0FeS沉淀完全5.5\n三、化学工艺流程题(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为________。A.KSCN溶液B.NaOH溶液C.KMnO4溶液D.苯酚溶液(2)操作Ⅱ中,通入硫化氢至饱和的目的是____________;在溶液中用硫酸酸化至pH=2的目的是_____________________________。(3)操作Ⅳ的顺序依次为____________、冷却结晶、___________。(4)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②_________________________________。高中化学实验解题指导55\n三、化学工艺流程题(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.850g绿矾产品,溶解,在250mL容量瓶中定容;b.量取25.00mL待测溶液于锥形瓶中;c.用硫酸酸化的0.01000mol·L-1KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00mL。①滴定时盛放KMnO4溶液的仪器为________(填仪器名称)。②判断此滴定实验达到终点的方法是____________________。③计算上述样品中FeSO4·7H2O的质量分数为____________。高中化学实验解题指导56\n三、化学工艺流程题[答案](1)AD(2)除去溶液中的Sn2+,并防止Fe2+被氧化;防止Fe2+生成沉淀(3)蒸发浓缩;过滤洗涤(4)降低洗涤过程中FeSO4·7H2O的损耗(5)①酸式滴定管②滴加最后一滴KMnO4溶液时,溶液变成浅红色且半分钟内不褪色③97.5%高中化学实验解题指导57\n三、化学工艺流程题10、KNO3是重要的化工产品,下面是一种已获得专利的KNO3制备方法的主要步骤:高中化学实验解题指导58\n三、化学工艺流程题(1)反应Ⅰ中,CaSO4与NH4HCO3的物质的量之比为1∶2,该反应的化学方程式为__________________________________________。(2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是___________;从反应Ⅳ所得混合物中分离出CaSO4的方法是趁热过滤,趁热过滤的目的是_____________________________________________。(3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法是:取少量K2SO4样品溶解于水,_____________________________________。(4)整个流程中,可循环利用的物质有________(填化学式)。(5)将硝酸与浓KCl溶液混合,也可得到KNO3,同时生成等体积的气体A和气体B(NOCl),该反应的化学方程式为_________________;气体B与O2反应生成1体积气体A和2体积红棕色气体C,该反应的化学方程式为_______________________________________________。高中化学实验解题指导59\n三、化学工艺流程题[答案](1)CaSO4+2NH4HCO3===CaCO3↓+(NH4)2SO4+H2O+CO2↑(2)分离NH4Cl与K2SO4,加快化学反应速率;防止KNO3结晶,提高KNO3的产率(3)加入过量Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液中滴加AgNO3溶液,若有沉淀生成,说明K2SO4中混有KCl(4)CaSO4、KNO3、(NH4)2SO4(5)4HNO3+3KCl(浓)===NOCl↑+Cl2↑+3KNO3+2H2O2NOCl+O2===Cl2+2NO2高中化学实验解题指导60\n三、化学工艺流程题11、亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O;②纯ClO2易分解爆炸,一般用稀有气体或空气将其稀释到体积分数为10%以下较安全;③HClO2可看成是强酸。高中化学实验解题指导61\n三、化学工艺流程题(1)160g·L-1NaOH溶液的物质的量浓度为_________,若要计算该溶液溶质的质量分数,还需要的一个条件是______________(用文字说明)。(2)在发生器中鼓入空气的作用可能是________(填序号)。A.将SO2氧化成SO3,增强酸性B.稀释ClO2以防止爆炸C.将NaClO3还原成ClO2(3)吸收塔内发生反应的化学方程式为___________________,吸收塔的温度不能超过20℃,其目的是防止H2O2分解,写出H2O2发生分解的化学方程式:______________________________________。高中化学实验解题指导62\n三、化学工艺流程题(4)在碱性溶液中NaClO2比较稳定,吸收塔中应使NaOH稍过量,判断NaOH是否过量的简单的实验方法是__________________。(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是______(填序号)。A.Na2O2B.Na2SC.FeCl2D.PbO悬浊液(6)从滤液中得到NaClO2·3H2O粗晶体的实验操作依次是________(填序号)。A.蒸馏B.蒸发C.灼烧D.过滤E.冷却结晶要得到更纯的NaClO2·3H2O晶体必须进行的操作是____________(填操作名称)。高中化学实验解题指导63\n三、化学工艺流程题[答案](1)4mol·L-1;该溶液的密度(2)B(3)2NaOH+2ClO2+H2O2===2NaClO2+2H2O+O22H2O2====2H2O+O2↑(4)连续测定吸收塔内溶液的pH(5)AD(6)BED或ED;重结晶高中化学实验解题指导64∆\n三、化学工艺流程题12、某地有软锰矿和闪锌矿两座矿山,它们的组成如下:软锰矿:MnO2含量≥65%,SiO2含量约20%,Al2O3含量约4%,其余为水分;闪锌矿:ZnS含量≥80%,FeS、CuS、SiO2含量约7%,其余为水分。科研人员开发了综合利用这两种资源的同槽酸浸工艺,工艺流程如下图所示。高中化学实验解题指导65\n三、化学工艺流程题(1)反应Ⅰ的滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、Al2(SO4)3等。试完成反应Ⅰ中生成CuSO4和MnSO4的化学方程式:MnO2+CuS+_____===_____↓+_____+CuSO4+_____(2)反应Ⅱ加入适量锌的作用是______________;如果锌过量,还会进一步发生反应的离子方程式为___________________________。(3)反应Ⅲ要调节pH生成Fe(OH)3、Al(OH)3,中和过量的H+所使用的物质是________,调节的pH范围是____________(pH数据见下表)。(4)本工艺可以循环利用的物质有ZnCO3、、MnCO3和____________高中化学实验解题指导66沉淀物Fe(OH)3Al(OH)3Zn(OH)2开始沉淀pH2.34.05.4完全沉淀pH4.15.28.0\n三、化学工艺流程题[答案](1)MnO2+CuS+2H2SO4===S↓+MnSO4+CuSO4+2H2O(2)将溶液中的硫酸铜转化为铜;Zn+Fe2+===Fe+Zn2+(3)MnCO3、ZnCO3;5.2~5.4(4)MnO2高中化学实验解题指导67