- 8.79 MB
- 2022-08-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
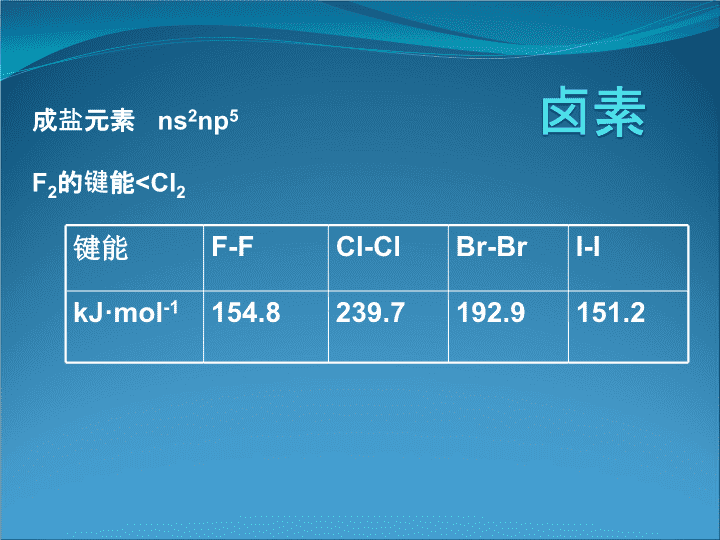
高中化学竞赛辅导全套课件按章节编排\n卤素成盐元素ns2np5F2的键能Cl的原因!以上说明:虽然Cl的电子亲和势>F,但F2的键能原子F的活泼性的活泼性仍>Cl2问题:与H相比较,Cl、Br、I的I1\nH的I1如何计算?13.6x1.602x10-19x6.022x1023=1312KJ∙mol-1>Cl、Br、I的I1为什么没有Cl+、Br+、I+呢?回答:H+为全空,Cl+、Br+、I+为nS2nP4不稳定。卤素的成键特征:有配位能力AgCl+Cl-=[AgCl2]-共价键\n1.1单质存在:卤素因其活泼性,不以单质存在F:CaF2(莹石)Na3AlF6(冰晶石)Ca5F(PO4)3氟磷硅石(磷灰石)Cl:NaCl海水3%约20g·L-1,岩盐、井盐、盐湖Br:矿水I:海带,海藻类,智利硝石其主要为NaNO3(NaIO3)碘易升华,为什么?\n1.1.2颜色物理性质(σnp)2(πnp)4(πnp*)4→(σnp)2(πnp)4(πnp*)3(σnp*)1\n1.1.3化学性质(投影)1.1.3.1与非金属作用,Fe,Hg
1.1.3.2非金属H,S,P
1.1.3.3水,碱\n1.2卤素的制备和用途1.2.1F21.2.1.1制备1.2.1.1.1电解\n1.2.1.1.1电解HF+KF=KHF2氟氢化钾KF高熔点,KHF2低熔点2KHF2=2KF+H2+F2↑为减少①HF挥发②极化作用,加入LiF和AlF3\n1.2.1.1.2化学方法4KMnO4+4KF+20HF=4K2MnF6+10H2O+3O2SbCl5+5HF=SbF5+5HCl2K2MnF6+4SbF5=4KSbF6+2MnF3+F2↑解释:K2MnF6看成MnF4·2KF而和SbF5生成SbF5·KF和MnF4=MnF3+½F2φoMnO4-/Mn2+=1.51v,φoF2/F-=2.87v\n1.2.1.2用途F2+UO2→UF4→UF6238U235U234U的分离n\nN2H4(l)+2F2→N2(g)+4HF(g)4000K火箭材料灭鼠药CH2FCOONH4水解后产生CH2FCOOH(氟代乙酸铵)\n1.2.2Cl21.2.2.1制备MnO2+4HCl=MnCl2+2H2O+Cl2↑2KMnO4+16HCl=2KCl+2MnCl2+8H2O+5Cl2↑电解:2NaCl+2H2O=2NaOH+H2↑+Cl2↑\n1.2.3Br2和I2(Ⅰ)海水→盐卤→Br2以空气吹出Br-+BrO3-→Br210吨海水0.14KgBr2(Ⅱ)Br2还可以电解NaCl水中的母液中提取2NaBr+3H2SO4+MnO2=2NaHSO4+MnSO4+2H2O+Br22NaI+3H2SO4+MnO2=2NaHSO4+MnSO4+2H2O+I2(此反应可用于从海藻中提取I2)\n工业上从NaIO3提取I22IO3-+5HSO3¯=5SO42-+H2O+3H++I2\n1.3HX1.3.1制备1.3.1.1直接合成(仅)H2+Cl2=2HCl1.3.1.2复分解反应CaF2+H2SO4=CaSO4+2HFSiO2+4HF=2H2O+SiF4↑SiF4+2HF=H2SiF6如何在玻璃容器上刻字?有人写不出来,怎么办?\n(实)NaCl+H2SO4(浓)=NaHSO4+HCl↑NaCl+H2SO4(浓)=Na2SO4+HCl↑而,NaBr+H2SO4(浓)=NaHSO4+HBr↑NaI+H2SO4(浓)=NaHSO4+HI↑2HBr+H2SO4(浓)=SO2↑+2H2O+Br28HI+H2SO4(浓)=H2S↑+4H2O+4I2另外:NaBr+H3PO4=NaH2PO4+HBr↑NaI+H3PO4=NaH2PO4+HI↑\n1.3.1.3卤化物的水解PBr3+3H2O=H3PO3+3HBrPI3+3H2O=H3PO3+3HI或2P+6H2O+3Br2=2H3PO3+6HBr↑2P+6H2O+3I2=2H3PO3+6HI↑\n1.3.1.4烃的卤化C2H6(g)+Cl2(g)=C2H5Cl(l)+HCl(g)1.3.1.5其它Br2+H2S=2HBr+SBr2+SO2+2H2O=2HBr+H2SO4I2+H2SO3+H2O=2HI+H2SO4\n1.3.2性质1.3.2.12HF=H2F++F-K=10-10液态HF和液NH3一样为一种非水溶剂稀:HF+H2O=H3O++F-K=7.4×10-4HF+F-=HF2-K=5浓:H2F2+H2O=H3O++HF2-求它的平衡常数\n1.3.2.2恒沸溶液HCl的浓度和沸点的关系图将HCl溶液加热到沸点后它会变化,其中如:NaCl溶液,则水蒸发,NaCl溶液变浓,最后析出NaCl如溶液,溶剂都可挥发,则一种挥发的快,一种慢,即和这个溶液平衡时的气相组成不同,对于我们这种情况,气相中HCl多一些,则溶液变样而对于浓度<20%的HCl,则相反,溶液变浓,最终得到20.24%的恒沸液\n1.4卤化物卤素互化物多卤化物1.4卤化物卤素和电负性小的元素生成的化合物叫做卤化物——区分氧化物一,F、Cl、Br、I的卤化物按顺序从高价到低价稳定\n卤化物的熔点沸点体现了键型的过渡NaClMgCl2AlCl3SiCl4PCl3S2Cl2熔点1074987465205181193沸点16861691453216349411\n问题:1,列举实例说明氟稳定元素的高氧化态,碘稳定元素的低氧化态。并分析其原因。并分析原因。2,离子型卤化物和共价型卤化物各有那些特征?3,举例说明低氧化态卤化物离子型高氧化态卤化物共价型\n1.4.2卤素互化物卤素互化物有XX´XX´3XX´5XX´7四种,卤素的种类不超过2种X2+X´2XX´XX´3XX´5XX´7例:Cl2+F2=2ClFCl2+3F2=2ClF3它们为分子晶体,熔沸点低,熔沸点随电负性差的增大而增大,其中n和电负性差以及半径比有关\n故XX´型有6种=C42XX´7型有1种IF7XX´5型有3种IF5BrF5ClF5三种XX´3型有5种IF3BrF3ClF3ICl3IBr3问题:用VSEPR解释IFIF3IF5IF7的结构,并说明。反应:水解XX`+H2O=H++X´¯+HXO3BrF3+5H2O=H++BrO3¯+Br2+9HF+O2IF5+3H2O=H++IO3¯+5HF\n卤化物水解的一般规律:氟化剂:2MO+2BrF3=2MnF2+Br2+O2+F2价键理论:XX`不杂化XX`3sp3dXX`3sp3d2XX`7sp3d3IF5+5HOHI(OH)5+5HFδ+δ-δ+δ-\n1.4.3多卤化物金属卤化物+卤素互化物多卤化物如:I2+I¯I3¯K=730问题:为什么多卤化物以I的为多,F的最少?因为多卤化物形成的条件是分子的极化能大于卤化物的晶格能。I2的极化率高,晶格能低,氟化物晶格能高,极化率低,不易形成多卤化物\n(kJ·mol-1)k=1071一般r较大的IA,ⅡA金属易形成多卤化物多卤化物的分解CsICl2=CsCl+ICl×CsI+Cl2\n1.4.4类卤化合物(拟卤素)(CN)2(OCN)2(SCN)2(SeCN)2N3¯\n1.4.4.1性质和卤素一样皆为二聚体,但不稳定成为多聚体x(SCN)2=2(SCN)xx(CN)2=2(CN)x与金属反应2Fe+3(SCN)2=2Fe(SCN)32Fe+3Cl2=2FeCl3与H2反应,但酸性很弱H2+(CN)2=2HCNH2+Cl2=2HCl\n生成配合物,配位能力较卤素强[Cu(CN)4]3-[HgCl4]2-氧化F2(OCN)2Cl2Br2(CN)2(SCN)2I2(SeCN)2歧化反应和卤素一样
如:(CN)2+2OH¯=CN¯+OCN¯+H2O\n1.4.4.2(CN)2及其化合物AgCN+CN¯=[Ag(CN)2]¯CN¯有极强的配位能力,可使一些不溶于水的氰化物溶于KCN中4Au+8NaCN+2H2O+O2=4Na[Au(CN)2]+4NaOH氰化物的处理Fe2++6CN-=[Fe(CN)6]4-CN¯+2OH¯+Cl2=OCN¯+2Cl¯+H2O2OCN¯+4OH¯+3Cl2=2CO2+N2+6Cl¯+2H2O\n1.4.4.3硫氰及其化合物黄色油状液体易聚合KCN+S=KSCNFe3++SCN¯=Fe(SCN)2+\n1.5卤素含氧化合物1.5.1氧化物Cl、Br、I氧化物F氟化物Cl、Br、I氧化物中以Br的氧化物最不稳定,同样,也是Br的含氧酸氧化能力最强——3d10——第四周期的不规则性惰性电子对效应\n1.5.1.1OF2及X2O2F2+2NaOH(2%)=2NaF+OF2+H2OCl2+HgO=HgCl2·HgO+Cl2O\n1.5.1.2ClO21.5.1.2.1制备2NaClO3+2H2C2O42ClO2+2CO2+Na2C2O2+2H2O(工)2NaClO4+SO2+H2SO42ClO2+2NaHSO42NaClO3+SO2=NaSO4+ClO2KClO3+H2SO4KClO4+KHSO4+ClO2+H2O90oC痕NaCl爆炸\n1.5.1.2.2性质:杀菌、漂白、净化水比84消毒液要好2ClO2+2OH-=ClO3-+ClO2-+H2O其分解产物中无Cl2故无害\n1.5.1.2.3结构奇电子数分子,有未成对电子,化学性质比较活泼,最新研究表明,其中含有Π35键。\n1.5.1.3I2O5固体、稳定性最高2HIO3=I2O5+H2OI2O5+5CO=I2+5CO2可以制I2定量检测CO结构:\n1.5.2含氧酸及其盐基本种类为HOXHXO2HXO3HXO4不同价态的含氧酸的命名:F只有HOF而且不稳定,I无HIO2能提出纯物质的只有HClO4HIO3HIO4H5IO6它们采取什么形式杂化,sp3sp3d2HBrO4HBrO3HBrO2HBrO高正亚次\n空间构型ClOHClOOOOHSOFOOH\n1.5.2.1次卤酸及其盐酸HClOHBrOHIOKa2.98×10-82.06×10-92.3×10-111.5.2.1.1由此可知酸性极弱,盐可水解成碱性中心原子电负性升高,酸性增强。\n制备方法F2+H2O=HOF+HF回忆F2和水的反应→HF+O2↑→HF+OF2↑X2+H2O→HOX+HX为提高转化率,则加入OH-特别:Cl2+H2O+HgO=HgO·HgCl2↓+HOClCl2+H2O+CaCO3=CaCl2+CO2+HOCl\n基本性质HOCl——HOI稳定性上升2HOCl=2HCl+O2↑HClO=HCl+HClO3[但不稳定]HClO3——HClO2——HClO——Cl2—Cl-BrO3-——HBrO——Br2——Br-由于HClO——Cl1.55V>1.229VHBrO—Br-1.33V>1.229V不足以克服过电位\nHBrO——Br21.6V>1.229V,可以4HBrO=2Br2+O2+2H2O5HBrO=HBrO3+2Br2+2H2O\n对于歧化反应,X2+NaOHNaXO+NaX(1)X2+NaOHNaXO3+NaX(2)对Cl,室温(1),高温(2)对Br,室温(2),低温(1)对I,只有(2)故I2+OH-=?\n1.5.2.1.2盐MClO电解无隔膜,稀NaCl溶液2Cl-+2H2O=2OH-+Cl2↑+H2↑Cl2+2OH-=Cl-+ClO-+H2O总:Cl-+H2O=ClO-+H2↑漂白粉:Ca(ClO)2+CaCl2①加酸生成什么?②为什么时间一长会失效?问题:实验室如何制备①漂白粉②KBrO③KClO3④KIO3\n1.5.2.2亚卤酸及其盐1.5.2.2.1制备亚溴酸仅见报道Ba(ClO)2+H2SO4→2HClO2+BaSO42ClO2+2OH-=ClO2-+ClO3-+H2O1.5.2.2.2性质Ka=10-2比HClO酸性强4HClO2=2H2O+3ClO2+Cl21.5.2.2.3盐Na2O2+ClO2=2NaClO2+O2NaClO2NaClO3+NaClΔ\n1.5.2.3卤酸及其盐1.5.2.3.1制备实验室方法Ba(ClO3)2+H2SO4=2HClO3+BaSO4Ba(BrO3)2+H2SO4=HBrO3+BaSO4注意:Ba(ClO3)2+2H2SO4=2HClO3+Ba(HSO4)2溶解于水,我们有一个实验H2SO4+BaSO4=Ba(HSO4)2HXO3制备时,应减压分馏,到HClO340%HBrO350%8HClO3=4HClO4+2Cl2+3O2+2H2O\n工业方法电解食盐水(盐,去隔膜)通电NaCl+3H2O=NaClO3+3H2NaClO3+KCl=KClO3+NaCl另外:5Cl2+Br2+6H2O=HBrO3+10HCl5Cl2+I2+6H2O=HIO3+10HCl3I2+6NaOH=NaIO3+5NaI+3H2OI2+10HNO3=2HIO3+10NO2+4H2OI2O5+H2O=2HIO3\n1.5.2.3.2性质氧化性电对BrO3-/Br2ClO3-/Cl2IO3-/I2φo1.521.471.192BrO3-+I2=2IO3-+Br22ClO3-+I2=2IO3-+Cl22BrO3-+Cl2=2ClO3-+Br2分解:4KClO3=3KClO4+KCl2KClO3=2KCl+3O2↑但不可以4KBrO3=3KBrO4+KBr\n1.5.2.4高卤酸及其盐1.5.2.4.1制备电解:通电KClO3+H2O=KClO4+H2↑通电ClO3-+H2O=ClO4-+2H++2e真空蒸馏可达纯HClO4或者KClO4+H2SO4=KHSO4+HClO4这是弱酸制强酸或者电解盐酸法Cl-+4H2O=ClO4-+8H++8e\n1.5.2.4.2性质1.K+、NH4+、Rb+、Cs+的ClO4¯一些溶解性极差,制备方法2.φoBrO4-/BrO3-=1.79V故不可制得BrO4-BrO3¯+F2+2OH-=BrO4¯+2F-+H2OBrO3-+XeF2+H2O=BrO4-+Xe+2HF1968年才制得KBrO4。3.氧化性,随浓度变化Nernst方程,浓度大时,反极化作用上升。\nClO4-+Zn,SO2,H2O2不反应ClO3-+Zn,SO2,H2O2反应从电极电势图ClO4-——ClO3¯——½Cl2说明ClO3¯应歧化,但由于动力学位阻,不发生歧化反应3.氧化性,随浓度变化Nernst方程,浓度大时,反极化作用上升。\n1.5.2.4.3HIO4H5IO6制备:2H5IO6=2HIO3+O2+4H2OH5IO6=HIO4+2H2O问题:H5IO6的结构是什么?为什么没有H5ClO6和H5BrO6回答:sp3d2,原子半径\n制备IO3-Na3H3IO6↓Ag5IO6↓AgCl↓+H5IO6(无色晶体)HNO3+Ba5(IO6)2=5Ba(NO3)2+2H5IO6↓2H5IO62HIO42HIO3+O2Cl2ClAgNO3373K413K\n水中以H5IO6存在HIO4+2H2OH5IO6H++H4IO6¯K=2×10-2性质Mn2++IO4-IO3-+MnO4-HNO3\n1.5.3卤素含氧酸及盐的性质递变规律1.5.3.1在酸性介质中氧化性升高MnO4-+8H++5eMn2++4H2OφMnO4-/Mn2+=φoMnO4-/Mn2+-0.05916/5log[Mn2+]/[MnO4-][H+]8\n1.5.3.2氧化性HClO2>HClO>HClO3>HClO41.5.3.3含氧酸的酸性,非羟基氧的数目HClO4>HClO3>HClO2>HClO\n氧族元素基本性质(ns2np4化合价活泼性键能半径电负性)和活泼金属生成离子化合物,Na2O电负性比卤素小,半径比卤素大氧化态O-2
S-20+2+4+6(Se,Te)键能从上到下下降
但O—O7.2,所以不可能,因此双水解\n同理Fe2S3+H2O=2Fe3++3S2-=Fe2S3主反应2Fe3++3S2-=2FeS+S2Fe3++3S2-+6H2O=2Fe(OH)3+3H2S而2CaS+2H2O=Ca(OH)2+Ca(HS)2Ca(OH)2微溶,pH=12左右Ca(HS)2为pH=11.1则可以\nAl2S3+6H2O=2Al(OH)3↓+3H2S↑6H++3S2-=3H2S(5.7×10-8×1.2×10-15)-32Al3++6OH-=2Al(OH)3(10-36)-26H2O=6H++6OH¯(10-14)6K=3.12×1054问题:S2的结构是什么?如何验证?
气态S2迅速冷到-196oC(液N2)得到紫色顺磁固体,S2核间距188.9pm<205pm\n3.4.2.1硫化物和多硫化物3.4.2.1.1硫化物与氧化物相比,硫化物碱性小,其他变化规律相同。同周期从左到右酸性升高同族从上到下,酸性降低同元素,高价酸性>低价H2SNaSHNa2SAs2S3As2S5Na2S2H2ONaOHNa2OAs2O3As2O5Na2O2还酸性氧化性\n3.4.2.1.2H2S体系Al2S3+6H2O=2Al(OH)3+3H2SNa2S和(NH4)2S水解度pH[S2-]0.1mol·L-1Na2S94%136×10-3(NH4)2S100%9.262.1×10-7\n储存:棕色瓶中2S2-+O2+2H2O=2S+4OH-问题:Na2S溶液长期放于空气中,会产生什么变化?S2-+xS=SX+12-如何计算Na2S和(NH4)2S的pH值。a,S2-+H2O=HS-+OH-c-xxx\nx=0.098828pH=13.00
b,S2-+NH4+=HS-+NH3
11
pH=pKa-lg1=9.24895难溶硫化物的特点:1,金属最难溶的盐一般为硫化物2,Ksp相差大。\n酸性不稳定,碱性稳定类似于H2O2O和S相比,哪个更易形成单键?S故有Sx2-Sx2-+2H+=H2S+(x-1)SNa2S2+SnS=SnS2+Na2S(氧化性)Na2S2+PbS=PbS2+Na2S×Na2S2+As2S3=As2S5+Na2S(氧化性)Na2S2+Sb2S3=Sb2S5+Na2S(氧化性)Na2S2+Bi2S3=Bi2S5+Na2S×3.4.2.1.3多硫化物\n3.5含氧化合物SO2和SO3为最重要的氧化物SO2、H2SO3和盐2ZnS+3O2=2ZnO+2SO2Π34为sp2杂化主要体现在还原性SO2H2SO4orSO42-作为酸:2HSO3-+CO32-=2SO32-+H2O+CO2↑还原剂:KIO3+SO2=KI+SO42-Br2+SO2=Br-+SO42-歧化4Na2SO3=3Na2SO4+Na2S\n3.5.2SO3,H2SO4及盐3.5.2.1结构SOOOSO3为sp2杂化π46\nH2SO4分子中,所有S–O键的键长和O–S–O键角不相等,而SO42-为对称性很高的Td群水合能HClHBrHNO3H2SO4kJ·mol-1-74.9-85.1-33.3-878.6所以硫酸溶解于水放热多a,水加到浓硫酸中是否可以?b,硫酸溶解于水放热,6mol·L-1稀释放热?\n3.5.2.3酸式盐a,Ka2=10-2故硫酸第二步电离为弱酸含氧酸性顺序HOSO2F>HI>HBr>HClO4>HCl≈HNO3≈H2SO4b,NaHSO4=Na2S2O7+H2O而焦硫酸溶解于水即水解\n3.5.2.3水合物和复盐a,水合物CuSO4·5H2OCaSO4·2H2O
MSO4·7H2O(Mg、Fe、Zn)b,复盐(doublesalt)M(I)2SO4·M(II)SO4·6H2OM(I)=NH4+、K+M(II)=Mg2+、Mn2+、Fe2+M(I)2SO4·M(III)2(SO4)3·24H2OMI=Li+、Na+、NH4+、K+\nM(III=Al3+Fe3+Cr3+V3+HSO4-和SO42-之间互相转化NaHSO4+NaOH=Na2SO4+H2O难溶盐MSO4+H+=Mn2++HSO4-K=Ksp/KaCaSO4SrSO4PbSO4BaSO4Ksp6.3x10-52.5x10-71.6x10-81.1x10-10\n讨论:1,BaSO4能否溶解于H2SO4?2,如何使这个反应一般化
思考:硫化物\nΦ=Z/r,Φ越大,分解温度就越小,分解产物MO、SO3、SO2、O2600oCSO3=SO2+O2FeSO4=Fe2O3+SO3+SO2如果温度再高,Fe2O3→Fe3O4→FeO6CaSO4+P4O10=3Ca3(PO4)2+6SO2+3O2CaSO4+SiO2=CaSiO3+SO2+1/2O23.5.2.6热稳定性\n附:BaSO4的溶解度1,水中,C==1.05x10-5mol∙L-12,[H+]=1mol∙L-1时,BaSO4+H+=Ba2++HSO4-C==1.05x10-4molL-13,[H+]=1mol∙L-1H2SO4中,[HSO4-]=1mol∙L-1C=Ksp/10-2=1.1×10-8molL-1\n3.5.3硫代硫Na2S2O3Na2SO3+S=Na2S2O32Na2S+Na2CO3+4SO2=2Na2S2O3+CO2酸性不稳定为S2O32-+2H+=SO2↑+S↓+H2O
2Na2S2O3+I2=Na2S4O6+2NaI
Na2S2O3+4Cl2+5H2O
=Na2(HSO4)2+8HCl\n3.5.4其它酸3.5.4.1分类H2SO3→H2S2O4(连二亚硫酸)H2SO4(连多硫酸)\n练习次硫酸HO—S—OH+2价焦硫酸一直连下去是什么?硫代硫酸\n过硫酸H—O—O—H\n3.6硫的其他化合物3.6.1S2Cl2注意:有SF6,但只有S2Cl2、S2Br2、S和I的化合物3.6.2SF6不水解,CCl4不水解,S2F10呢?\n3.6.3卤磺酸其酸性>>H2SO4由于F对电子的吸引力大于OSbF5+HSO3F=H[SbF5(OSO2F)]一种超酸1966年,美CaseWesternReserve大学,\n因为SbF5为一种强的Lewis酸,由于Sb为第五主族元素,其配位数可以为6,它最外层价电子都成键,故为一种Lewis酸,其它如:BF3、AlF3、GaF3而NH3、PH3、AsH3、Sb3H为Lewis碱H[SbF5(OSO2F)]+HOSO2F=H2SO3F++[SbF5(OSO2F)]-\n3.7硒和碲3.7.1存在都是分散元素,硒为半导体材料,有毒和砒霜相近,碲也毒,但小氧化物及酸H2SeO3H2TeO3酸性比H2SO3弱同周期从HClO4HBrO4H5IO6的氧化物看可知,H2SeO4H2TeO4(强酸)氧化性比H2SO4强,故SeO2和TeO2都有氧化性,(SO2还原性)H2TeO4弱酸\n3.8含氧酸的氧化还原性和酸的强弱规律3.8.1氧化还原性以各元素最高价氧化态的含氧酸在酸性介质中到单质时的Eo为准比较3.8.1.1周期性规律1.同一周期,从左到右氧化性升高H4SiO4H5IO6>HClO4H2SeO4>H2TeO4>H2SO4HNO3>H3PO4>H3AsO4>Sb2O5>Bi2O5实际上是Bi2O5最强,然后HNO3、H3AsO4、Sb2O5、H3PO4原因:第二,四,六周期的特殊性
二,r小,无2d,内层电子少\n四,3d10屏蔽少于4p使原子核引力升高3.副族周期性但从5到6周期变化,La系收缩,4f10的影响。六,惰性电子对效应6s2钻穿效应同族中,主、副族比较,主>副BrO4->MnO4-SeO42->Cr2O72-?1.76v1.51v1.15v1.33v?p电子比d电子影响大\n同一元素的不同氧化态,则氧化态越低,越易氧化HClO>HClO2>HClO3>HClO4(HClO2>HClO)
HNO2>HNO3注:一些特殊,如一般S为最高+6而S2O82-为+7当然氧化力更强目前认为:S2O82-为+6,同理还有CrO5练习:比较HNO3H3PO4H3AsO4H2SO4H2SeO4H2TeO4的氧化性\n3.8.1.2影响含氧酸氧化能力的因素1,介质的pH升高,氧化力降低KspK稳三大因素2,内因a,中心原因电负性大,结合电子能力强,氧化性强,现代电负性发展,电负性与电荷无关与轨道有关,如C2H6、C2H4、C2H2b,R—O键的强度\n由于3d和4d、5d相比,1,无节点2,余尾效应小。3,能量受核电荷影响大,故d轨道和O原子成键的倾向,3d<4d<5d所以稳定性:ReO4->TeO4->MnO4-3.8.2无机酸强度变化规律同周期:H4SiO4HClO3>H2SO4>HNO3另外:H4P2O7>H3PO4H5IO6>HIO4H2S2O7>H2SO4缩合后n升高的原因\n氮族元素第一节通性1.ns2np3a.氧化态为–3、+5b.可以为金属、非金属2.亚周期性第二周期:1.无2d轨道配位数少2.半径小\n3.内层电子数少共价单键键能小无2d轨道,双键稳定∴NN三键键能大第四周期3d10不规则性使As氧化性>P第六周期惰性电子对效应6s2电子钻穿效应大而使Bi(V)/Bi(Ⅲ)电极电势很大4.惰性电子对效应:对6s2电子的争夺Hg、Tl、Pb、Bi有什么样的关系?EoHg2+/Hg120o故可能为∏34而留一个单电子OOOONN问题:N2O4为什么是平面结构∏682.王水HNO3有强氧化性+HCl后氧化性更强,可氧化Au、Ptwhy王水有强氧化性?(1)NOClHNO3+3HClNOCl+Cl2+2H2O\n(2)Cl–的配位作用a.Au3++3eAu1.42V[AuCl4]–+3eAu+4Cl–0.994V试求K稳=?EoAuCl4–/Au=EoAu3+/Au–0.05916/3logK稳K稳=4×1021b.王水和Au反应产物为什么是NO而非NO2?Au+HNO3+4HCl=HAuCl4+NO+2H2Oc.王水和Pt反应3Pt+4HNO3+18HCl=3H2PtCl6+4NO+8H2OPt的配位数:0价的Pt化合物很多4配位而这里H2[PtCl6]为何?dsp2杂化和d2sp3杂化\nd.王水洗玻璃仪器很好,比铬酸洗涤好NO(σ1s)2(σ1s*)2(σ2s)2(σ2s*)2(σ2p)2(σ2p*)2(∏2p)4(∏2p*)1OON262pm218pm112pm∴NO为稳定的自由基NO+N2COCN–等电子体\n二、亚硝酸及其盐N2O3亚硝酸酐易分解N2O3NO+NO2250C90%分解HNO2中强酸Ka=5.1×10–4强氧化性酸NO+NO2+H2O2HNO2NO+NO2+2OH–2NO2–+H2OHNO2HNO3+2NO+H2OHNO2分解,如浓度大时有NO2逸出,浓度不大时,NO2与H2O反应生成HNO32NO2+2I–+4H+2NO+I2+2H2O2MnO4–+5NO2–+6H+2Mn2++5NO3–+3H2O\n三、硝酸及其盐(实)NaNO3+H2SO4NaHSO4+HNO3(2)4NH3+5O24NO+6H2OΔHo=–90.4kJ·mol-12NO2+O22NO2ΔH0=–113kJ·mol-13NO2+H2O2HNO3+NOΔH0=–200.1kJ·mol-1NH3ΔHo298=–904kJ·mol-1So=179.76J·mol-1N2O5硝酸酐NO2+NO3–NO2+硝酰N2OCO2N3–等电子体\n百分浓度密度Mol/lbp发烟HNO393%1.522浓HNO368%1.415120oC纯HNO3mp:–40.1oC80oCWhy?水bp100oCHNO380oC而68%HNO3120oC?\n1)相图例:bp:Na97.8oCK63.2oC其合金更低(还有盐酸)2)HNO3的结构原因分子内氢键,加入H2O后,水与HNO3之间形成H键,使HNO3分子内氢键减小1.HNO3与金属的反应(1)Fe、Cr、Al浓HNO3中钝化(2)Sn、As、Sb、Mo、W生成含水化合物SnO2∙xH2OH3AsO4\n(3)M+HNO3(12––16mol/l)NO2为主M+HNO3(6––8mol/l)NO为主M+HNO3(~2mol/l)N2O为主活泼M+HNO3(<2mol/l)NH4+为主活泼M+HNO3H2(4)反应速度:一旦发生后速度很快2NO2+H2OHNO2+H++NO3–Cu+2HNO2+2H+Cu2++2NO+2H2O2NO+4H++4NO3–6NO2+2H2O但如果加入H2O2,Co(NH2)2和HNO2反应,则反应速度减慢CO(NH2)2+2HNO22N2+CO2+3H2O\n2.混合酸(1)王水(见前)(2)浓HNO3∙HF混合酸(M=Nb,Ta)M+5HNO3+7HFH2MF7+5NO2+5H2O(3)浓HNO3+H2SO4硝化剂3.特别(1)Cu(NO3)2为共价化合物4.热分解硝酸盐2NaNO32NaNO2+O22Cu(NO3)22CuO+4NO2+O2(Mg–Cu)2AgNO32Ag+2NO2+O2特别:LiNO3Li2OSn(NO3)2SnO2Fe(NO3)2Fe2O3\n第三节P(还原性)§3-1P一、同素异形体白磷红磷1.P4O6(结构如何?)2.实验PPPPOPPPPOOOOO∙白磷∙红磷对中心红磷加热结果白磷先着火\n二、制备Ca3(PO4)2(s)+3SiO2(S)3CaSiO3(l)+P2O5(g)P2O5(g)+5C(s)2P(g)+5CO(g)三、化学性质表3-1磷的成键性质磷配位数3456成键轨道p3或sp3sp3sp3dsp3d2分子构型三角锥四面体三角双锥八面体例PH3PCl3POClP(OH)3PCl5PF5PF6–\n2P+3X22PX34P+3SP4S3P4+3NaOH+3H2OPH3+3NaH2PO2(类比3S+6OH–2S2–+SO32–+3H2O)X2+2OH–X–+OX–+H2O\n四、氢化物PH3(膦Phosphine)P2H4(双膦Diphosphine)1.鬼火是什么?PH3燃烧白磷燃烧生成P4O6和P4O10,也可缓慢氧化当pO2=133–80000Pa时(10–3–0.8atm)产生绿光PH3+O2P4O10(P4O6)+H2O2.磷盐的稳定性<氨盐\n五、毒性2P+5CuSO4+8H2O5Cu+3H3PO4+5H2SO411P+15CuSO4+24H2O5Cu3P+6H3PO4+5H2SO4AlP被用作粮食仓库的烟熏消毒剂AlP+3H2OAl(OH)3+PH3↑Δ\n§3-2磷的氧化物含氧酸及其盐一、氧化物P4O6P4O101.干燥剂P4O10为最强的干燥剂P4O10+6H2SO44H3PO4+6SO3P4O10+2H2O4HPO3P4O10+8H2O4H3PO4(反应速度不快)P4O10+6C2H5OH=(加酸加热时速度上升)2.P4O6水解歧化还原性亚磷酸酐溶于冷水的最终产物H3PO3P4O6+6H2O(冷)4H3PO32C2H5OP(OH)2+2(C2H5O)2P(OH)OO\n但与热水反应生成PH3P4O6+6H2O(热)=PH3+3H3PO4∴H3PO3在加热时也同样歧化5P4O6+18H2O(热)=8P+12H3PO42P4O6=2P2O4+2P(红)P4O6+2O2=P4O10二、磷的含氧酸1.正磷酸偏磷酸焦磷酸1正酸“分子”-1水分子=1偏酸分子2正酸“分子”-1水分子=1焦酸分子eg.H3PO4-H2O=HPO32H3PO4-H2O=H4P2O7Δ\n2.次磷酸及盐H3PO226.5oC(熔)140oC分解H2PO2–+OH–=HPO32–+H2H2PO2–+Ni2++H2O=HPO32–+Ni+3H+3.亚磷酸及其盐PPCl3H3PO32P+3Cl2=2PCl3PCl3+3H2O=H3PO3+3HCl4H3PO3=3H3PO4+PH3↑制备纯H3PO3的方法:Cl2H2OΔΔ\nNa2HPO3PbHPO3H3PO3该化学反应能发生的原因是什么?为什么先生成沉淀,后沉淀溶解?H3PO3+2Ag++H2O=H3PO4+2Ag+2H+H3PO3+H2SO4(浓)=H3PO4+SO2+H2OH3PO3+2HgCl2+H2O=H3PO4+Hg2Cl2+2H++2Cl–4.磷酸及盐3P4+20HNO3+8H2O=12H3PO4+20NOH3PO4的导电性在45%~47%最强H2SO4也在30%最强为什么?H2SO4+H2OH3O++HSO4–H2SO4+H2SO4H3SO4++HSO4–过磷酸钙Ca(H2PO4)2+2CaSO4Pb(Ac)2H2S\n5.偏磷酸盐焦磷酸盐聚磷酸盐NaH2PO4=NaPO3+H2O2Na2HPO4=Na4P2O7+H2O2Na2HPO4+NaH2PO4=Na5P3O10+2H2O对于硫酸有Na2S2O7+H2O=NaHSO4磷酸呢?反应速度大大减慢如:最大的偏磷酸HPO3+H2O=H3PO4如不加热,要一年才能完成转变6.磷酸和PO43–的结构ΔΔΔOOα152HHOHOP157157158pmβ\n如何从α计算ββ=900+tg–1α106110109.47104107β112.75108.9114.5111.87.p–d∏键OOOOP4个2py与3dz24个2pz与3dx2-y2\nSiO44–PO43–SO42–ClO4–M–O单键长176171169168.5M–O键长1631541491458.PO43–的鉴定(1)PO43–+3NH3+12MoO42–+24H+(NH4)3PO4∙12MoO3∙6H2O+6H2O还可写为(NH4)3[PMo12O40]∙6H2O它可溶于OH–NH3NH4+和(NH4)2C2O4而(NH4)3[AsMo12O40]∙6H2O不可溶于二者\n(2)Mg2++NH4++PO43–=NH4MgPO4↓3Ag++PO43–=Ag3PO4↓(黄)3Ag++AsO43–=Ag3AsO4↓(暗红色)§3-3卤化物和硫化物一、三卤化磷PX3+3HOH=H3PO3+3HXPCl3+3HOC2H5=P(OC2H5)3+3HClPCl3+3C2H5OH=(C2H5O)2POH+C2H5OH+2HClPCl3+BBr3Cl3PBBr3PCl3+1/2O2POCl3PCl3+Cl2PCl5\n二、五卤化磷PCl3+Cl2PCl5PCl5+H2OPOCl3+2HClPOCl3+H2OH3PO4+3HClPCl5+ROHPOCl3+RCl+HClPCl5晶体由[PCl4]+[PCl6]–组成PBr5晶体由[PBr4]+Br–组成三、硫化磷P4S3P4S5P4S7P4S10P4S3制火柴原料\n第四节砷锑铋一般叫砷分族§4-1单质问题:1)什么叫雄黄雌黄砷硫矿锑矿辉铋矿As4S4As2S3FeAsSSb2S3Bi2S32)为什么它们的矿(砷分族)以硫化物居多?而不是氧化物?\n软硬酸碱规则Lewis酸、碱:以给出和接受电子为标准而软硬酸碱规则则是它的推广和发展什么叫软酸:易变形比如:Na+和Hg2+S2–和O2–规则:硬亲硬,软亲软,软硬交界就不管砷分族较软,故和S形成矿物质3)实验室水银温度计打碎了怎么处理?Why?Hg+SHgS软亲软而为什么Hg+O2HgO\nBAlSiGaGeAsInSnTlPbNaOH+H2↑另外PSCl2+NaOH歧化\n§4-2氢化物和卤化物提问:EH3的还原性,键角,酸碱性从上到下怎么变化?酸性还原性变大酸性还原性变大碱性NH3H2OHFPH3H2SHClAsH3H2SeHBrSbH3H2TeHI\nN∙∙ClClCl+2H∙O∙HHOHN∙∙ClClClHOH二、卤化物的水解:NCl3+H2OHClO+NH3NHCl2+HCl+H2ONH3+HOClN2+HOCl+HClH2O\nPClClClHO:HPCl3+H2OP(OH)3+3HClPCl5+H2OAsX5+3H2OPOCl3+2HClH3PO4+3HClH3AsO4+3HX但SbCl3+H2OSbOCl↓+2HClBiCl3+H2OBiOCl↓+2HCl氯化氧铋;氯化铋\n§4-3氧化物及其水合物As2O3As2O5Sb2O3Sb2O5Bi2O3/(惰性电子对效应)引起的原因1.f电子的屏蔽效应更小,使6s2的钻穿效应更显著,具有特别低的轨道能2.形成高氧化态时需要将6s电子激发到6por6d上,所以激发能更高3.原子半径大,内层电子越多,成键时排斥越大,电子云重叠越差,键能小问题:As2O3在水中的溶解度和H+有关吗?\n§4-3AsSbBi的鉴定一、砷镜As(Ⅴ)或(Ⅲ)+Zn=AsH3↑加热分解而SbH3锑镜但:5NaClO+2As+3H2O=2H3AsO4+5NaClor:2AsH3+12AgNO3+3H2O=As2O3+12HNO3+12Ag↓注意:此法不好(主要原因是Ag+氧化性强,Si也可SO2H2S也可)二、AsO43–+3NH4++12MoO42–+24H+(NH4)3AsO4∙12MoO3∙6H2O+6H2O(黄色沉淀)钼砷酸铵(NH4)3AsO4∙12MoO3∙6H2O同样可检验PO43–\n三、Bi3++Sn(OH)3–+9OH–=2Bi↓+3Sn(OH)62–立即生成黑色沉淀Bi3+缓慢生成Sb3+N族课堂提问:1.HNO3作为氧化剂,其还原产物有何规律?浓HNO3NO2稀HNO3NO2a.why?∵NO2+H2OHNO3+NO的平衡b.何为浓,何为稀?中学生的课堂实验c.浓和稀是相对的,对于不同的还原剂有不同的标准,极稀HNO3NH4+(实际这时只能证明没有气体放出)\n2.键角1200键角1300为什么?3.硝酸盐的分解规律(Cu–Mg)问题:Pb(NO2)PbO+NO2+O2PbO2+NO2+O2?Why?4.如何实现Ca3(PO4)2Pa.2Ca3(PO4)2+6SiO2+10C6CaSiO3+P4+10CO↑b.why?产物不能是CO2,高温是CO稳定.why?CO2(g)+C(s)=2CO(g)ΔS>0高温可发生OOONHOOON\nc.上述方程式有何错?P4P(g)d.所以不要相信书,别以为书上写的一定对–––––李远哲5.化学镀Ni2++NaH2PO2Ni↓6.写出PO43–HPO42–H2PO4–和Ag+反应的离子方程式PO43–+3Ag+=Ag3PO4↓2HPO42–+3Ag+=Ag3PO4↓+H2PO4–3H2PO4–+3Ag+=Ag3PO4↓+H3PO4\n磷酸焦磷酸偏磷酸黄↓白↓白↓Ag+溶解HNO3白↓(胶状)蛋白+HAc§4-4硫化物及硫代酸盐1.无Bi2S5因为Bi(Ⅴ)的氧化性2.颜色从上到下加深是因为荷移光谱18+2e型极化作用↑附加极化作用,吸收光能量E↓7.PO43–和P2O44–和PO3–的鉴定\n第五节无机含氧的盐热分解规律§5-1一般稳定性PO43–、SiO32–、B4O7–盐>MSO4≥MCO3>MNO3、MXOn因素:a.酸根离子的对称性高中心离子电负性小稳定d–p∏键倾向性大R–O键数目多b.判断依据:MmROn+1MmO+ROnΔG0判据一般以ΔH0代替\n一、含水盐1.ⅠAⅡAⅢB族盐一般受热脱水eg.Ca(NO3)2∙4H2ONa2CO3∙10H2ONa2B4O7∙10H2O2.z/r大的如Be2+Mg2+Al3+Fe3+等NO3–CO32–的盐则水解,产物为碱式盐或碱二、无水盐的热分解反应1.分解(非氧化还原)373KNa2S2O7Na2SO4+SO3↑BeCO3BeO+CO2↑硼酸盐,硅酸盐不分解\n2.聚合反应2NaHSO4MnO2+2NO2↑AgNO2Ag+NO2↑KMnO4K2MnO4+MnO2+O2ΔΔ\n铝族锗分族\n第一节铝§1-1存在和提取存在:以硅铝酸盐的形式存在与各种矿物中如长石,云母,高岭土等提取:铝钒土(Al2O3)NaAl(OH)4Al(OH)3Al2O3电解液Al2O3+NaAlF6(2~8%)+CaF2(10%)\n§1-2性质一、与B比较1.B半径小,IE高。故以共价键形成化合物离子键共价键B4BF4B(OH)4−Al6AlF4Al(OH)63−3.B非金属H3BO3酸性Al金属Al(OH)3两性Al可以2.最大配位数\n二、Al与水的反应Al+H2O=Al(OH)3+H2↑钝化后不反应加酚酞后是否变红,自来水?三、Al+HCl→AlCl∙6H2O晶体Al+HCl(气)→AlCl34Al+3C→Al4C3ΔG=−211.3KJ∙mol−1\n§1-3氢氧化物和氧化物Al(OH)3(s)=Al3+(aq)+3OH−(aq)Al(OH)3(s)+H2O=H+(aq)+Al(OH)4−(aq)Ksp(a)=2.0×10−11请问:对Al(Ⅲ)来说,存在于水的pH范围如CAl(Ⅲ)=0.1mol∙L−13.5~~9.7Al3+Al(OH)3Al(OH)4−\n§1-4卤化铝AlF3白色难溶Ksp=1.0×10−15离子化合物AlCl3固态:以离子键形式存在以共价键形式存在合成:2Al+3X2→2AlX3Al2O3+3C+3X2=2AlX3+3CO(ClBr)AlCl3∙6H2OAl(OH)3+3HCl+3H2OClAlClAlClClClCl\n§1-5铝盐和配合物一、磷酸盐Al3++PO43−→AlPO4∙xH2O白色胶状是一种新型的分子筛可否溶于强酸?如果可溶,如何计算?\n二、易溶铝盐Al2(SO4)3∙nH2O
Al(NO3)3∙nH2O这些盐受热时,因Al(Ⅲ)的水解作用生成碱式盐Al(ClO4)3∙15H2OAl(OH)(ClO4)3Al(NO3)3∙9H2OAl2O3Al(NO3)3Al(OH)(ClO4)2灭火:Al3++3HCO3−=Al(OH)3↓+3CO2Al2(SO4)3+NaHCO3比H2SO4+Na2CO3好白色固体阻挡燃烧\n三、明矾1.复盐的溶解度小→稳定温度030100Al2(SO4)3(g)31.240.582.1K2SO4·Al2(SO4)3(g)3.08.41542.明矾M2SO4∙Al2(SO4)3∙24H2OLiNaKRbCsNH4TlMⅠAlFeCrVCoMnRhIrMⅢSO4→SeO4\n四、配合物Al3++3C2O42−=Al(C2O42−)33−6.2×1016Al3++Y4−=AlY−2.0×1016(Y=EDTA)问题:Al+SAl2S3而AlCl3+Na2S→无Al2S3why?\n第三节镓铟铊1.性质Ga在液态有Ca2→说明它的非金属性强Ga(OH)3和Al(OH)3的酸性比较:Ga(OH)3强而应为Al(OH)3强周期性:从上到下,金属性增强,氢氧化物碱性↑问题:在NaAl(OH)4和NaGa(OH)4中通CO2,哪个先沉淀?NaAl(OH)4+H2CO3=Al(OH)3↓+NaHCO3+H2O强b强a弱a弱b\n§3-1性质一、物性1.比铅还软(比较:ⅠA、ⅡAⅢA与ⅣA)2.Ga的特殊性熔点29.780C沸点24030C液态区间最大用途:温度计3.液态液态的密度固态4.半导体\n二、Ga的提取1.Ga和Al的金属性哪个强?Ga(OH)3和Al(OH)3的酸性:Al、Ga强Ga(OH)3+H2O=Ga(OH)4−+H+1)酸性越强则加碱易溶解∴Ga(OH)3溶于碱的pH值小于Al(OH)32)由于Ga(OH)3酸性大,Ga(OH)4−与H+的结合力弱一些,在加H+时,Al(OH)4−先变成Al(OH)3\n2.步骤问题:最后一步如何得到Ga?电解法Ga(OH)4−+3e=Ga↓+4OH−Al干扰反应吗?\n§3-2氢氧化物和氧化物Ga(OH)31.4×10−71.4×10−34溶于NH3∙H2OAl(OH)32×10−111×10−36不溶KspaKspb\n一、氢氧化物碱性变化的顺序Al(OH)3≈Ga(OH)3>Cl−>Br−>I−)Pb2++X−(I−>Br−>Cl−>>F−)why?\n四、铅的其他盐Pb(NO3)2Pb(Ac)2可溶PbSO4PbCO3PbCrO4不溶可溶盐中均有配合物生成:Pb(NO3)+(β=15.1)Pb(Ac)+Pb(Ac)2Pb(Ac)3−Pb2++Ac-=Pb(Ac)+β=145Pb(Ac)++Ac-=Pb(Ac)2β=810Pb(Ac)2+Ac-=Pb(Ac)3-β=2950\n就像电离平衡是逐步电离一样,生成配合物也是逐步生成
空气中的反应生成为什么?H2O+CO2+Pb(Ac)2=PbCO3+2HAc\nPbSO4有时可以溶解PbSO4+H2SO4=Pb(HSO4)2PbSO4+3Ac−=Pb(Ac)3−+SO42−你认为PbCO3和PbSO4哪一个的Ksp大PbCrO4+3OH−=Pb(OH)4−+CrO4−(用其两性区别)如BaCrO4SrCrO4(它们都溶于酸,而只有PbCrO4溶于碱)而SrCrO4的Ksp较大,它可溶于弱酸\n§4-5有机物Sn(Ⅱ)Pb(Ⅱ)少Sn(Ⅳ)Pb(Ⅳ)多SnCl4+2Zn(C2H5)2=Sn(C2H5)4+2ZnCl2Na4Pb+4C2H5Cl=Pb(C2H5)4+4NaCl四乙基铅(锡),汽油抗震剂ΔH=217.6KJ∙mol但常温稳定\n碳硅硼第一节引言问题:既然以C作为原子量的标度,为什么C的原子量是12.011而不是12?本章:注意结构以及与之相关的性质/合成。第二节碳14C的半衰期为5730年,可以测定古生物年代。(500-5万年)问题:14C在自然界中是如何平衡的?\n2-1石墨插入化合物大家知道,石墨为一种层状结构,如果将这种层状结构加以利用,加入一些物质,即作为内表面,插入化合物使石墨膨了。这在表面与催化方面有特殊的应用。类似的还有γ-Al2O3金红石(rutile)TiO2\n2-2活性碳的吸附性例如金刚石活性碳:主要是内表面,外表面很小吸附:和催化特性极为相关物理吸附(physicaladsorption)化学吸附(chemicaladsorption)作用大,热效应大\n2-3CO是否为甲酸酐CO+NaOHHCOONaHCOOH脱水得CO1.检验:CO+PdCl2+H2OPd+CO2+2HCl2.Fe2O3+3CO(g)2Fe(s)+3CO2(g)ΔH=-26.8kJ·mol-1Fe(s)+5CO(g)=Fe(CO)5ΔH=-233.5kJ·mol-1\n3.CO和N2的键能有人试图从分子轨道理论加以解释则应为两个π键能量相等又有人想从第一个π键<第二个π键,也不可以解释σ2p*π2p*σ2pπ2p\n2-4CO2H2CO3及盐若将0.2mol/lNa2CO3和0.2mol/lCaCl2混合,是生成Ca(OH)2还是CaCl2Ksp:5.5×10-62.5×10-9[Ca2+][CO32-]=0.1×0.1=10-2>2.5×10-9[Ca2+][OH-]2=0.1×(4.5×10-3)2=2×10-6<5.5×10-6不沉淀若将0.2mol/lMgCl2和0.2mol/lNa2CO3混和呢?生成Mg(OH)2和MgCO3?Ksp1.8×10-111×10-5而[Mg2+][CO2-]=10-2>>Ksp[Mg2+][OH-]2=2×10-6>>Ksp生成碱式盐Mg(OH)2CO3有兴趣的同学可以讨论一下,什么时候生成碱式盐。\n1.动力学>>Ksp时,来不及选择,一起沉淀。2.热力学,Mg2(OH)2CO3的pH值为多少?[Mg2+][CO2-]=Ksp=1.8×10-11[Mg2+][OH-]2=Ksp=1×10-5而[OH-]=9×10-7pOH=6.04,pH=8但是,Mg2(OH)2CO3为一纯净物,有它自己的稳定性,故在pH=6左右很大的区间内生成Mg2(OH)2CO3\n若将CO32-改成HCO3-,则以相同的计算,并可知:0.1mol·L-1的NaHCO3,[OH-]=2×10-6,则M2++HCO3¯=MCO3Ca2+,Sr2+,Ba2+,Cd2+,Mn2+,Ni2+,Ag2+,M2++HCO3¯=M2(OH)2CO3Cu2+,Zn2+,Be2+,Co2+M3++HCO3¯=Fe3+,Al3+,Cr3+若用CO2通入NaHCO3中呢?若用CO2通入水中呢?\n第二节硅重点为硅酸盐3-1单质硅一、SiO2+2CSi+2CO↑提纯,Si+Cl2SiCl4Si+HCl高纯硅(用于半导体),区域熔融法。可达7个9(Hyperpuresilicon)H2\n二、3Si+4HNO3+18HF==3H2SiF6+4NO+8H2OSi+2NaOH+H2O==2H2+Na2SiO3Si+HNO3不反应无HF时不反应。而Si+HF=SiF4+2H2常温下也不反应。\n3-2硅烷n=15一、硅烷为什么没有碳烷多Si-Si键220g/l)NaOH(100g/l)蒸发NaOH溶解度↑NaCl不变由于同离子效应,使NaOH浓度↑时,NaCl浓度↑时,NaCl溶解度下降而析出2.汞阴极法:汞作阴极,则阴极析出Na,成钠汞齐汞的作用1)增加H2的超电势2)升高EoNa+/Na使Na(Hg)m导出与水反应生成NaOH纯度高.但:Hg污染\n第五节盐类Li+,Be2+,Mg2+有共价性,其他离子LiFNa[Sb(OH)6]Li2CO3Na[Zn(UO2)3](Ac)9醋酸铀酰酸钠Li3PO4KHC4H4O6酒石酸钾KClO4K2PtCl6六氯合铂酸钾KB(C6H5)4四苯硼酸钾K2Na[Co(NO2)6]六硝基合钴酸钠钾Rb2SnCl6六氯合锡酸铷从LiK形成水合盐的倾向递减\n一、Na+盐和K+在性质上的差别1.溶解度Na盐>K2.水合盐Na>K数目3.Na盐吸水性>K盐二、如何从锶、钡矿中提取锶、钡SrSO4天青石BaSO4重晶石SrSO4=Sr2++SO42−2.5×10−7Sr2++CO32−=SrCO3(1.6×10−9)−1SrSO4+CO32−=SrCO3+SO42−K=156\n而BaSO4=Ba2++SO42−1.1×10−10Ba2++CO32−=BaCO3(5.1×10−9)−1BaSO4+CO32−=BaCO3+SO42−K=0.022故不可用CO32−来制Ba盐(分析中可用Na2CO3饱和溶液多次转移)BaSO4(s)+4C(s)=BaS(s)+4CO(g)BaS+2HCl=BaCl2+H2S\n练习:判别:Mg2+和NH3∙H2O的反应是否完全?Mg(OH)2和NH4Cl的反应是否完全?Ksp=1.2×10-11Kb=1.8×10-5解题思路:假设Mg2+0.2mol∙L-1和NH3∙H2O0.8mol∙L-1等V反应Mg2++NH3∙H2O=Mg(OH)2+2NH4+方法2,K=Ksp-1Kb2=27故两问其实一回事,PH=PKa−lgCa/Cb[H+]=…[OH-][Mg2+]5.56×10-101.8×10-50.037=1/27\n三、水解Be2+Li+Mg2+较差LiCl∙H2OLiOH+HCl↑BeCl∙4H2OBe(OH)Cl+HCl+3H2OMgCl2∙6H2OMg(OH)Cl+5H2O+HCl↑问题:如何制无水LiCl?HCl气氛中加热四、含氧酸盐的热稳定性(叫同学回答)五、硬水(提问)暂时硬水HCO3−永久硬水SO42−硬度:相当于1升水中有10mgCaO为1o\n第六节对角线规则LiBeMgAl§6-1Li、Be的特性2.Lia.2LiOH=LiO+H2O↑b.LiH加热不分解,而NaHNa+H2c.E0Li+/Li=−3.03最小d.水合盐多1.熔点,硬度高,导电性弱半径小,金属键向共价键过渡\n3.Be化合物分解温度低(叫人回答)易水解共价键§6-2Li与Mg的相似性[Li的特殊性]一、在氧气中燃烧生成氧化物(而非Na2O2KO2)二、MF、MCO3、MPO4难溶(而Na盐溶)三、可生成氮化物Li3N和Mg3N2(Na3N不稳定)四、水合物受热时水解五、共价性LiCH3相性NaCH3离子化合物\n§6-3铍和铝的相似性(1)氧化物氢氧化物均为两性(Mg(OH)2碱性)(2)BeCl2AlCl3为共价化合物易升华,溶于乙醇、乙醚(MgCl2为离子化合物熔融导电)(3)Be和Al和HNO3钝化,而Mg等则反应本节本质原因φ=z/r2e构型\n第七节离子的分离和鉴定Na+K+NH4+Mg2+Ca2+Ba2+ⅠAⅡA[投影]问:1.为什么Mg2+不沉淀(和Ca2+Ba2+一起Mg(OH)2)2.为什么加C2O42−和可使的残余也沉淀分析化学中Ca2+Ba2+(Sr2+)叫碳酸铵组Na+K+NH4+Mg2+叫易溶组\n鉴定:Na+Na++Sb(OH)6−=NaSb(OH)6↓(白)K+2K++Na++C(NO2)63−=K2Na(NO2)6↓(亮黄)Ca2+Ca2++C2O42−=CaC2O4↓(白)Ba2+Ba2++CrO42−=BaCrO4↓(黄)Mg2+Mg2++2OH−+镁试剂Mg(OH)2吸附染料(兰色)NH4+NH4++OH−=NH3↑+H2O\n1.溶液的酸度H++Sb(OH)2−=HSb(OH)6↓(白色胶状)故碱性Mg2+和镁试剂必须pH>10(这时有Mg(OH)2↓)2.反应的温度大多数离子鉴定反应在常温下进行加快反应速度加热使沉淀聚沉,长大为颗粒溶解沉淀赶走气体\n第八节焰色反应提问:如何除去Li中的K(挥发K)Na中的Ca(过滤Ca)