- 1.15 MB
- 2022-08-05 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
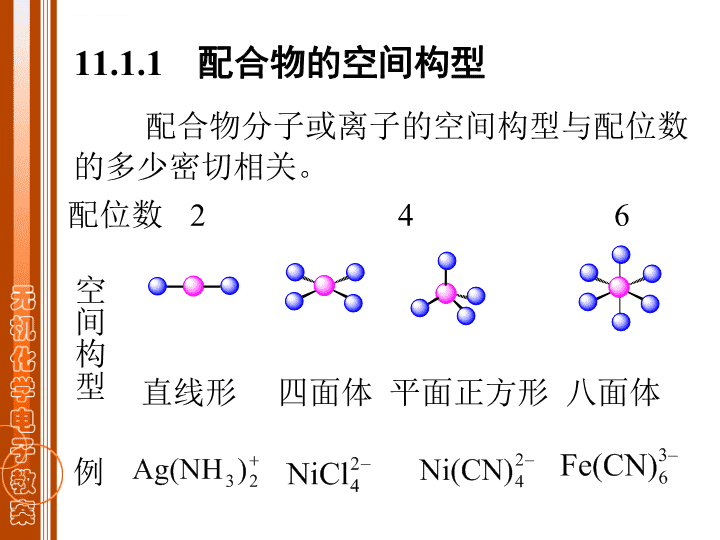
第十一章配合物结构\n§11.1配合物的空间构型和磁性\n配合物分子或离子的空间构型与配位数的多少密切相关。直线形四面体平面正方形八面体配位数246例11.1.1配合物的空间构型空间构型\n例三角形四方锥三角双锥配位数35空间构型\n11.1.2配合物的磁性n——未成对电子数顺磁性:被磁场吸引µ>0,n>0例:O2,NO,NO2反磁性:被磁场排斥µ=0,n=0铁磁性:被磁场强烈吸引。例:Fe,Co,Ni磁性:物质在磁场中表现出来的性质。磁矩:(B.M.)玻尔磁子\nn012345µ/B.M.01.732.833.874.905.92实例:[Ti(H2O)6]3+Ti3+:3d1µ=1.73n=1K3[Mn(CN)6]Mn3+:3d4µ=3.18n=2K3[Fe(CN)6]Fe3+:3d5µ=2.40n=1根据可用未成对电子数目n估算磁矩µ。\n§11.2配合物的化学键理论11.2.1价键理论11.2.2晶体场理论*11.2.3分子轨道理论\n价键理论的要点:1.形成体(M):有空轨道配位体(L):有孤对电子二者形成配位键ML2.形成体(中心离子)采用杂化轨道成键3.杂化方式与空间构型有关11.2.1价键理论\nNH3NH3[Ag(NH3)2]+的空间构型为直线形,μ=0。5p4d5s例:[AgCl2]-,[CuCl2]-4d5s5pAg+[Ag(NH3)2]+sp杂化1.配位数为2的配合物\n[BeX4]2-的空间构型为四面体。1s2s2p1s2s2pX-X-X-X-sp3杂化[BeX4]2-Be2+2.配位数为4的配合物\n[Ni(CN)4]2-的空间构型为平面正方形,μ=0[NiCl4]2-的空间构型为四面体,μ=2.83B.M.[Ni(CN)4]2-Ni2+3d4s4p3d4s4p[NiCl4]2-Cl-Cl-Cl-Cl-dsp2杂化sp3杂化CN-CN-CN-CN-\n这类配合物绝大多数是八面体构型,形成体可能采取d2sp3或sp3d2杂化轨道成键。[Fe(CN)6]3-,μ=2.4B.M.;内轨配键。以内轨配键形成的配合物叫内轨形配合物。3.配位数为6的配合物Fe3+3d4s4p[Fe(CN)6]3-d2sp3杂化CN-CN-CN-CN-CN-CN-\n[FeF6]3-,μ=5.90B.M.外轨配键。以外轨配键形成的配合物叫外轨形配合物。同一中心离子的内轨形配合物比外轨形配合物稳定。[FeF6]3-sp3d2杂化F-F-F-F-F-F-Fe3+3d4s4p4d···([Fe(CN)6]3-)=52.6,([FeF6]3-)=14.3\n对价键理论的评价:很好地解释了配合物的空间构型、磁性、稳定性。直观明了,使用方便。无法解释配合物的颜色(吸收光谱)。\n晶体场理论要点:在配合物中,中心离子M处于带电的配位体L形成的静电场中,二者完全靠静电作用结合在一起;晶体场对M的d电子产生排斥作用,使M的d轨道发生能级分裂;分裂类型与化合物的空间构型有关;晶体场相同,L不同,分裂程度也不同。11.2.2晶体场理论\n在八面体型的配合物中,6个配位体分别占据八面体的6个顶点,由此产生的静电场叫做八面体场。八面体场中d轨道与配体间的作用:1.八面体型的配合物\n\n八面体场中d轨道能级分裂自由离子的能量在球形对称场中的能量在八面体场中的能量\n八面体场及四面体场中d轨道能级分裂\n配合物离子的颜色所吸收光子的频率与分裂能大小有关。颜色的深浅与跃迁电子数目有关。\n配合物离子的颜色\n影响o的因素(中心离子,配位体,晶体场)①中心M离子:电荷Z增大,o增大;主量子数n增大,o增大。[Cr(H2O)6]3+[Cr(H2O)6]2+o/cm-11760014000[Fe(H2O)6]3+[Fe(H2O)6]2+o/cm-11370010400[CrCl6]3-[MoCl6]3-o/cm-11360019200\n②配位体的影响:光谱化学序列[Co(H2O)6]3+[Co(CN)6]3-[CoF6]3-[Co(NH3)6]3+o/cm-1130001860022900340002-2-I-P弱场:o