- 96.00 KB
- 2022-08-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
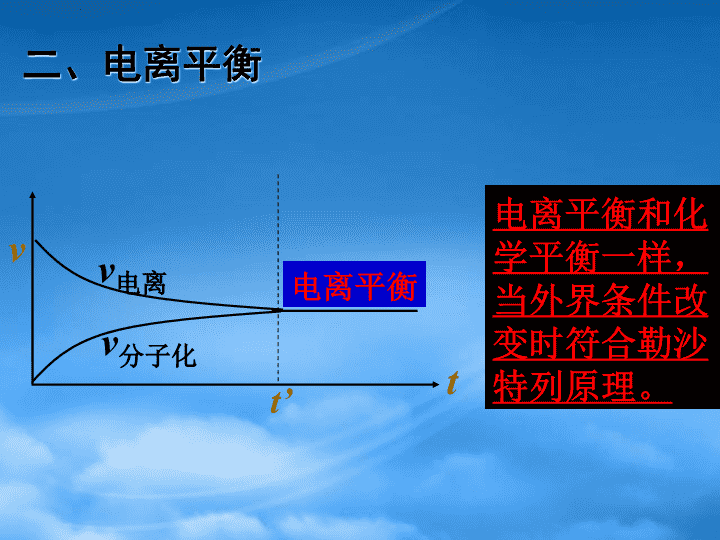
电离平衡\n可逆反应有什么特征?化学平衡有什么特征?若在纯水滴加冰醋酸,试分析一下所形成的水溶液中发生哪些变化?以醋酸为例,研究弱电解质的电离过程中实质上包含着哪几个过程?弱电解质的电离过程中包含:(1)分子电离成离子;(2)离子结合成分子。\n二、电离平衡vt’tv电离v分子化电离平衡电离平衡和化学平衡一样,当外界条件改变时符合勒沙特列原理。\n影响电离平衡有哪些因素(1)温度电离过程是吸热过程,平衡温度升高向电离方向移动。(2)浓度浓度越大,电离程度越小。(3)其他因素\n讨论:1、在盐酸中加少量NaCl固体,在醋酸溶液中加少量NaAc固体,将分别对两种酸的电离有怎样的影响?2、在0.1mol/L醋酸溶液分别:加热、加入少量盐酸、加入少量氢氧化钠、加入醋酸铵晶体,电离平衡会怎样移动?溶液中c(H+)怎样变化?3、强电解质溶液中有无可能存在电离平衡?\n问题:怎样定量的比较弱电解质的相对强弱?电离程度相对大小怎么比较?三、电离平衡常数(K)看课本自学相关内容并思考:(1)什么叫电离平衡常数?(2)电离平衡常数的化学含义是什么?(3)怎样用电离平衡常数比较弱电解质的相对强弱?(4)影响电离平衡常数的因素是什么?\n弱电解质电离程度相对大小的参数一电离平衡常数(K)对于一元弱酸HAH++A-,平衡时Ka=c(H+).c(A-)c(HA)对于一元弱碱MOHM++OH-,平衡时Kb=c(M+).c(OH-)c(MOH)意义:K值越大,电离程度越大,相应酸(或碱)的酸(或碱)性越强。K值只随温度变化。\n已知多元弱酸在水溶液中的电离是分步的。例:H2CO3H++HCO3-一(1)HCO3-H++CO32-一(2)每一步的电离程度是不一样的。(9)写出H3PO4在水溶液中的电离方程式。H3PO4H++H2PO4-一(1)H2PO4-H++HPO42-一(2)HPO42-H++PO43-一(3)就电离本身而言,你推测每一步的电离程度如何变化,为什么?\n对于多元酸:多元弱酸是分步电离的,K1》K2(一般要相差105)。多元弱酸的酸性由第一步电离决定。试根据课本中“一些弱酸和弱碱的电离平衡常数”比较它们的相对强弱。\n弱电解质电离程度相对大小的另一种参数-------电离度αα=已电离的分子数弱电解质分子总数讨论:根据以上定义式,你还能得出哪些计算α的关系式?\n