- 789.50 KB
- 2022-08-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
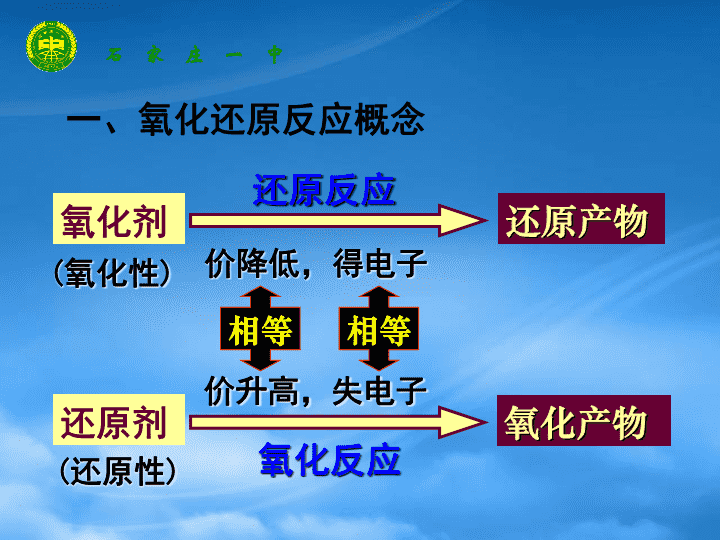
氧化还原专题复习化学反应中的物质变化和能量变化高三第一轮复习\n石 家 庄 一 中【考试大纲要求】Ⅰ理解氧化和还原、氧化性和还原性、氧化剂和还原剂等概念Ⅱ能判断氧化还原反应中电子转移的方向和数目Ⅲ配平反应方程式Ⅳ考查综合能力\n一、氧化还原反应概念还原反应价降低,得电子(氧化性)(还原性)氧化反应价升高,失电子还原剂还原产物氧化剂氧化产物相等相等石 家 庄 一 中\n常见的氧化剂、还原剂活泼非金属单质:含氧酸:高价盐:氧化物:O2SCl2Br2浓H2SO4HNO3HClOFeCl3KMnO4NO2Na2O2MnO2⑴氧化剂\n活泼的金属单质:无氧酸:低价化合物:非金属单质:NaMgZnH2SHClHBrHINa2SO3NaBrKINOCOFeCl2H2CS常见的氧化剂、还原剂⑴还原剂\n随着人们生活节奏的加快,方便的小包装食品已被广泛接受。为了延长食品的保质期,防止食品受潮及富脂食品氧化变质,在包装袋中应放入的化学物质是(A)无水硫酸铜、蔗糖(B)硅胶、硫酸亚铁(C)食盐、硫酸亚铁(D)生石灰、食盐B石 家 庄 一 中[课堂练习]\n苹果汁是人们喜欢的饮料。由于此饮料中含有Fe2+,现榨的苹果汁在空气中会由淡绿色变为棕黄色。若榨汁时加入维生素C,可有效防止这种现象发生,说明维生素C具有(A)氧化性(B)还原性(C)碱性(D)酸性(B)[课堂练习]石 家 庄 一 中\n二、分析方法(1)双线桥法(2)单线桥法石 家 庄 一 中氧化剂+还原剂——还原产物+氧化产物失去电子被氧化得到电子被还原\n三、物质的氧化性、还原性及强弱的比较(1)根据元素的化合价物质中元素具有最高价,该元素只有氧化性,物质中元素具有最低价,该元素只有还原性;物质中元素具有中间价,该元素既有氧化性又有还原性。石 家 庄 一 中\n(2)根据氧化还原反应方程式氧化剂+还原剂——还原产物+氧化产物失去电子被氧化得到电子被还原石 家 庄 一 中强氧化剂+强还原剂——弱还原剂+弱氧化剂失去电子被氧化得到电子被还原\n(3)根据金属活动性顺序表在金属活动性顺序表中,金属的位置越靠前,其还原性就越强(铂金除外);金属的位置越靠后,其阳离子的氧化性就越弱。(4)其它因素,如反应的条件(温度、浓度、溶液的pH等)、原电池正负极判断,电解放电顺序等石 家 庄 一 中\n(4)浓度、pH、温度的影响⑴增大浓度,氧化性、还原性增强⑵增强溶液pH,氧化性、还原性增强⑶升高温度,氧化性、还原性增强Cu和浓H2SO4MnO2和浓HClS2-+SO32-+H+NO3-+H+浓硫酸加热有明显的氧化性石 家 庄 一 中\n根据反应①~④判断下列4种物质的氧化性由强到弱的正确顺序是()①Cl2+2KI=2KCl+I2②2FeCl2+Cl2=2FeCl3③2FeCl3+2HI=2FeCl2+2HCl+I2④H2S+I2=S+2HI(A)S>I2>Fe3+>Cl2(B)Cl2>Fe3+>I2>S(C)Fe3+>Cl2>S>I2(D)Cl2>I2>Fe3+>SB[课堂练习]石 家 庄 一 中\n在含有FeCl3和BaCl2的酸性溶液中,通入足量的SO2后有白色沉淀生成,过滤后,向溶液中滴加KSCN溶液,无明显现象,下列叙述正确的是A.白色沉淀是BaSO4和BaSO3B.溶液的酸性减弱C.白色沉淀是BaSO3D.FeCl3全部被还原为FeCl2\n已知Co2O3在酸性溶液中易被还原成Co2+,Co2O3、Cl2、FeCl3、I2氧化性依次减弱。下列反应在水溶液中不可能发生的是A.3Cl2+6FeI2=2FeCl3+4FeI3B.Cl2+FeI2=FeCl2+I2C.Co2O3+6HCl=2CoCl2+Cl2↑+3H2OD.2Fe3++2I—=2Fe2++I2[课堂练习]石 家 庄 一 中\n四、氧化还原反应方程式配平1.依据原则在氧化还原反应中,元素得失电子的总数(或化合价升降的总数)相等。2.配平方法化合价升降法石 家 庄 一 中\n1.定项配平HClO3+P4+H2O—HCl+H3PO42.缺项配平Pt+HNO3+HCl——H2PtCl6+NO↑+[课堂练习]石 家 庄 一 中\n由硫可制得多硫化钠Na2Sx,x值一般为2~6,已知Na2Sx与NaClO反应的化学方程式如下:Na2Sx+NaClO+NaOH——Na2SO4+NaCl+H2O试配平上述方程式,若某多硫化钠在反应中消耗的NaClO和NaOH的物质的量之比为2:1,试以求得的x值写出该多硫化钠的分子式________________。3.未知量配平[课堂练习]石 家 庄 一 中\n配平以下氧化还原反应方程式:KMnO4+H2C2O4+H2SO4——CO2+K2SO4+MnSO4+H2O当KMnO4消耗0.05mol时,产生的CO2的体积为________L(标准状况)。[课堂练习]4.有机氧化还原反应方程式配平石 家 庄 一 中\n(09广东化学23)(3)次磷酸钠(NaH2PO2)可用于化学镀镍。①NaH2PO2中P元素的化合价为。②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:(a)Ni2++H2PO2-+→Ni+H2PO3-+(b)6H2PO2-+2H+=2P+4H2PO3-+3H2↑请在答题卡上写出并配平反应式(a)。\n五、有关氧化还原反应的计算:电子守恒一定条件下硝酸铵受热分解的未配平化学方程式为NH4NO3——HNO3+N2+H2O,在反应中被氧化与被还原的氮原子之比为A.1:1B.5:4C.5:3D.3:5[课堂练习]石 家 庄 一 中\n(2002年河南,12)在一定条件下,分别以高锰酸钾、氯酸钾、过氧化氢(H2O2)为原料制取氧气,当制得同温、同压下相同体积的O2时,三个反应中转移的电子数之比为A.1∶1∶1B.2∶2∶1C.2∶3∶1D.4∶3∶2(2002年江苏综合,25)在100mL含等物质的量HBr和H2SO3的溶液里通入0.01molCl2,有一半Br-变为Br2(已知Br2能氧化H2SO3)。原溶液中HBr和H2SO3的浓度都等于A.0.0075mol·L-1B.0.008mol·L-1C.0.075mol·L-1D.0.08mol·L-1\n在BrF3+H2O----HBrO3+Br2+HF+O2↑中,有5molH2O反应时,被水还原的BrF3的物质的量为(),被还原的BrF3的物质的量为(),被其本身还原的BrF3的物质的量为()A.3molB.2molC.4/3molD.2/3molCBD[课堂练习]石 家 庄 一 中\n有0.3mol硫化亚铜与适量的稀硝酸恰好完全反应生成硝酸铜、硫酸、一氧化氮和水,则末被还原的硝酸为()mol,被还原的硝酸为()mol,消耗的硝酸为()mol。A.2.2B.0.6C.1.2D.1.0C、D、A[课堂练习]石 家 庄 一 中\n向VmLFeBr2溶液中缓缓通入amolCl2,结果溶液中有50%的Br2被氧化,则原FeBr2的物质的浓度为()mol/·LA.B.C.D.A[课堂练习]石 家 庄 一 中\n将标况下224mLCl2通入10mL1mol/L的FeBr2溶液中,发生反应的离子方程式为()A.2Br-+Cl2=Br2+2Cl-B.2Fe2++Cl2=2Fe3++2Cl—C.2Fe2++4Br—+3Cl2=2Fe3++2Br2+6Cl—D.2Fe2++2Br—+2Cl2=2Fe3++Br2+4Cl—D[课堂练习]石 家 庄 一 中\n(09全国卷Ⅱ13)含有amolFeBr2的溶液中,通入xmolCl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-B.x=0.6a,2Br-+Cl2=Br2+2Cl-C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-\n硫元素可形成多硫化物,如K2Sx(x=2-6),为测定x值,K2Sx在碱性条件下与BrO3-反应,反应中S被氧化为SO42-,BrO3-还原为Br-。(1)如果当K2Sx恰好被全部氧化时,消耗BrO3-与K2Sx的物质的量之比为7:3,则x=_____;(2)以上反应的离子方程式为________。7×6=3[6-(-)]xx=2[课堂练习]石 家 庄 一 中\n用KMnO4晶体和浓盐酸制取氧气和氯气。取0.2molKMnO4晶体先加热制得一定量的O2后停止加热,再将残留物与过量浓盐酸混合、加热,得到Cl2,此时溶液中的主要离子是K+、Mn2+、H+和Cl-。(1)计算KMnO4晶体完全分解时制得的O2在标准状况下的体积。(2)将(1)中完全分解的固体产物与过量浓盐酸反应,可制得Cl2的物质的量为。(3)若最后得到的Cl2为0.48mol,则KMnO4制氧气时的分解率为。[课堂练习]石 家 庄 一 中\n(08全国Ⅰ卷)实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl:用水溶解,滤去残渣,滤液酸化后,K2MnO4转化为MnO2和KMnO4;滤去MnO2沉淀,浓缩滤液,结晶得到深紫色的针状KMnO4。请回答:(1)软锰矿制备K2MnO4的化学方程式是。(2)K2MnO4制备KMnO4的离子方程式是。(3)若用2.5g软锰矿(含MnO280%)进行上述实验,计算KMnO4的理论产量。(4)KMnO4能与热的经硫酸酸化的Na2C2O4反应生成Mn2+和CO2该反应的化学方程式是。(5)上述制得的KMnO4产品0.165g,恰好与0.335g纯Na2C2O4反应完全,计算该KMnO4的纯度。\n(1)3MnO2+6KOH+KClO3KCl+3K2MnO4+3H2O。(2)3MnO42-+4H+===MnO2↓+2MnO4-+2H2O。(3)2.42g。(4)2KMnO4+8H2SO4+5Na2C2O4===K2SO4+2MnSO4+5Na2SO4+10CO2↑+8H2O。(5)95.76%。\n(08上海卷)某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。(1)请将Au2O3之外谁反应物与生成物分别填入以下空格内。(2)反应中,被还原的元素是___,还原剂是______。(3)将氧化剂与还原剂填入空格中,并标出电子转移的方向和数目。(4)纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白后布匹“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂物质的量之比为__________。\n(1)Au2O3、Na2S2O3、H2O、Na2S4O6、Au2O、NaOH。(2)Au(+3);Na2S2O3。(3)(4)1∶4。\n