- 1.70 MB
- 2022-08-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
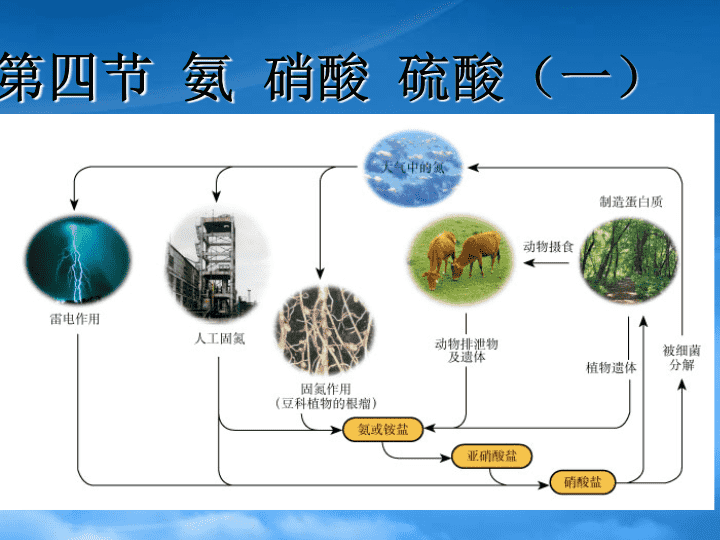
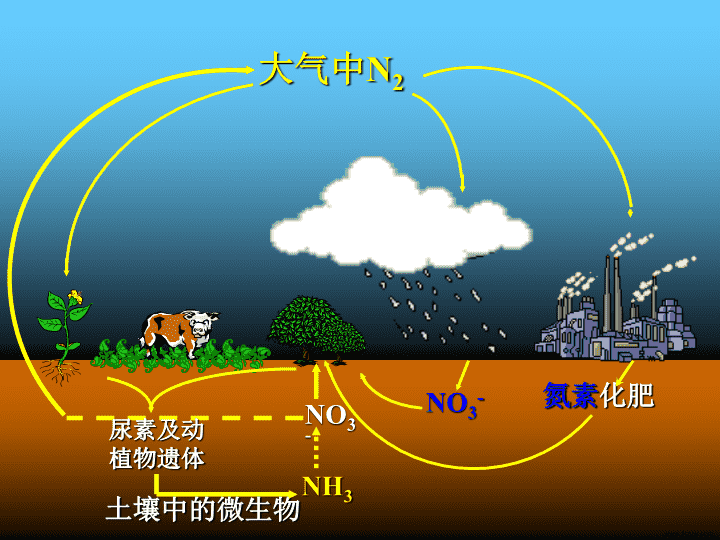
第四节氨硝酸硫酸(一)\n大气中N2NO3-NH3尿素及动植物遗体NO3-土壤中的微生物氮素化肥www.jkzyw.com\n氮元素是一切动植物的生长都需要的营养元素。大气中含有大量的氮气,但是不能被多数生物直接吸收,多数生物只能吸收含氮元素的化合物。\n氮的固定(fixationofnitrogen):将空气中游离的氮转变为氮的化合物的方法叫做氮的固定。氮的固定自然固氮人工固氮:合成氨豆科植物根瘤菌固氮;打雷放电条件下固氮。\n一、氨(NH3):(ammonia)合成氨是人类发展史上的一项重大突破,解决了因粮食不足而导致的饥饿和死亡问题。\n对合成氨研究有贡献的三位科学家哈伯(1868—1934),德国化学家,合成氨工业的奠基人。1918年哈伯由于对合成氨研究作出过重大贡献,而获诺贝尔化学奖。www.jkzyw.com\n1900年,法国化学家勒沙特列在研究平衡移动原理的基础上通过计算,认为N2、H2在高压条件下可以直接化合生成氨,接着,他用实验来验证。但在实验过程中发生了爆炸,他也没有调查事故发生的原因,而是觉得这个实验有危险,于是放弃了研究。勒沙特列的合成氨实验就这样夭折了。\n后来查明是由于他所用混合气体中含有O2,实验中H2和O2化合发生了爆炸。稍后,德国化学家耐斯特通过理论计算,认为合成氨是不可能的。因此人工合成氨的研究又一次止步。后来才发现,是能斯特计算时误用了一个热力学数据,以至得到错误结论。\n在合成氨研究屡屡受挫的情况下,德国另一位化学家哈伯知难而进,对合成氨进行了全面系统地研究和实验,终于在1908年7月在实验室里用N2和H2在600℃、200个大气压下合成氨,产率虽只有2%,但却是科学上的一项重大突破。\n当哈伯的合成氨工艺流程公众于世后,立即引起了德国当时的统治者们的注意,德国统治者为了达到吞并欧洲称霸世界的野心,同时也利用哈伯想成为百万富翁的贪婪心理,请哈伯出任德国威廉研究所所长,继续他的研究。从1911年到1913年短短两年时间内,哈伯不仅提高了合成氨的产率,而且合成了1000吨液氨,并且用它制造出3500吨烈性炸药TNT。\n到了1913年第一次世界大战时,哈伯已为德国建成了无数个大大小小的合成氨工厂,为侵略者制造了数百万吨炸药,从而导致并蔓延了这场秧祸全球的世界大战,这也是第一次世界大战德国为什么能坚持这么久的谜底。www.jkzyw.com\n当事实真相大白于天下时,哈伯受到了各国科学家的猛烈抨击,尤其是当他获得1918年诺贝尔化学奖时,更激起了世界人民的愤怒。人工合成氨实验的成功令人欢心鼓舞,它对工农业生产、国防科技的重大意义是不言而喻的。但三位科学家留给后人的思考也是深刻的—科学必须造福于民!\n1、氨气制法:1)工业制法:N2+3H22NH3高温、高压催化剂\n2)氨气的实验室制法:(1)原料:用NH4Cl与Ca(OH)2混和加热制得(2)原理:2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O\n(3)制取装置:固固加热装置(5)验满:(4)收集装置:⑹环保措施:⑺干燥装置棉花的作用:防止空气对流\n浓氨水方法二:加热浓氨水制氨气NH3·H2O===NH3↑+H2OCaO或NaOH浓氨水\n实验:一支干燥的充满NH3的圆底烧瓶,用带有玻璃管和滴管(滴管预先吸入水)的塞子塞紧瓶口。倒置烧瓶,使玻璃管插入盛有水的烧杯里(水中滴有酚酞溶液)。NH3水酚酞www.jkzyw.com\n【操作方法】:打开止水夹,轻轻挤压胶头滴管,使少量的水进入烧瓶。观察并描述现象。NH3水酚酞\n烧杯中的水进入烧瓶中,形成红色的喷泉。——“喷泉实验”【实验现象】:\n①烧瓶里为什么会形成喷泉?②胶头滴管的作用是什么?③烧瓶中的溶液为什么变成红色?①烧瓶内外产生压强差。②引发“喷泉”实验③水溶液呈碱性,有OH-离子存在。www.jkzyw.com\n一、氨(NH3):1.氨的物理性质:颜色:气味:状态:密度:无色有刺激性气味气体比空气的密度小水溶性:极易溶于水(1:700)氨易液化.\n氨的溶解更主要的是化学反应。氨溶于水时,大部分氨与水结合,形成一水合氨(NH3·H2O)。NH3+H2ONH3·H2O⑴氨与水反应:2.氨气的化学性质:一水合氨\nNH3·H2O可以部分电离形成NH4+和OH-,所以氨水显弱碱性。NH3·H2ONH4++OH-NH3+H2ONH3·H2ONH4++OH-【小结】:氨水的成分分子:NH3、H2O、NH3·H2O离子:NH4+、OH-等\nNH3·H2O不稳定,受热时容易分解为NH3和H2O。不加热不分解.NH3·H2O===NH3↑+H2O现象:溶液红色褪色,冷却后恢复红色。【探究实验】:将氨的酚酞溶液倒入栓有小气球的试管中,加热。www.jkzyw.com\n取两支玻璃棒,分别蘸取浓氨水和浓盐酸后,再将两支玻璃棒靠近,观察现象。现象:产生大量的白烟。【探究实验】:\n\n⑵氨与酸反应:NH3+HCl==NH4Cl(白烟)——此反应可检验NH3或HCl【知识延伸】:挥发性酸(HCl、HNO3等)遇氨气均有白烟生成;难挥发性酸H2SO4无此现象。www.jkzyw.com\nNH3+HCl==NH4Cl;NH3+HNO3==NH4NO3;2NH3+H2SO4==(NH4)2SO4;不能用浓硫酸干燥.\n⑶氨与氧气反应:\n⑶氨与氧气反应:4NH3+5O2====4NO+6H2O催化剂△——工业制硝酸的基础。www.jkzyw.com\nN2NH3NONO2HNO3O2O2H2ON2+3H22NH3高温、高压催化剂4NH3+5O2====4NO+6H2O催化剂△2NO+O2===2NO23NO2+H2O===2HNO3+NO\n3.氨的用途:氨制铵盐制硝酸制纤维、塑料、染料制纯碱制尿素作致冷剂制医用氨水\n氨的用途制硝酸制纯碱制尿素做致冷剂www.jkzyw.com\n2NH3+H2SO4==(NH4)2SO4NH3+HNO3==NH4NO3NH3+CO2+H2O===NH4HCO3制铵盐4NH3+5O2====4NO+6H2O催化剂△2NO+O2===2NO23NO2+H2O===2HNO3+NO制硝酸2NH3+CO2====CO(NH2)2+H2O催化剂△制尿素NH3(g)NH3(l)放热吸热制冷剂\n2)氨气的实验室制法:(1)原料:用NH4Cl与Ca(OH)2混和加热制得(2)原理:2NH4Cl+Ca(OH)2==CaCl2+2NH3↑+2H2O\n(3)制取装置:固固加热装置(5)验满:(4)收集装置:⑹环保措施:⑺干燥装置棉花的作用:防止空气对流www.jkzyw.com\n(5)验满:a:湿润的红色石蕊试纸变蓝(唯一的一种碱性气体)(4)收集装置:向下排空气法b:蘸有浓HCl的玻璃棒接近试管口产生白烟。\n⑹环保措施:浓硫酸吸收多余的氨气.⑺干燥装置水——装置:倒扣漏斗用碱石灰干燥。\n4、铵盐1)铵盐的涵义:由铵根离子(NH4+)与酸根离子构成的化合物叫铵盐.物理性质:铵盐都易溶于水\n2)铵盐的化学性质:①铵盐受热易分解:NH4Cl==NH3↑+HCl↑△NH4HCO3==NH3↑+CO2↑+H2O△△(NH4)2CO3==2NH3↑+CO2↑+H2O\n②铵盐与碱反应(NH4)2SO4+2NaOH==2NH3↑+Na2SO4+H2O△△NH4NO3+NaOH==NH3↑+NaNO3+H2ONH4++OH-==NH3↑+H2O【结论】:铵盐的通性—均能与碱共热产生氨气。实质:www.jkzyw.com\n如何用实验方法证明某白色固体是铵盐?试剂及操作:滴加NaOH溶液,再加热,并将湿润的红色石蕊试纸靠近试管口。实验现象:产生无色刺激性气味气体,能使湿润红色石蕊试纸变蓝。铵盐(NH4+)的检验:\n如果只提供如图2的装置,请说明引发喷泉的方法。水氨气打开夹子,用手(或热毛巾等)将烧瓶捂热,氨气受热膨胀,赶出玻璃导管内的空气,氨气与水接触,即发生喷泉。\n5.若该实验在标况下完成,烧瓶的容积为VL,喷泉实验后溶液充满整个烧瓶,所得溶液中溶质的物质的量浓度为多少?\n6.下图装置难以形成喷泉,试分析其原因。如果要使该装置也能形成喷泉(在不改变气体成分的前提下),你认为要采取什么措施?www.jkzyw.com\n