- 4.09 MB
- 2022-08-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
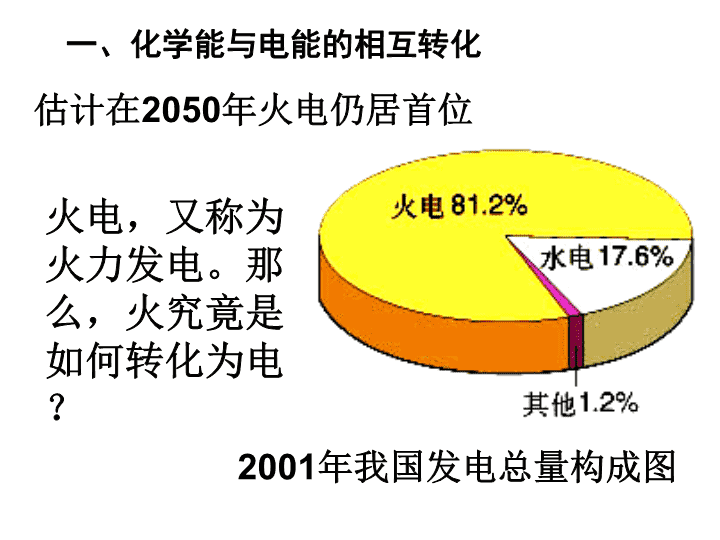
化学能与电能\n电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源,又称为电力。\n一、化学能与电能的相互转化2001年我国发电总量构成图估计在2050年火电仍居首位火电,又称为火力发电。那么,火究竟是如何转化为电?\n化学能热能机械能电能燃烧蒸汽发电机1、火力发电的原理分析。\n2、火力发电的化学深层本质分析燃烧氧化还原反应氧化剂与还原剂之间发生电子的转移火力发电将化学能经一系列能量转化为电能旧键断裂和新键形成、体系能量变化过程关键本质本质引起\n3、火力发电的利弊分析。思考1:火力发电有何利与弊?燃料燃烧转化为电能后,社会中应用最广泛、使用最方便。利弊产生二氧化硫和氮的氧化物,导致空气污染,也会造成酸雨,破坏生态环境;会产生二氧化碳,会使地球的温室效应恶化。能量的转化效率地低.\n思考2:假设你是电力工程师,面对这些利与弊,你会如何应对呢?a、改进火力发电方式之一就是尝试将化学能直接转化为电能。就像电池。其好处就是减少中间环节能损,高效、清洁利用燃料,不浪费能源,更方便。b、研究新的发电方式\n4、原电池学生实验2-4现象电极方程式电极铜片锌片电流表有气泡产生不断溶解指针发生偏转Zn-2e-==Zn2+(氧化反应)2H++2e-==H2↑(还原反应)实验结果表明,导线中有电流通过。正极负极将化学能转变为电能的装置。\n当把用导线连接的铜片和锌片一同浸入稀硫酸时,由于锌比铜活泼,容易失去电子,锌被氧化成Zn2+而进入溶液,电子由锌片通过导线流向铜片,溶液中的H+从铜片获得电子被还原成氢原子,氢原子结合成氢分子从铜片上逸出。\n☆学与问☆你知道电子是怎样流动的吗?你如何判断电源的正极、负极?我们知道,电流是从正极流向负极的,与电子的流向是相反的。从实验知道电子从锌片流向铜片,所以电流应该是从铜片流向锌片的,因此可知原电池两极的判断方法:活泼金属→发生氧化反应→向外线路提供电子→原电池的负极;不活泼金属(或石墨)→发生还原反应→接受外线路提供的电子→原电池的正极。\n实践活动自制电池——水果电池。如下图:\n原电池化学反应本质:
较活泼的金属发生氧化反应,电子从较活泼的金属(负极)通过外电路流向较不活泼的金属(正极)化学电池由正极、负极、电解质溶液以及容器组成。\n思考与交流通过以上实验和探究,试说明化学电池由几部分组成,它的组成条件是什么?总结归纳原电池的构成条件:①有两种活动性不同的金属(或非金属导体)作电极。②电极材料均插入电解质溶液中。③两极相连形成闭合电路。\n一、铜片和锌片用导线连接后插入稀硫酸中,锌片是()极二、在用锌片,铜片和稀硫酸组成的原电池装置中,经过一段时间工作后,下列说法中正确的是()A、锌片是正极,铜片上有气泡产生B、电流方向是从锌片流向铜片C、溶液中硫酸的物质的量减小D、电解液的PH保持不变负C\n化学电源空气电池锂电池\n(1)干电池的构造是什么样的?(2)干电池的负极和正极分别是什么?电解质溶液又是什么?(3)干电池使用久了会发生什么现象?思考题\n(4)什么叫做充电电池?铅蓄电池的构造是什么样的?(5)铅蓄电池负极和正极分别是什么?电解质溶液又是什么?(6)废旧电池是否应该回收?为什么?\n干电池上图是锌-锰干电池负极:Zn--2e-==Zn2+正极(C):2NH4++2e-==2NH3↑+2H2↑\n体积小、性能好的碱性锌-锰电池应运而生。这类电池的重要特征是电解液由原来的中性变为离子导电性更好的碱性,负极也由锌片改为锌粉,反应面积成倍增长,使放电电流大幅度提高。\n铅蓄电池\n负极:Pb+SO42--2e-==PbSO4↓正极:PbO2+4H++SO42-+2e-==PbSO4↓+2H2O总反应:Pb+PbO2+2H2SO4==PbSO4+2H2O放电\n锂电池锂是密度最小的金属,用锂作为电池的负极,跟用相同质量的其他金属作负极相比较,使用寿命大大延长。\n新型燃料电池燃料电池不是把还原剂、氧化剂物质全部贮藏在电池内,而是在工作时,不断从外界输入,同时将电极反应产物不断排出电池负极:2H2-4e-+4OH-==4H2O正极:O2+2H2O+4e-==4OH-总反应:2H2+O2==2H2O电极:多孔镍电解质:KOH\n科学探究——构成原电池的条件实验序号①步骤要求在一支试管中加入少量稀硫酸和一小粒纯锌粒实验现象用化学方
程式解释
实验现象思考问题
寻找答案1.反应中,哪种物质失电子?哪种物质得电子?2.Zn是通过什么途径将电子转移给溶液中H+的?3.想什么办法使Zn与H+分开,不让H+直接在Zn表面得电子?列出你对
问题3的
想 法学生实验探究\n实验序号②步骤要求在另一支试管中加入少量稀硫酸和一小粒纯锌粒,再将一根粗铜丝插入试管,观察一会儿,使铜丝与锌粒接触,观察现象实验现象用化学方
程式解
释实验现象思考问题寻找答案1.反应中,哪种物质失电子?哪种物质得电子?2.Zn是通过什么途径将电子转移给溶液中H+的?3.H+得到的电子是Cu失去的吗?Cu在这个过程中起什么作用?4.想什么办法让这种电子的转移变成电流?列出你对
问题4的
想 法\n实验序号③步骤要求将锌片和铜片用导线连接,平行插入盛有稀硫酸的烧杯中,观察现象实验现象写化学方程
式或解释
实验现象思考问题
寻找答案1.反应中,哪种物质失电子?哪种物质得电子?2.电子从Zn到溶液中H+经历了哪些途径?3.导线在这个过程中起什么作用?4.你怎样才能知道导线中有电子流过?怎样才能知道导线中电子流动方向?组内交流
列出想法\n实验序号④步骤
要求将锌片和铜片用导线连接,在导线中间接入一个电流计,平行插入盛有稀硫酸的烧杯中,观察现象。将锌片和铜片用导线反接电流计再做实验,观察现象实验
现象解释实
验现象思考问题
寻找答案1.反应中,哪种物质失电子?哪种物质得电子?2.电子从Zn到溶液中H+经历了哪些途径?3.电流计在这个过程中起什么作用?4.你认为这个过程中能量的转化关系是怎样的?组内交流
列出想法\n原电池构成部分对比一实验现象解释或写化学方程式稀硫酸Zn石墨稀硫酸Cu石墨电流计原电池构成部分对比二实验现象解释或写化学方程式稀硫酸ZnFe乙醇ZnFe电流计\n原电池构成部分对比三实验现象解释或写化学方程式稀硫酸ZnZn稀硫酸ZnFe电流表原电池构成部分对比四实验现象解释或写化学方程式插在一个西红柿中ZnCu插在两个西红柿中ZnCu电流计