- 192.00 KB
- 2022-08-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
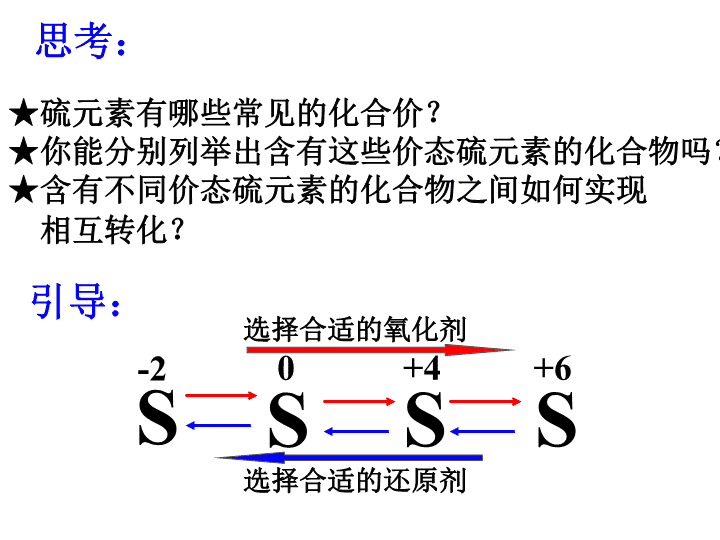
第3节硫的转化\n★硫元素有哪些常见的化合价?★你能分别列举出含有这些价态硫元素的化合物吗?★含有不同价态硫元素的化合物之间如何实现相互转化?思考:引导:-2S0SS+4S+6选择合适的还原剂选择合适的氧化剂\n实验室常见的氧化剂和还原剂有哪些?氧化剂:还原剂:酸性KMnO4溶液、氯气(氯水)、氧气、浓硫酸和硝酸等硫化氢、硫化钠、碘化钾、金属单质H2、CO、C等\n活动·探究:不同价态硫元素间的转化基本步骤:①选择代表物,确定研究的物质(如果没有,应考虑如何制备)。②选择合适的氧化剂和还原剂。③预测可能出现的现象,并实验探究。④根据现象,得出结论。\n基本原则:实验方案的筛选:原料易得操作简单易行现象明显另外在实验实施的时候,还要考虑减少污染以及尾气处理问题\n价态0+4+6SSO2H2SO3Na2SO3SO3H2SO4Na2SO4-2代表物H2SNa2S其他金属硫化物FeS\n实例1:-2→0的转化代表物:H2S氧化剂:O2、氯水、SO2制备:FeS+H2SO4=H2S↑+FeSO4\n(二)硫的氢化物――硫化氢(H2S)1、物理性质:无色、有臭鸡蛋气味的剧毒气体,可溶于水(1:2.6)。2、化学性质:(1)弱酸性:H2S是一种很弱的二元酸。试写出H2S与氢氧化钠反应的方程式:(2)还原性:-2价的S元素具有较强的还原性。2H2S+SO2=3S↓+2H2O2H2S+O2=2S↓+2H2O2H2S+3O2=2SO2+2H2O点燃点燃\nH2S可以被O2、Cl2、SO2、浓硫酸、硝酸等氧化,S2-在溶液中与硝酸、次氯酸根、高锰酸根等强氧化性物质不能大量共存。\n实例2:+4→0、+4→+6的转化代表物:SO2氧化剂:O2、氯水、酸性KMnO4溶液、硝酸制备:Na2SO3+H2SO4(浓)=SO2↑+Na2SO4+H2O还原剂:H2S\n(三)硫的氧化物——二氧化硫的性质1、物理性质:无色、有刺激性气味的有毒气体,易溶于水(1:40)。2、化学性质①酸性氧化物的通性。SO2+H2O=H2SO3(亚硫酸)试写出SO2与氢氧化钠溶液反应的方程式亚硫酸是一种二元弱酸,但酸性比碳酸强\n②氧化性:SO2具有弱的氧化性,能把-2价的硫氧化成硫单质。如:把H2S气体通入亚硫酸中,会出现浑浊现象。2H2S+SO2=3S↓+2H2O③还原性:知道:在溶液中SO2或SO32-易被Cl2、硝酸、次氯酸、高锰酸根等氧化生成硫酸。2SO2+O22SO3催化剂△SO2+Cl2+2H2O2HCl+H2SO4\n④漂白性SO2能使品红等有色物质褪色但加热后又恢复原来的颜色。(用于检验SO2)品红是一种红色的有机物质,SO2可使品红溶液褪色。原因:SO2与品红结合成不稳定的无色物质。\n1、如何鉴别SO2与CO2?你有几种方法?2、如何除去CO2中的SO2?你有几种方法?交流·讨论