- 302.00 KB
- 2022-08-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
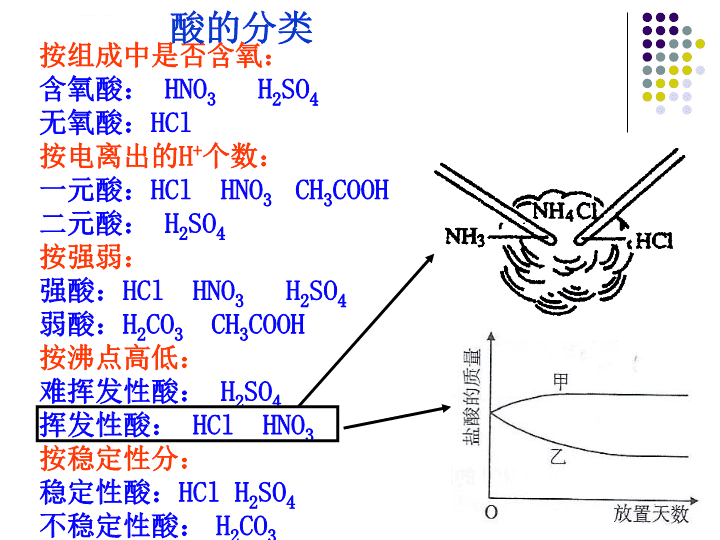
初高中化学知识衔接题目\n已知磷酸、醋酸、硼酸按顺序酸性由强变弱,请根据下列事实,作出推断。A.磷酸和醋酸钠反应可制得醋酸;B.醋酸和硼酸钠反应可制得硼酸;C.硼酸不能和醋酸钠反应制得醋酸。(1)由上述资料,可以分析得出的结论是:一般的说,_____(填“强酸”、“弱酸”,下同)可以和______盐发生反应而生成酸,反之则不能;(2)用上述结论解释二氧化碳通入氯化钙溶液中无碳酸钙沉淀生成的原因__________________。(3)已知醋酸可以和碳酸钠反应生成二氧化碳气体,而硼酸不和碳酸钠反应。请指出碳酸在上述三种酸中的位置,排出正确的顺序_______________。强酸+弱酸盐=弱酸+强酸盐\n按组成中是否含氧:含氧酸:HNO3H2SO4无氧酸:HCl按电离出的H+个数:一元酸:HClHNO3CH3COOH二元酸:H2SO4按强弱:强酸:HClHNO3H2SO4弱酸:H2CO3CH3COOH按沸点高低:难挥发性酸:H2SO4挥发性酸:HClHNO3按稳定性分:稳定性酸:HClH2SO4不稳定性酸:H2CO3酸的分类\n可溶性碱:微溶性碱:Ca(OH)2难溶性碱:Mg(OH)2Fe(OH)3Cu(OH)2(能溶解于酸中)强碱:NaOHKOHBa(OH)2弱碱:Cu(OH)2Fe(OH)3NH3·H2O碱碱NaOHKOHBa(OH)2NH3·H2O挥发性碱碱的分类\n由组成分由溶解性分盐正盐:NaClNa2SO4酸式盐:NaHCO3、Na2HSO4碱式盐:Cu2(OH)2CO3可溶性盐:Na2SO4KNO3NH4Cl难溶性盐:BaSO4AgClCaCO3BaSO4AgCl既不溶于水也不溶于酸的白色沉淀盐的分类\n两种溶液混合,生成了一种沉淀。用酸碱盐的知识回答下列问题。(1)若两种溶液均为无色,生成的白色沉淀不溶于稀硝酸,则两种溶液中的溶质可能是和;(2)若两种溶液均为无色,生成的白色沉淀溶于稀硝酸且有气体产生,则两种溶液中的溶质可能是和;(3)若一种溶液有色,另一种无色,生成的沉淀溶于稀盐酸且无气体产生,沉淀可能是。\n氧化物酸性氧化物:只能和碱反应生成盐和水的氧化物。(大部分为非金属氧化物)如CO2SO2P2O5碱性氧化物:只能和酸反应生成盐和水的氧化物。(均为金属氧化物)如Na2OCaOFe2O3CuO非金属氧化物:CO2SO2金属氧化物:Na2OCaO氧化物氧化物的分类\n过量的铁粉与稀盐酸反应,实验时观察到有气泡产生,溶液由无色变成浅绿色。(1)写出反应的化学方程式_______;(2)反应后溶液中主要含有Cl-、___、___(填粒子符号)(3)从资料中得知:溶液的颜色通常是由溶液中的粒子决定的。由此你认为该反应后溶液呈浅绿色是由___(填粒子符号)表现出来的,验证的实验方案或事实是______。盐的解离\n酸性氧化物和碱性氧化物的性质(1)酸性氧化物+水→含氧酸:CO2+H2O=H2CO3(2)酸性氧化物+碱→盐+水:CO2+2NaOH=Na2CO3+H2O(3)酸性氧化物+碱性氧化物→盐:CO2+CaO=CaCO3(4)碱性氧化物+水→碱:Na2O+H2O=2NaOH(5)碱性氧化物+酸→盐+水:Na2O+2HCl=NaCl+H2O\n小梅同学学习了单质、氧化物、酸、碱、盐性质后,发现许多不同类别的物质反应时能生产盐,于是她构建了下图所示的知识网络,请你把图中①②处补充完整,要求不能与图中已有信息重复。酸+盐金属+盐\n常见的有颜色的物质
——————————————淡黄色固体S硫棕黄色溶液Fe3+红色固体Cu、Fe2O3、红磷红色溶液碱的酚酞溶液酸的石蕊溶液黑色固体C、MnO2、Fe3O4、CuO、FeO白色沉淀BaSO4AgClBaCO3CaCO3紫黑色固体KMnO4紫色溶液MnO4-绿色固体Cu2(OH)2CO3浅绿色溶液Fe2+\n下列物质能共存于同一溶液中,且无色透明的是A.NaOH、NaNO3、K2SO4B.CuSO4、MgSO4、KClC.Ba(OH)2、H2SO4、NaClD.NaCl、AgNO3、HNO3下列各组物质能在同一溶液中大量共存的是A.NaClHClMgSO4Cu(NO3)2B.AgNO3NaClMg(NO3)2NaOHC.Ca(OH)2NaNO3Na2CO3NH4ClD.HClK2SO4NaOHNaNO3物质的共存\n下列各组离子在溶液中一定能大量共存的是A.H+、Cl-、OH-B.H+、SO42-、HCO3-C.Ba2+、H+、SO42-D.Cu2+、Cl-、N03-下列各组离子在水溶液中能大量共存的是A.Fe2+、Ca2+、CO32、OH-B.Na+、SO42-、Cl-、OH-C.Ba2+、H+、Cl-、OH-D.Ag+、NH4+、NO3-、OH-\n下列离子能在pH=2的无色溶液中大量共存的是A.SO42-、Fe3+、Na+、OH-B.K+、SO42-、Cu2+、NO3-C.Cl-、K+、SO42-、Na+D.Ca2+、Cl-、CO32-、Na+\n某废液可能含有这8种离子中的几种:H+、SO42-、Ba2+、NO3-、Na+、OH-、K+、CO32-。废液的pH为12,显碱性,所在一定不存在的一种离子是____;有三种离子在任何条件下都会存在,它们是NO3-、K+和____。[猜想]:甲同学:另外,可能还含有SO42-、CO32-乙同学:另外,可能还含有Ba2+丙同学:另外,可能还含有Ba2+、SO42-、CO32-以上甲、乙、丙三位同学的假设中,_____同学的假设一定不成立,原因是________。[实验验证]:选择其中一种可能成立的假设,设计实验进行验证。我选择______同学的假设,实验方案如下:离子共存\n在经济建设中,我们要走发展与环保并重的可持续发展道路,某化工厂有甲、乙两个车间,排出的废水澄清透明,分别含有三种不同的离子,它们可能是K+、Ba2+、Cu2+、OH-、NO3-、CO32-中的三种。已知甲车间废水明显显碱性,则乙车间水中肯定含有的阴离子是;将甲、乙两车间的废水按适当的比例混合,可以变废为宝,即可以使废水中的Ba2+、Cu2+、OH-等离子转化为沉淀除去,又可以用上层清液来浇灌农田。则清液中含有的溶质主要是(填化学式)。离子共存\n在氧化还原反应中,反应前后元素化合价变化有规律:有的元素化合价升高,有的元素化合价会降低。如:H2+CuO=Cu+H2O中,氢元素的化合价由反应前的0价升高为变化后的+1价,但铜元素的化合价却由反应前的+2价降低为0价。(1)在反应3CO+Fe2O3=2Fe+3CO2中,化合价升高的元素为;(2)已知钠与水在常温下可发生氧化还原反应。甲、乙两同学对该反应的生成物有不同观点,甲同学认为生成物为氢氧化钠和氢气,乙同学认为生成物为氢氧化钠和氧气。请结合化合价变化的规律书写出正确的反应方程式,该反应的基本类型为。\n化合价升高化合价降低2Na+2H2O==2NaOH+0+1+1H2↑?能力培养的衔接\n在化学反应前后,物质所含元素化合价发生变化的反应是氧化还原反应,它与化学反应基本类型间的关系如图所示,下列示例中错误的是A阴影1:C+O2=CO2B阴影2:2H2O=2H2↑+O2↑C阴影3:Mg(OH)2+2HCl=MgCl2+2H2OD阴影4:Fe+CuSO4=FeSO4+Cu