- 1.11 MB
- 2022-08-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
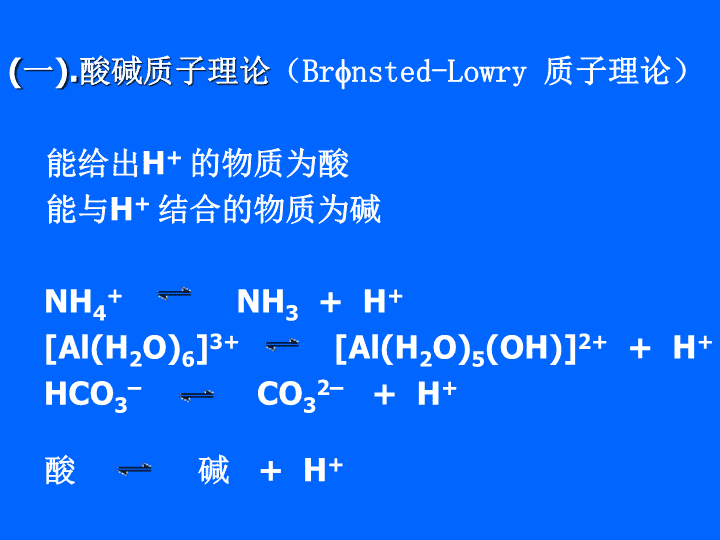
酸碱电离平衡\n一.酸碱理论Arrhenius(阿仑尼乌斯)1887年酸碱电离理论:凡是在水溶液中能够电离产生的阳离子全部都是H+的化合物叫酸(acid);电离时产生的阴离子全部是OH的化合物叫碱(base)局限:无法解释NaCO3,Na3PO4呈碱性;NH4Cl现酸性的事实;无法解释非水溶液中的酸碱行为液氨中:NH4++NH2-=2NH3\n(一).酸碱质子理论(Brnsted-Lowry质子理论)能给出H+的物质为酸能与H+结合的物质为碱NH4+NH3+H+[Al(H2O)6]3+[Al(H2O)5(OH)]2++H+HCO3–CO32–+H+酸碱+H+\n2.酸碱电离平衡(质子理论)酸H++碱共轭关系共轭酸共轭碱HClH++Cl–酸在水中的电离(酸碱必须同时存在)HCl+H2OH3O++Cl–(全部)酸1碱2酸2碱1NH4++H2OH3O++NH3(可逆)酸1碱2酸2碱1H+H+H+H2CO3-HCO3-;HCO3--CO32-H3PO4-H2PO4-;H2PO4--HPO42-;HPO42--PO43-\n2.酸碱电离平衡(质子理论)碱在水中的电离(酸碱必须同时存在)Ac–+H2OHAc+OH–(可逆)碱1酸2酸1碱2酸碱反应H+“有酸才有碱,有碱才有酸酸中有碱,碱可变酸”(酸碱相互依存和转化)\n3.酸碱的强弱取决于(1)酸碱本身释放质子和接受质子的能力(2)溶剂接受和释放质子的能力例如:HAc在水中为弱酸,但在液氨中为强酸(拉平效应)HCl、HBr、HI在水中电离无区别,但在甲醇中电离能力明显不同(区分效应)酸碱的强弱用Ka(电离平衡常数)来表征如:\n(二)、Lewis的酸碱电子理论1.Lewis的酸碱电子理论的提出质子理论无法解释:如SnCl4、AlCl3等的酸碱性行为2.理论要点:凡可以接受电子对的分子、原子团、离子为酸(electronpairacceptor);凡可以给出电子对的物质为碱(electronpairdonor)。\n3.酸碱反应的实质:酸碱反应的实质是形成配位键的反应;碱提供电子对,酸以空轨道接受电子对形成配位键。H++:OH–HOHAlCl3+Cl–AlCl4–Cu2++4:NH3Cu2+4(NH3)4.Lewis的电子理论有关酸、碱的划分凡金属阳离子及缺电子的分子都是酸;凡与金属离子结合的阴离子或中性分子都是碱。\n5.Lewis的酸碱电子理论的优缺点:优点:一切化学反应都可概括为酸碱反应缺点:太笼统,不易掌握酸碱的特性无法判断酸碱性的强弱\n(三)、软硬酸碱理论硬酸:半径小,电荷高的离子如碱土金属离子和Ti4+,Fe3+,Al3+,Ln3+等软酸:半径大,电荷低的离子如Ag+,Pt2+,Hg2+等硬碱:半径小,变形小的阴离子如F–,O2–等软碱:半径大,变形大的阴离子如I–,Br–ClO4–等优点:①比电子理论更广泛的范围②可以解释化合物的稳定性规则:硬亲硬,软亲软\n\n\n配合物的形成规律生成稳定配合物反应速度快生成物不稳定或不能形成,反应速度慢Bi3+(交界酸)+6Br-(交界碱)BiBr63-Cu2+(交界酸)+4NH3(硬碱)Cu(NH3)42+Pd2+(软酸)+4Br-(交界碱)PdBr42-生成物较稳定反应速度适中\n例用软硬酸碱理论解释配位离子的稳定性次序(1)HgI42->HgBr42->HgCl42->HgF42-(2)AlF63->AlCl63->AlBr63->AlI63-解Hg2+为软酸,而从I-至F-半径减小,从软碱向硬碱过渡,HgI42-更稳定。Al3+为硬酸,从F-至I-半径依次增大,从硬碱向软碱过渡,AlF63-更稳定。\n对配合物中异性双基配位体(SCN-、CNO-、CN-)配位原子选择的解释:O、N——硬碱[Fe-(NCS)6]3-[Ta-(NCS)6]-C、S——软碱[Hg-(SCN)4]2-[Cd-(SCN)4]2-异双核配合物:Hg-(SCN)4-Co\n判断溶解度AlF3AgCl>AgBr>AgI酸的硬度:Ba2+>Fe2+>Hg2+BaS>FeS>HgSH2O含有电负性高的氧原子,是一种硬碱,但介于F-与其它卤素离子之间,碱的硬度:F->Cl->Br->I-而卤化银中Ag+是软酸,与Cl-、Br-、I-键合较水强,这些盐溶解度就小,但Ag+与F-键合较水弱,AgF溶解度就大。\n8-1-2水的解离平衡和溶液的pH1水的离子积常数平衡常数表达式KӨ=[H+][OH-],称其为水的离子积常数,经常用KwӨ表示。常温下KwӨ=1.0×10–14。KwӨ与反应的ΔrGmӨ有关系,由KwӨ可求得上述反应的ΔrGmӨ值。rGmӨ=-79.87kJ·mol-1H2O+H2OH3O++OH-或H2OH++OH-\n2溶液的pHpH=-lg[H+]pOH=-lg[OH-]因为常温下:KwӨ=[H+][OH-]=1.0×10–14故常温下有:pH+pOH=14但当某温度下,水的离子积常数KwӨ不等于1.0×10–14,pKwӨ不等于14时,中性溶液中pH=pOH,但都不等于7。pH=pOH是中性溶液的根本标志。\n8-1弱酸和弱碱的解离平衡8-1-1一元弱酸、弱碱的解离平衡1解离平衡常数醋酸CH3COOH(经常简写做HAc)溶液中存在着平衡:或:HAc+H2OH3O++Ac-HAcH++Ac-\n其平衡常数表达式可写成:式中Ka是酸式解离平衡常数,[H+]、[Ac-]和[HAc]分别表示H+、Ac-和HAc的平衡浓度。Ө若用c0表示醋酸溶液的起始浓度,则有:ӨӨ\n当电离平衡常数K很小,酸的起始浓度c0较大时,则有c0≫[H+],于是上式可简化成:适用条件:c0>400KaӨ;一元弱酸体系。Ө所以:Ө\n作为弱碱,氨水也发生部分解离,存在下列平衡:其解离平衡常数可表示为:式中KbӨ是弱碱的解离平衡常数,c0表示碱的起始浓度,[OH-]代表平衡时体系中OH-的浓度。NH3·H2ONH4++OH-KbӨ当c0>400KbӨ时,有Ө\nKaӨ,KbӨ值越大,表示弱酸、弱碱解离出离子的趋势越大。一般把KaӨ小于10-2的酸称为弱酸。一元弱酸一元弱碱HClO2.9×10–8(CH3)2NH5.9×10–4HF6.3×10–4C6H5NH24.0×10–10HNO27.2×10–4C5H5N1.5×10–9KaӨKbӨKaӨ,KbӨ与温度有关。但由于弱电解质解离过程的热效应不大,所以温度变化对二者影响较小。\n2解离度弱酸、弱碱在溶液中解离的程度可以用解离度a表示,HAc的解离度a表示平衡时已经电离的醋酸的浓度与醋酸起始浓度之比,即:NH3·H2O的解离度为:ӨӨӨ\n例:a)计算0.10mol·dm–3HAc溶液的[H+]和解离度;b)计算1.0×10–3mol·dm–3NH3·H2O的[OH-]和解离度。已知HAc的KaӨ=1.8×10–5,NH3·H2O的KbӨ=1.8×10–5平衡常数KaӨ和KbӨ不随浓度变化,但作为转化百分数的解离度a,却随起始浓度的变化而变化。起始浓度c0越小,解离度a值越大。解离度a经常用百分数表示。\n其中x表示平衡时已解离的HAc的浓度各物质的平衡相对浓度0.10-xxx各物质的起始相对浓度0.1000即c0>400KaӨ,有0.10-x≈0.10,可以近似计算:解:a)反应方程式HAcH++Ac-平衡常数的表达式为Ө由于a)中Ө\n故[H+]=1.34×10–3mol·dm–3电离度若不采用近似计算,而将平衡常数的值代入其表达式中,则有:ӨӨ\n解一元二次方程得x=1.33×10–3即[H+]=1.33×10–3mol·dm–3解离度各物质的起始相对浓度1.0×10–300各物质的平衡相对浓度1.0×10–3-yyy其中y表示平衡时已解离的NH3·H2O的浓度b)反应方程式NH3·H2ONH4++OH-\n不能近似计算,将c0=1.0×10–3mol·dm–3和KbӨ=1.8×10–5代入平衡常数表示式中:解一元二次方程得[OH-]=1.25×10–4mol·dm–3解离度ӨӨ\n若用近似计算:与前面计算结果比较,计算误差较大。Ө\n8-1-3多元弱酸的解离平衡多元酸在水中是分步电离的,以氢硫酸的解离为例:H2SH++HS-HS-H++S2-ӨӨ\n在常温常压下,H2S气体在水中的饱和浓度约为0.10mol·dm–3,据此可以计算出H2S的饱和溶液中的[H+]、[HS-]和[S2–]。设平衡时已解离的氢硫酸的浓度为x,则[H+]、[HS-]近似等于x,而[H2S]=0.10-x≈0.10mol·dm–3起始浓度:0.1000平衡浓度:0.10xxH2SH++HS-\n解得x=1.05×10–4故[S2-]=1.3×10–13mol·dm–3即[H+]≈[HS-]=1.05×10–4mol·dm–3第二步电离平衡HS-H++S2-ӨӨ\n对二元弱酸H2S来说,溶液的[H+]由第一级电离决定,故比较二元弱酸的强弱,只须比较其第一级电离常数K1Ө即可。HS-的第二步解离极小可以被忽略,即[HS-]≈[H+]而且[S2–]=K2Ө如果将K1Ө和K2Ө的表达式相乘,即可得到H2S2H++S2–\n其平衡常数KӨ的表达式为:从二元弱酸H2S的讨论中可得到以下结论:⑶负二价酸根[S2–]等于第二级电离常数K2Ө。⑴溶液的[H+]由第一级电离决定;⑵负一价酸根[HS–]等于体系中的[H+];上述结论完全适用于一般的二元弱酸和二元中强酸。必须注意的是,对于二元酸与其它物质的混合溶液,以上结论一般不适用。Ө\n例:a)求0.010mol·dm–3的H2S溶液中H+、HS-、S2–及H2S的浓度。b)若向上述溶液中加几滴浓盐酸,使其浓度达到0.010mol·dm–3,求溶液中S2–的浓度。H2S的解离平衡常数K1Ө=1.1×10–7K2Ө=1.3×10–13解:a)H2S的起始浓度c0=0.010mol·dm–3,其[H+]由第一步电离决定。起始浓度:0.01000平衡浓度:0.010xxH2SH++HS-\n解得x=3.32×10–5即[H+]=[HS-]=3.32×10–5mol·dm–3故[S2–]=1.3×10–13mol·dm–3第二步电离平衡HS-H++S2-ӨӨ\nb)盐酸完全解离,体系中[H+]=0.010mol·dm–3,在这样的酸度下,已解离的[H2S]以及H2S解离出的[H+]均可以忽略不计。设[S2-]为y,则平衡浓度:0.010.010yy=1.4×10–18即[S2–]=1.4×10–18mol·dm–3H2S2H++S2–ӨӨӨ\n计算结果表明,由于0.010mol·dm–3的盐酸存在,使[S2–]降低至原来的9.3×104分之一,可见同离子效应的影响之大。和二元酸相似,三元酸也是分步电离的,由于K1Ө,K2Ө,K3Ө相差很大,三元酸的[H+]也以认为是由第一步电离决定的;负一价酸根离子的浓度等于体系中的[H+];负二价的酸根离子的浓度等于第二级电离常数K2Ө。\n例:已知H3PO4的各级电离常数K1=7.1×10–3,K2=6.3×10–8,K3=4.8×10–13。求H3PO4的起始浓度c0多大时,体系中PO43-的浓度为4.010-18mol·dm-3。Ө解:因为K1>>K2>>K3,体系中的[H+]由H3PO4的第一步解离决定。ӨӨӨ起始浓度:c000平衡浓度:c0-[H+][H+][H+]H3PO4H++HPO4-\n平衡常数表达式为:第三步电离平衡常数表达式为:HPO42-H++PO43-ӨӨӨ\n所以Ө式中ӨӨӨ\n3同离子效应若在HAc溶液中加入一些NaAc,NaAc在溶液中完全解离,于是溶液中Ac-离子浓度增加很多,使醋酸的解离平衡左移,从而降低HAc的电离度。例:如果在0.10mol·dm–3的HAc溶液中加入固体NaAc,使NaAc的浓度达0.20mol·dm–3,求该HAc溶液的[H+]和解离度a。起始浓度0.1000平衡浓度0.10-xx0.20+x解:HAcH++Ac-\n将各平衡浓度代入平衡常数表达式:由于c0/KbӨ≫400,同时可认为0.20+x≈0.20,0.10-x≈0.10。故平衡常数表达式变为:ӨӨӨ\n即[H+]=9.0×10–6mol·dm–3解离度与前面计算结果α=1.33%相比,加入强电解质后,解离度α缩小了149倍。上述计算结果说明:在弱电解质的溶液中,加入与其具有共同离子的强电解质,使弱电解质的解离平衡左移,从而降低弱电解质的解离度。这种影响叫做同离子效应。\n3酸碱指示剂借助于颜色的改变来指示溶液pH的物质叫做酸碱指示剂。酸碱指示剂通常是一种复杂的有机物,并且都是弱酸或弱碱。酸分子HIn显红色,酸根离子In-显黄色,当[HIn]和[In-]相等时溶液显橙色。例如甲基橙指示剂就是一种有机弱酸:HInH++In-其平衡常数表达式为:Ө\n可化成:式中KiӨ是指示剂的解离常数。可以看出,当[H+]=KiӨ,即pH=pKi时,溶液中[In-]=[HIn],这时溶液显HIn和In-的中间颜色,例如甲基橙的橙色。故将pH=pKiӨ称为指示剂的理论变色点。当[HIn]∕[In-]≥10时,明确显示HIn的颜色;对于一般指示剂:当[In-]∕[HIn]≥10时,明确显示In-的颜色。Ө\n指示剂变色范围pH酸色碱色甲基橙3.24.4红黄溴酚蓝3.04.6黄蓝溴百里酚蓝6.07.6黄蓝中性红6.88.0红亮黄酚酞8.210.0无色红达旦黄12.013.0黄红把这一pH间隔称为指示剂的变色间隔或变色范围。存在关系式:Ө\n8-1-4缓冲溶液缓冲溶液是一种能抵抗少量强酸、强碱和水的稀释而保持体系的pH基本不变的溶液。缓冲作用的原理与前面讲过的同离子效应有密切的关系。缓冲溶液一般是由弱酸和弱酸盐组成或由弱碱和弱碱盐组成的。例如HAc和NaAc,NH3·H2O和NH4Cl,以及NaH2PO4和Na2HPO4等都可以配制成保持不同pH值的缓冲溶液。\n例:以HCN和NaCN构成的缓冲溶液溶液中存在起始浓度为c酸的弱酸的解离平衡,由于起始浓度为c盐的强电解质弱酸盐NaCN的存在,故平衡时各物质的浓度如下:平衡浓度:c酸-xxc盐+x由于同离子效应,近似有c酸-x≈c酸,c盐+x≈c盐HCNH++CN-故Ө\n上式说明:混合溶液的pH首先决定于弱酸的Ka值,其次决定于弱酸和弱酸盐的浓度之比。这种溶液就是缓冲溶液。Ө取负对数Ө故有Ө\n例:缓冲溶液中有1.00mol·dm–3的HCN和1.00mol·dm–3的NaCN,试计算1)缓冲溶液的pH;2)将10.0cm31.00mol·dm–3HCl溶液加入到1.0dm3该缓冲溶液中引起的pH变化;3)将10.0cm31.00mol·dm–3NaOH溶液加入到1.0dm3该缓冲溶液中引起的pH变化;4)将1.0dm3该溶液加水稀释至10dm3,引起的pH变化。\n平衡浓度:x2)在1.0dm3缓冲溶液中,含HCN和NaCN各是1.0mol,加入的HCl相当于0.01molH+,它将消耗0.01mol的NaCN并生成0.01molHCN,故有:HCNCN-+H+解:1)根据Ө\n相对而言,若将10.0cm31.00mol·dm–3HCl溶液加入到1.0dm3纯水中,pH将从7变化为2。根据:Ө\n3)在1.0dm3缓冲溶液中,含HCN和NaCN各是1.0mol,加入的NaOH相当于0.01molOH-,它将消耗0.01mol的HCN并生成0.01molCN-离子,故有平衡浓度:yHCNCN-+H+根据Ө\n相对而言,若将10.0cm31.00mol·dm–3NaOH溶液加入到1.0dm3纯水中,pH将从7变化为12。\n4)将1.0dm3该缓冲溶液加水稀释至10.0dm3时,c酸和c盐的数值均变化为原来的十分之一,但两者的比值不变。根据故该缓冲溶液的pH不变。缓冲溶液中发挥作用的的弱酸和弱酸盐(或弱碱和弱碱盐)称为缓冲对。缓冲对的浓度越大,当加入强酸或强碱时其浓度值及其比值改变越小,即抵制酸碱影响的作用越强。Ө\n缓冲对的浓度越大,缓冲溶液的缓冲容量越大。配制缓冲溶液时,要先找出与溶液所要控制的pH值相当的pKaӨ值的弱酸,再与该弱酸的强碱盐按一定的比例配成浓度合适的溶液。当c酸/c盐的值从0.1变化到10时,则缓冲溶液的pH在p±1之间变化。若用弱碱和弱碱盐配成缓冲溶液,其公式则可写成ӨӨ\n所以:例:用NH3·H2O和NH4Cl配制pH=10的缓冲溶液,求比值c碱/c盐。解:弱碱NH3·H2O的Kb=1.8×10–5,pH=10的缓冲溶液,其pOH=4,Ө根据:Ө故:Ө\n8-2盐的水解8-2-1水解平衡常数1弱酸强碱盐以NaAc溶于水生成的溶液为例,可以写出NaAc的水解平衡式:水解的结果使得溶液中[OH-]>[H+],NaAc溶液显碱性。Ac-+H2OHAc+OH-\n平衡常数表达式为:Kh是水解平衡常数。在上式的分子分母中各乘以平衡体系中的[H+],上式变为ӨӨӨӨӨ即ӨӨӨ\n弱酸强碱盐的水解平衡常数Kh等于水的离子积常数与弱酸的电离平衡常数的比值。Ө由于盐的水解平衡常数相当小,故计算中可以采用近似的方法来处理。NaAc的水解平衡常数:ӨӨӨ\n2强酸弱碱盐以NH4Cl为例,其水解平衡式为:NH4+和OH-结合成弱电解质,使H2O的电离平衡发生移动,结果溶液中[H+]>[OH-],溶液显酸性。可以推出强酸弱碱盐水解平衡常数Kh与弱碱的Kb之间的关系如下:ӨӨNH4++H2ONH3·H2O+H+ӨӨӨ\n3弱酸弱碱盐以NH4Ac为例,其水解平衡式可写成:平衡常数表达式为:HN4++Ac-+H2ONH3·H2O+HAcӨ\nNH4Ac的水解平衡常数Kh:Ө即与NaAc的Kh和NH4Cl的Kh相比,NH4Ac的水解平衡常数扩大了1.0×105倍。显然NH4Ac的双水解的趋势要比NaAc或NH4Cl的单方向水解的趋势大得多。ӨӨӨӨӨӨӨӨӨӨ\n可见影响水解平衡常数的一个重要的因素,即生成盐的酸碱越弱,即Ka、Kb越小,则盐的水解平衡常数Kh越大。ӨӨӨ综合以上结论:ӨӨ例如:NaAc和NaF同为弱酸强碱盐,由于HAc的Ka小于HF的Ka,故当NaAc溶液和NaF溶液的浓度相同时,NaAc的水解程度要大于NaF。ӨӨӨӨӨӨӨӨӨӨ\n盐的水解一般是吸热过程,ΔH>0,由公式可知,当温度升高时平衡常数Kh增大,因此升高温度可以促进水解的进行。例如FeCl3的水解,常温下反应并不明显,加热后反应进行得较彻底,颜色逐渐加深,生成红棕色沉淀。ӨӨ\n8-2-1水解度和水解平衡的计算1单水解过程的计算NaAc水解反应的方程式如下:起始浓度:c000平衡浓度:c0-xxxAc-+H2OHAc+OH-ӨӨӨ\nKh很小,近似有[Ac-]≈c0Ө若用弱酸的电离平衡常数表示,上式则变为:Ө解得Ө即ӨӨӨ\n水解反应的程度用水解度h表示:用弱酸的电离平衡常数表示,可写成:同理可推导出弱碱的水解度表达式:ӨӨӨӨӨӨӨӨ\n例:求0.10mol·dm–3NH4Cl溶液的pH和水解度。故pH=5.13水解度解:ӨӨӨӨӨ\n可以看出,当水解平衡常数Kh一定时,盐的起始浓度c0越小,水解度h越大,即稀溶液的水解度比较大。Ө这一结果也可以从平衡移动的角度得出。一定浓度的NH4Cl溶液达到水解平衡时,有关系式:ӨӨ\n将溶液加水稀释,体积变成原来的10倍,于是各物质的浓度均变成原来的1/10,此时的Qc可以表示为:即Qc<Kh,平衡要向继续水解的方向移动,故稀释时盐的水解度增大。ӨӨӨ\n水解度盐的水解会使溶液的酸度改变,根据平衡移动的原理,可以通过调解溶液的酸度来控制盐的水解。与未稀释前相比,可以看出稀溶液的水解度增大。例如,实验室配制SnCl2溶液,用盐酸来溶解SnCl2固体,原因就是用酸来抑制Sn2+的水解。\n2双水解过程的计算在这里我们只研究由一元弱酸HA和一元弱碱MOH生成的弱酸弱碱盐MA溶液的[H+]。将MA溶于H2O中,阳离子M+和酸根阴离子A-起始浓度均为c0两个水解反应同时达到平衡M++H2OM(OH)+H+A-+H2OHA+OH-\n有1个M(OH)生成,则产生1个H+;而有一个HA生成则有1个OH-去中和一个H+。故[H+]=[MOH]-[HA](1)M+的水解平衡常数表达式为ӨӨӨ由此可得出(2)ӨӨ\nA-的水解平衡常表达式为由此可得出将(2)和(3)代入(1)中:ӨӨӨ(3)ӨӨӨӨӨӨ\n将上式两边分别乘以KaKb[H+],得ӨӨ当Ka与c0相比很小时,[M+]和[A-]的水解程度极小,近似有Ө[M+]≈[A-]≈c0ӨӨӨӨӨ整理得:ӨӨӨӨӨӨӨӨ\n当c0≫Ka时,近似有Ka+c0≈c0Ө可见弱酸弱碱盐水溶液的[H+]与盐溶液的浓度无直接关系。但该式成立的前提是Ka与c0相比很小且c0≫Ka,所以盐的起始浓度c0不能过小。ӨӨ对0.1mol·dm–3NH4Ac溶液,由KaӨ=KbӨ=1.8×10–5,可知[H+]=1.0×10-7mol·dm–3,即溶液显中性。但当Ka和Ka不相等时,溶液则不显中性。ӨӨӨ\npH=6.23因为Ka比Kb大,故弱碱的水解程度比弱酸的水解程度大些,故溶液中[H+]>[OH-],溶液显酸性。ӨӨ例:求0.10mol·dm–3的NH4F溶液的pH。解:ӨӨӨ