- 185.17 KB
- 2022-08-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
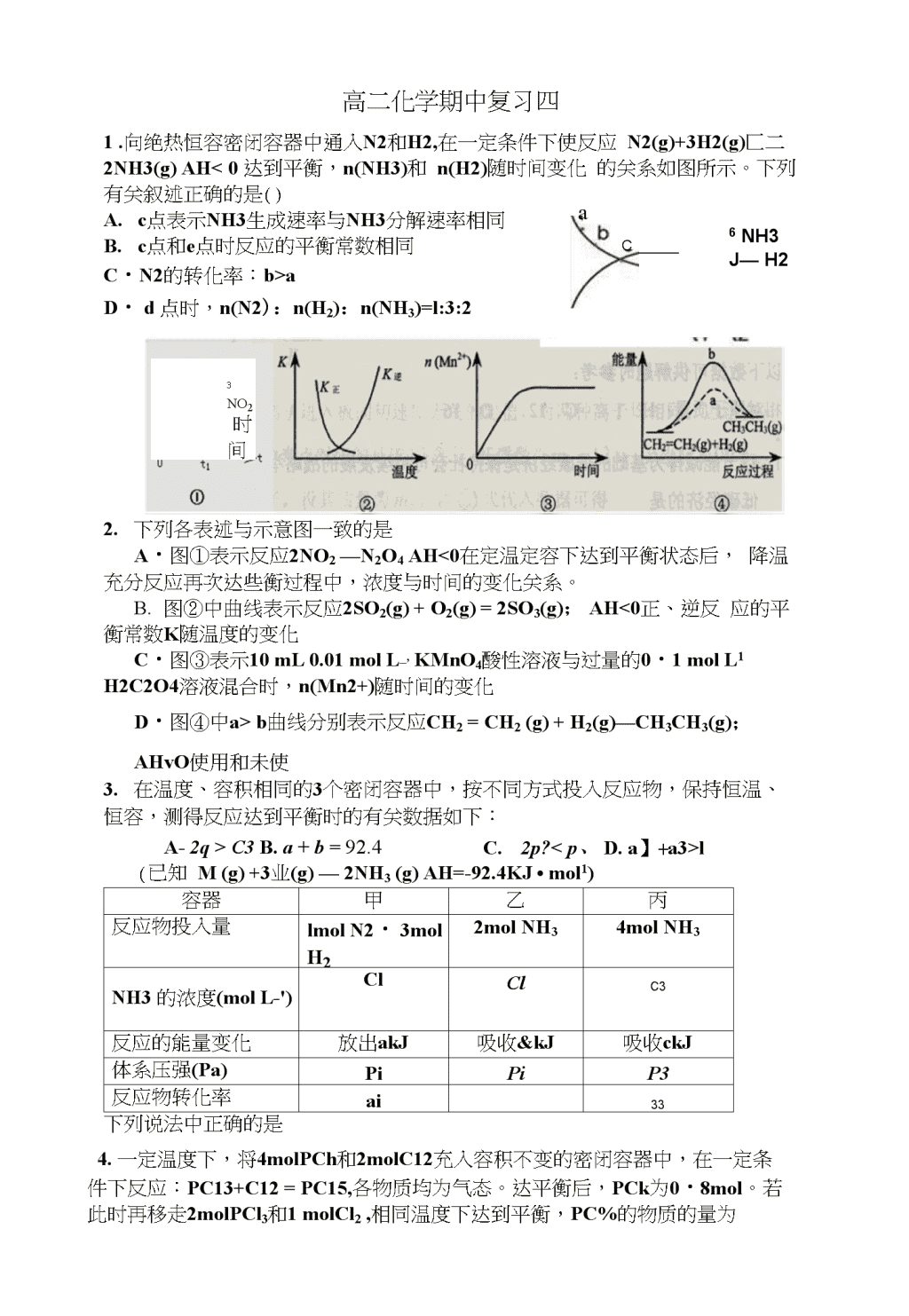
aC6NH3J—H23no2时间高二化学期中复习四1.向绝热恒容密闭容器中通入N2和H2,在一定条件下使反应N2(g)+3H2(g)匚二2NH3(g)AH<0达到平衡,n(NH3)和n(H2)随时间变化的关系如图所示。下列有关叙述正确的是()A.c点表示NH3生成速率与NH3分解速率相同B.c点和e点时反应的平衡常数相同C・N2的转化率:b>aD・d点时,n(N2):n(H2):n(NH3)=l:3:22.下列各表述与示意图一致的是A・图①表示反应2NO2—N2O4AH<0在定温定容下达到平衡状态后,降温充分反应再次达些衡过程中,浓度与时间的变化关系。B.图②中曲线表示反应2SO2(g)+O2(g)=2SO3(g);AH<0正、逆反应的平衡常数K随温度的变化C・图③表示10mL0.01molL_,KMnO4酸性溶液与过量的0・1molL1H2C2O4溶液混合时,n(Mn2+)随时间的变化D・图④中a>b曲线分别表示反应CH2=CH2(g)+H2(g)—CH3CH3(g);AHvO使用和未使3.在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下:A-2q>C3B.a+b=92.4C.2p?l(已知M(g)+3业(g)—2NH3(g)AH=-92.4KJ•mol1)容器甲乙丙反应物投入量lmolN2・3molh22molNH34molNH3NH3的浓度(molL-')ClClC3反应的能量变化放出akJ吸收&kJ吸收ckJ体系压强(Pa)PiPiP3反应物转化率ai33下列说法中正确的是4.一定温度下,将4molPCh和2molC12充入容积不变的密闭容器中,在一定条件下反应:PC13+C12=PC15,各物质均为气态。达平衡后,PCk为0・8mol。若此时再移走2molPCl3和1molCl2,相同温度下达到平衡,PC%的物质的量为\nA-0-8molB-0.4molC.0>4mol4mol\n5、有反应4HCl(g)+€>2仗)一2C12(g)+2H2O(g),已知2molO2被还原时,放出akJ的热量,且知断开1mol0—0键需要吸收bkJ的热量,断开1molCI—CI键需要吸收ckJ的热量。则断开1molH—O键比断开1molH—Cl键所需能量高()b——a——2ca+2方——4cA.:kJB.okJC・吐护kJ6•在700°C时,向容积为2L的密闭容器中充入一定量的CO和H20,发生反应:CO(g)+H20(g)C02(g)+H2(g),反应过程中测定的部分数据见下表(表中t2>tl)o下列说法中正确的是反应时间/minn(CO)/moln(H20)/mol01.200.60tl0.20t20.80A.反应在tlmin内的平均反应速率为u(C02)=0.40/tlmol/(L•min)B・到tlmin时,反应未达到平衡状态B.温度升至800°C时,上述反应的平衡常数为0.64,则正反应为放热反应C.保持700°C不变,向平衡体系中再通入0.60molCO和0.30molH20,达到新的平衡,与原平衡相比,CO的转化率增大,H2的体积分数增大7.相同温度下,在体积相等的三个恒容密闭容器中发生可逆反N2(g)+3H2(g)2NH3(g)AH=-92kJ-mol-1。实验测得起始、平衡时的有关数据如下表:容器编号起始时各物质物质的量/mol平衡时反应中的能量变化n2h2nh3①130放出热量akJ②230放出热量bkJ③260放出热量ckJ下列叙述正确的是()A.放出热量关系:a©>(§)&如下图是Zii和Cii形成的原电池,某实验兴趣小组做完实验后,在读书卡片上记录如下,其中正确的是()①Zn为正极,Cu为负极;\n①H+向负极移动;②电子是由Zn经外电路流向Cu;③Cu极上有比产生;④若有1mol电子流过导线,则产生的H2为0.5mol;⑤正极的电极反应式为Zn-2e_===Zn2+⑥Cu电极上发生氧化反应\n⑧电流由Cu外电路流向ZnA.①②③⑦B.②③④⑧C.③④⑤⑧D.④⑤⑥⑦9.在一容积为2L的密闭容器内加入0.2mol的2和0.6mol的出,在一定条件下发生如下反应:N2(g)+3H2(g)^2NH3(g)AHV0,反应中NH3的物质的量浓度的变化的情况如下图:⑴根据上图,计算从反应开始到平衡时,平均反应速率WNH3)为(2)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为oA.0.20mol/LB・0.12mol/LC・0.10mol/LD・0.08mol/L(3)反应达到平衡后,第5分钟末,保持其它条件不变,若只把容器的体积缩小一半,平衡移动(填“向逆反应方向”、“向正反应方向”或“不”)10.煤的气化在煤化工业中占有重要地位,至今仍然是化学工业重要组成部分。(1)已知H2(g)>CO(g)和CH3OH⑴的燃烧热分别为-285.8kj/mol.-283.OkJ/mol和-726.5kJ/molo请写出CH3OH(1)完全燃烧生成二氧化碳和液态水的热化学方程式:o(2)工业上一般在恒容密闭容器中采用下列反应合成甲醇:•PW温度/T250300350K/l:・moK22.0410.2700.012CO(g)+2H2(g)CH3OH(g)AHo下表所列数据是该反应在不同温度下的化学平衡常数(K)①反应的平衡常数的表达式是,由表中数据判断AH0(填“〉”、“二”或“〈”)②某温度下,将2molC0和6molH2充入2L的密闭容器中,充分反应后,4min达到平衡时测得c(CO)=O.2mol/L,此时的温度为,则反应速率v(也)=\n=CH3()H(g)达到平衡,(1)T°C时,在时刻,合成甲醇反应CO(g)+2H2(g)若在时刻将容器的体积缩小为原来的%,在t2时刻又达到新的平衡,请在图中用曲线表示〜t2时间段氢气、甲物质的量浓度随时间变化的趋势示意图(其他条件不变,曲线上必须标明氢气、甲醇)。\n(1)如果用CfWH和空气作燃料电池,用KOH作电解质溶液,请写出该燃料电池的负极的电极反应式o10.已知2A2(g)+B2(g)=2C3(g)AH="-a,zkj>mol-l(a>0),在一个有催化剂的固定容积的容器中加入2molA2和ImolBz,在500°C时充分反应达到平衡后C3的浓度为wmol/L,放出热量bkJ;(1)比较ab(填〉、=、V);(增大、减(2)若将反应温度升高到700°C,反应的平衡常数将小或不变);(3)能说明该反应已经达到平衡状态的是a.V(C3)=2V(B2);b.容器内压强保持不变c.V逆(A2)=2V正(B2)d.容器内的密度保持不变(2)为使该反应的反应速率增大,且平衡向正反应方向移动的是a.及时分离出C3气体;b.适当升高温度;c.增大B2的浓度;d.选择高效的催化剂12・某研究小组在实验室探究氨基甲酸^(NH2COONH4)分解反应平衡常数和水解反应速率的测定。(1)将一定量纯净的氨基甲酸镀固体置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)2NH3(g)4-CO2(g).实验测得不同温度下的平衡数据列于如表:温度(°C)15.020.025.030.035.0平衡总压强(kPa)5.7&312.017.124.0平衡气体总浓度(X103mol/L)2.43.44.86.89.4①可以判断该分解反应已经达到化学平衡的是A.2v(NH3)=v(CO2)B.密闭容器中总压强不变C.密闭容器中混合气体的密度不变D.密闭容器中氨气的体积分数不变②根据表中数据,列式计算25・0°C时氨基甲酸鞍的分解平衡常数①取一定量的氨基甲酸钱固体放在一个带活塞的密闭真空容器中,在25°C下\n达到分解平衡.若在恒温下压缩容器体积,氨基甲酸鞍固体的质量(填“增加”、\n高二化学期中复习四答案8题CBBDBCAC9.(1)0-025mol/L-min(2)A、C(3)向正反应方向fc(NH3)/mol-L0.300.250.200.150.100.05°12345678910\(1)CH3OH(1)+3/202(g)二C02(g)+2H20(1)AH=—726.5kJ/mol(2)①K二c(CH30H)/c(CO)•c2(H2)略;V;(3)如图(一是氢气、甲「对应的起点必须正确;二是变化趋势要正确;三是②250°C;0.4mol/(L•min)名称标出,)(4)CH30H-6e-+80H-二C032-+6H2011、(1)>;(2)减小;(3)be;(4)Co12(1)①BC;②1.6x108(mol・LI)?;\n1■④〉;