- 412.00 KB
- 2022-08-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
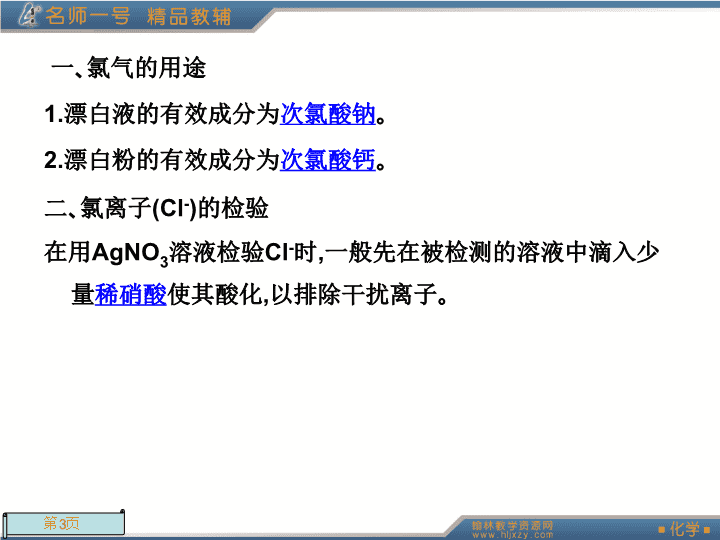
第2课时氯气的用途及Cl-的检验\n课前自主学习(学生用书P90)\n一、氯气的用途1.漂白液的有效成分为次氯酸钠。2.漂白粉的有效成分为次氯酸钙。二、氯离子(Cl-)的检验在用AgNO3溶液检验Cl-时,一般先在被检测的溶液中滴入少量稀硝酸使其酸化,以排除干扰离子。\n诱思探究:如何鉴定KClO3中含有O、Cl二元素?提示:1.在试管中加入KClO3和MnO2混合物加热,产生能使带火星木条复燃的气体,证明其中含有氧元素。2.继续加热至不再产生气体为止,取固体混合物溶解于水,过滤,取滤液滴加用HNO3酸化的AgNO3产生白色沉淀,证明有Cl-,则证明其中含有氯元素。\n课堂深化探究(学生用书P90)\n一、氯离子检验应注意的问题\n\n二、卤素单质的化学性质1.与H2反应H2+X2=2HX(X=F、Cl、Br、I)2.与H2O反应2F2+2H2O=4HF+O2↑X2+H2O=HX+HXO(X=Cl、Br、I)3.与金属反应Na、K、Ca、Mg、Al、Fe、Cu、Zn等均能与卤素单质反应。\n4.与碱溶液反应X2+2NaOH=NaX+NaXO+H2O(X=Cl、Br、I)5.卤素单质间置换反应:Cl2+2Br-=Br2+2Cl-Cl2+2I-=I2+2Cl-Br2+2I-=I2+2Br-\n6.其他有关反应X2+Na2SO3+H2O=2HX+Na2SO4(X=Cl、Br、I)X2+2Fe2+=2Fe3++2X-(X=Cl、Br)特别提示:①2F2+2H2O=4HF+O2,F2作氧化剂,水作还原剂。②由卤素单质的相互置换知氧化性:F2>Cl2>Br2>I2还原性:Cl-Br2>I2,而对应阴离子的还原性为I->Br->Cl-;②碘单质可使淀粉变蓝,溴水颜色为橙色。由此可推断出甲中加入氯水和淀粉后溶液变为橙色,说明甲中含有Br-,再加丙溶液无明显变化,则说明丙溶液中无I-(若为I-,则发生反应2I-+Cl2=2Cl-+I2)。\n课内针对性训练(学生用书P91)\n1.下列可用于人工降雨的是()A.HClB.AgClC.AgID.干冰答案:CD\n2.化工厂经常用浓氨水检验管道是否漏氯气,其反应方程式为3Cl2+8NH3=6NH4Cl+N2,NH4Cl为白色晶体,把浓氨水靠近漏气口推测一下现象()A.产生白雾B.产生白色晶体C.产生白烟D.产生无色气体答案:C解析:NH4Cl为固体,应为白烟,B、D产生现象是无法看见的,故选C。\n3.在MgCl2、()、Ca(ClO)2、HClO2、KClO3、Cl2O7当中,氯元素的化合价是有规律排列的,括号内应填入的物质是()A.Cl2B.HClC.HClOD.Cl2O3答案:A解析:MgCl2中Cl为-1价,Ca(ClO)2中Cl为+1价,HClO2中Cl化合价为+3价,KClO3中Cl为+5价,Cl2O7中Cl为+7价,则化合价由低至高排列,故选A。\n4.氯化碘(ICl)的化学性质与Cl2相似,预计它跟水反应的生成物为()A.HI、HClOB.HCl、HIOC.HClO3、HIOD.HClO和HIO答案:B\n解析:根据氯气与水的反应方程式:Cl2+H2O=HCl+HClO,ICl中的氯离子为-1价,所以反应后生成HCl,碘离子为+1价,反应后生成HIO。方程式为:ICl+H2O=HCl+HIO。\n5.在氯水中存在多种分子和离子,它们在不同的反应中表现出不同的性质。下列实验现象和结论一致且正确的是()A.加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在B.溶液呈黄绿色,且有刺激性气味,说明有Cl2分子存在C.加入盐酸酸化的AgNO3溶液产生白色沉淀,说明有Cl-存在D.加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在答案:B\n解析:氯水成分的多样性决定了其性质的多重性,氯水的漂白性是由HClO体现的,A项错;盐酸也能够电离出Cl-,不足以说明氯水中含Cl-,C项错;HClO、HCl和NaOH反应,使Cl2和水反应右移,氯水褪色,D项错。\n课后优化训练(学生用书P91)\n基础强化\n1.欲除去Cl2中少量HCl气体,可选用()A.NaOH溶液B.Na2CO3溶液C.饱和食盐水D.AgNO3溶液答案:C解析:A项NaOH与Cl2、HCl都能反应,B项HCl与Na2CO3反应生成CO2新杂质,C项饱和食盐水中Cl2溶解的很少,HCl极易溶于水。\n2.已知氯的化合价可为+1,+3,+5,+7价,某氯的含氧酸根离子中含有m个氧原子,则该离子式量为()A.8m+17B.8m+18C.16m+35.5D.16m+36.5答案:C解析:题中所给已知为干扰项,由于O原子相对质量为16,Cl的原子相对质量为35.5,故可去除A、B、D,故选C。Cl的含氧酸根一般为ClOn-m。\n3.在未知液中加入AgNO3溶液有白色沉淀生成,加入稀硝酸后,沉淀部分溶解,有无色无味的气体生成,将气体通入澄清石灰水,石灰水变浑浊,由此判断原溶液中含有()答案:C\n解析:由已知能使澄清石灰水变浑浊的无色无味气体应是CO2,又因为加入稀HNO3后沉淀部分溶解,故原溶液中除含有外,还有Cl-。\n4.痕检是公安机关提取犯罪嫌疑人指纹的一种重要的方法,AgNO3显现法就是其中一种:人的手上有汗渍,用手动过白纸后,手指纹线就留在纸上。如果将溶液①小心地涂到纸上,溶液①中的溶质就跟汗渍中的物质②作用,生成物质③,物质③在光照下,分解出的银粒呈灰褐色,随着反应的进行,银粒逐渐增多,由棕色变成黑色的指纹线。用下列化学式表示这3种物质都正确的是()\nA.①AgNO3;②NaBr;③AgBrB.①AgNO3;②NaCl;③AgClC.①AgCl;②AgNO3;③NaClD.①AgNO3;②NaI;③Ag答案:B解析:溶液①为AgNO3溶液,AgCl不溶于水;汗渍中含有的物质②为NaCl溶液;生成物质③为AgCl,AgCl见光分解为银粒。\n5.已知Cl2、Br2、I2都具有氧化性,其氧化性Cl2>Br2>I2,在NaBr和KI的混合溶液中通入过量的氯气,然后将溶液蒸干并灼烧,最后留下的物质是()A.NaClB.NaCl和KBrC.KCl和NaBrD.NaCl和KCl答案:D\n解析:将过量的氯气通入到NaBr和KI的混合溶液中,发生的反应有:2Br-+Cl2=Br2+2Cl-,2I-+Cl2=I2+2Cl-。生成的物质有:NaCl、KCl、Br2、I2,加热灼烧时,Br2易挥发、I2易升华,最终剩余的物质为NaCl、KCl。\n6.检验氯化氢气体中是否混有Cl2,可采用的方法是()A.用干燥的蓝色石蕊试纸B.用干燥的有色布条C.将气体通入硝酸银溶液D.用湿润的碘化钾淀粉试纸答案:D解析:Cl2不能使干燥有色物质褪色;Cl2溶于水也产生Cl-,故C方法不可行;故选D。\n7.许多国家十分重视海水的综合利用,不需要化学反应就能够从海水中获得的是()A.Cl2、Br2、I2B.Mg、Na、AlC.火碱、氢气D.食盐、淡水答案:D解析:海水通过蒸发可获得食盐,通过蒸馏可获得淡水,蒸发、蒸馏都是物理的分离方法。而A、B、D中都含有单质,海水中所含的元素多以化合态形式存在,若制备单质,必须采用化学方法,故答案为D。\n8.下列单质中最易与H2发生反应的是()A.Cl2B.Br2C.F2D.I2答案:C解析:氢化物越稳定,则越易生成,实际上H2与F2一混合即发生反应,故选C。\n能力提升\n1.某无色溶液中可能含有,向该溶液中加入少量溴水,溶液仍呈无色,则下列关于该溶液组成的判断正确的是()①肯定不含I-②肯定不含Na+③肯定含④可能含I-A.①③B.①②③C.③④D.②③④答案:C\n解析:由于加入溴水后溶液仍呈无色,说明Br2被还原为Br-,而I2在溶液中呈棕色,那么一定含有。由于还原性而加入的溴水少量,所以可能有I-(I-未被氧化)。\n2.将一盛满Cl2的试管倒立在水槽中,当日光照射相当一段时间后,试管中最后剩余的气体约占试管容积的()答案:B\n\n3.往含I-和Cl-的稀溶液中滴入AgNO3溶液,沉淀的质量与加入AgNO3溶液体积的关系如下图所示。则原溶液中c(I-)/c(Cl-)的比值为()\nA.(V2-V1)/V1B.V1/V2C.V1/(V2-V1)D.V2/V1答案:C\n解析:AgNO3溶液滴入后,先生成AgI,然后再生成AgCl,则产生AgI用去V1体积的AgNO3,产生AgCl用去V2-V1体积AgNO3,又因为c(I-)c(Cl-)的值等于产生沉淀用去AgNO3体积比,故为V1/(V2-V1)。\n4.已知CN-(氢氰酸根离子)和Cl-有相似之处,HCN(氰化氢)的某些性质与氯化氢相似。(CN)2(氰)与Cl2的性质有相似之处,且常温常压下也是气体[例如。写出下列反应的化学方程式:\n(1)MnO2和HCN溶液加热反应________________________________________;(2)(CN)2和KOH溶液反应________________________________________。(CN)2+2KOH=KCN+KCNO+H2O\n解析:充分分析题给信息,再与Cl2的性质和制备相联系,即可得出答案。