- 621.50 KB
- 2022-08-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
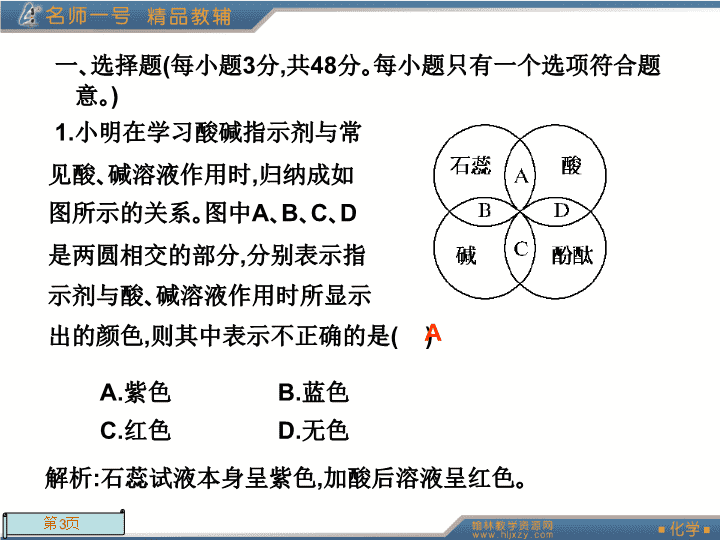
章末检测(二)\n第Ⅰ卷(选择题,共48分)\n一、选择题(每小题3分,共48分。每小题只有一个选项符合题意。)1.小明在学习酸碱指示剂与常见酸、碱溶液作用时,归纳成如图所示的关系。图中A、B、C、D是两圆相交的部分,分别表示指示剂与酸、碱溶液作用时所显示出的颜色,则其中表示不正确的是()A.紫色B.蓝色C.红色D.无色A解析:石蕊试液本身呈紫色,加酸后溶液呈红色。\n2.下列物质中,不能电离出酸根阴离子的是()A.Na2SB.Ca(OH)2C.KMnO4D.KCl解析:A、C、D都是盐,电离出的阴离子都是酸根离子;B属于碱。B\n3.下列反应中,划线物质是还原剂的是()A.Zn+H2SO4=ZnSO4+H2↑B.Cl2+2NaBr=2NaCl+Br2解析:还原剂是在反应中化合价升高的反应物,A、B中划线物质为生成物,C中划线物质化合价降低为氧化剂。D\n4.“纳米材料”是指微粒直径为几纳米到几十纳米的材料,如将纳米材料分散到水中,得到的分散系不可能具有的性质有下列的()A.能全部透过半透膜B.能全部通过滤纸C.粒子做布朗运动D.有电泳现象解析:根据纳米材料的直径在几纳米到几十纳米,可以确定所得分散系属于胶体,这种分散系具有胶体的性质特点。A\n5.NaOH、Na2CO3\,NaCl\,Na2SO4可按某种标准划为一类物质,下列分类标准不正确的是()A.钠的化合物B.可与硝酸反应C.可溶于水D.电解质解析:NaCl、Na2SO4与HNO3不反应。B\n6.离子方程式H++OH-=H2O所表示的反应是()A.所有酸和碱之间的中和反应B.所有强酸和强碱之间的中和反应C.所有可溶性酸和可溶性碱之间的中和反应D.强酸溶液与强碱溶液生成可溶性盐和水的反应D\n7.(2010·广东高考)能在溶液中大量共存的一组离子是()A.NH+4、Ag+、PO3-4、Cl-B.Fe3+、H+、I-、HCO-3C.K+、Na+、NO-3、MnO-4D.Al3+、Mg2+、SO2-4、CO2-3解析:A中Ag+与Cl-、PO3-4因生成AgCl、Ag3PO4沉淀而不能共存;B中Fe3+、I-因发生氧化还原反应而不共存,H+与HCO-3反应、Fe3+与HCO-3发生反应也不共存(以后会学到);C中各离子不发生反应,能大量共存;D中Mg2+与CO2-3不共存,Al3+与CO2-3发生反应也不共存(以后会学到)。C\n8.今有一种固体化合物X,X本身不导电,但熔融状态或溶于水中能够导电,下列关于该化合物X的说法中,正确的是()A.X一定为电解质B.X可能为非电解质C.X只能是盐类D.X可以是任何化合物解析:固体A本身不导电,但熔融状态或水中能够导电,说明上述条件下能够电离出自由移动的离子,因此属于电解质,但不一定属于盐类,如强碱NaOH也符合题意。A\n9.化学概念在逻辑上存在下图所示关系:对下列概念的说法中正确的是()A.纯净物与混合物属于包含关系B.化合物与氧化物属于包含关系C.单质与化合物属于交叉关系D.氧化还原反应与化合反应属于并列关系B\n解析:纯净物与混合物、单质与化合物属于并列关系,氧化还原反应与化合反应属于交叉关系。\n10.下列反应的离子方程式,书写错误的是()A.用稀硫酸清除铁锈:Fe2O3+6H+=2Fe3++3H2OB.铜粉放入硝酸银溶液里:Cu+Ag+=Cu2++AgC.氢氧化钡跟硫酸铜溶液的反应:Ba2++2OH-+Cu2++SO2-4=BaSO4↓+Cu(OH)2↓D.氯化铁溶液中滴加硝酸银溶液:Cl-+Ag+=AgCl↓解析:B选项中电荷不守恒。B\n11.下列各组物质发生的反应,既是化合反应又是氧化还原反应的是()解析:只有B、D是化合反应,只有B有化合价变化。B\n12.(2009·海淀高一检测)实验室制Cl2反应为下列说法不正确的是()A.还原剂是HCl,氧化剂是MnO2B.每生成1molCl2,转移电子的物质的量为2molC.每消耗1molMnO2,起还原剂作用的HCl消耗4molD.转移电子的物质的量为1mol时,生成标准状况下Cl2的体积为11.2L解析:分析该氧化还原反应方程式,可得每消耗1molMnO2,起还原剂作用的HCl消耗2mol。C\n13.根据离子方程式:①2Fe3++2I-=2Fe2++I2,②Br2+2Fe2+=2Br-+2Fe3+,可判断离子的还原性从强到弱的顺序是()A.Br-\,Fe2+\,I-B.I-\,Fe2+\,Br-C.Br-\,I-\,Fe2+D.Fe2+\,I-\,Br-解析:由氧化还原反应规律:强氧化剂+强还原剂→(弱氧化性)氧化产物+(弱还原性)还原产物可判断:①反应中还原性I->Fe2+;②反应还原性Fe2+>Br-,综合两个关系即得I->Fe2+>Br-。B\n14.(2009·昆明高一检测)菜谱中记载:河虾不宜与西红柿同食。主要原因是河虾中含有+5价砷,西红柿中含有比较多的维生素C,两者同食会生成有毒的+3价砷。下列说法正确的是()A.在该反应中维生素C作催化剂B.由上述信息可推知砒霜中含有的砷是+3价C.因为河虾中含有砷元素,所以不能食用D.上述反应中维生素C作氧化剂解析:由题给信息可知河虾中+5价砷与维生素C作用生成有毒的+3价砷,说明维生素C作还原剂,砒霜中含有有毒的+3价砷。B\n16.已知aM2++bO2+4H+=cM3++dH2O,则化学计量数c的值为()A.1B.2C.3D.4解析:根据原子守恒和电荷守恒可知:a=c2a+4=3c解得c=4。D\n第Ⅱ卷(非选择题,共52分)\n二、非选择题(共5个大题,52分)17.(8分)现有下列物质:A.豆浆B.食盐水C.铁D.硫酸E.氢氧化钠固体F.纯碱G.泥水H.二氧化碳I.水请将它们的序号或所属类别填充到下列横线上。\n物质混合物溶液:________________:A浊液:________纯净物单质:________化合物酸:________碱:________盐:________________:H、IB胶体GCDEF氧化物\n18.(9分)我国规定饮用水的质量标准必须符合下表所列要求。pH6.5~8.5Ca2+、Mg2+总浓度<0.0045mol·L-1细菌总数<100个/L\n以下是源水处理成自来水的工艺流程示意图:源水气池一级沉淀池二级沉淀池过滤池自来水加入凝聚剂通入CO2气体通黄绿色A2加入生石灰(1)源水中含有Ca2+、Mg2+、HCO-3、Cl-等,加入生石灰后生成Ca(OH)2,进而发生若干复分解反应,写出其中一个反应的离子方程式_______________________________________。Mg2++2OH-=Mg(OH)2↓(其他正确均可)\n(2)凝聚剂Fe2(SO4)3是常用的凝聚剂,它在水中先形成Fe(OH)3胶体,最终生成沉淀,除去悬浮固体颗粒的过程是________(填写序号)。①只是物理过程②只是化学过程③是物理过程和化学过程(3)通入CO2气体的目的是____________________和____________________。③除去多余的Ca2+调节自来水的pH\n解析:(1)源水中含Ca2+、Mg2+、HCO-3、Cl-等,加入生石灰后生成Ca(OH)2,可以发生的反应有:Mg2++2OH-=Mg(OH)2↓,Ca2++HCO-3+OH-=CaCO3↓+H2O。(2)凝聚剂Fe2(SO4)3中的Fe3+与水反应生成Fe(OH)3胶体,吸附悬浮物沉淀到水底,属于物理和化学过程。(3)通入CO2气体可除去多余的Ca2+,并调节自来水的pH。\n19.(15分)某校学生课外活动小组的同学设计下图所示实验装置,用来验证一氧化碳具有还原性。回答下列问题。\n(1)写出装置A中所发生反应的离子方程式________________________________。(2)装置B中最适宜的试剂是____________________。(3)若实验中没有装置C,使装置B与装置D直接相连,会对实验造成的影响是:__________________________________________________________________________。(4)装置D中黑色固体为________(填名称),反应的化学方程式为______________________________。1)CaCO3+2H+=Ca2++H2O+CO2↑饱和碳酸氢钠溶液没有除去气体中的水蒸气,高温下水蒸气与炭反应生成H2和CO,H2也能还原CuO炭\n(5)按照如图装置进行实验时,首先进行的操作是____________________________________。(6)根据实验中的________________________现象,可证明CO具有还原性,有关反应的化学方程式是________________________________________。(7)若要根据装置F中澄清石灰水变浑浊的现象确认一氧化碳具有还原性,应在上图装置________与________之间连接下图中的________装置(填序号)。检查装置的气密性E装置中黑色CuO变成红色DE②\n解析:A是实验室制取CO2的装置;B装置的作用是除去CO2中的HCl,用饱和碳酸氢钠溶液;C装置的作用是干燥CO2气体;D是产生CO的装置,黑色固体碳单质;E中发生的反应为:,现象是出现红色物质;F装置的作用是检验生成的CO2和除去尾气。\n20.(12分)有五瓶损坏标签的试剂,分别盛有AgNO3溶液、稀硝酸、盐酸、氯化钡溶液、碳酸铵溶液,为了确定各瓶中是什么试剂,将它们任意编号为A、B、C、D、E,用小试管各盛少量,多次进行两两混合反应,反应现象为:A与B、A与E产生沉淀,B与D、B与E产生沉淀,C与E、D与E产生气体,而C与D无反应现象。由此,可判定各试剂瓶中所盛试剂为:A________、B________、C________、D________、E________。BaCl2AgNO3HNO3盐酸(NH4)2CO3\n请写出下面的离子方程式:(1)A与E:____________________。(2)B与E:____________________。(3)C与E:____________________。Ba2++CO2-3=BaCO3↓2Ag++CO2-3=Ag2CO3↓CO2-3+2H+=H2O+CO2↑\n解析:根据题意,E与A、B分别产生沉淀,与C、D分别产生气体,可推断E为(NH4)2CO3溶液,A、B可能为AgNO3和BaCl2中的一种,可判断C、D必为稀硝酸和盐酸中的一种,而B与D能产生沉淀,可确定B为AgNO3溶液,D为盐酸,因此A为BaCl2溶液,C为稀硝酸。\n21.(8分)已知反应:3Cl2+8NH3=N2+6NH4Cl(1)参加反应的NH3和作还原剂的NH3的个数比为________。(2)当有44.8L(标准状况)Cl2参加反应,转移电子数为________mol,被氧化的NH3的质量为________g,还原产物的质量为________g。4:1422.7214\n解析:(1)由方程式可得,若参加反应的NH3为8mol,作为还原剂的NH3为2mol,故参加反应的NH3和作为还原剂的NH3的个数比为41。(2)由题意得n(Cl2)==2mol转移电子数为4mol3Cl2+8NH3=N2+6NH4Cl3mol2×17g6×53.5g2molm(NH3)m(NH4Cl)被氧化的NH3的质量:m(NH3)==22.7g还原产物NH4Cl的质量:m(NH4Cl)==214g