- 572.00 KB
- 2022-08-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
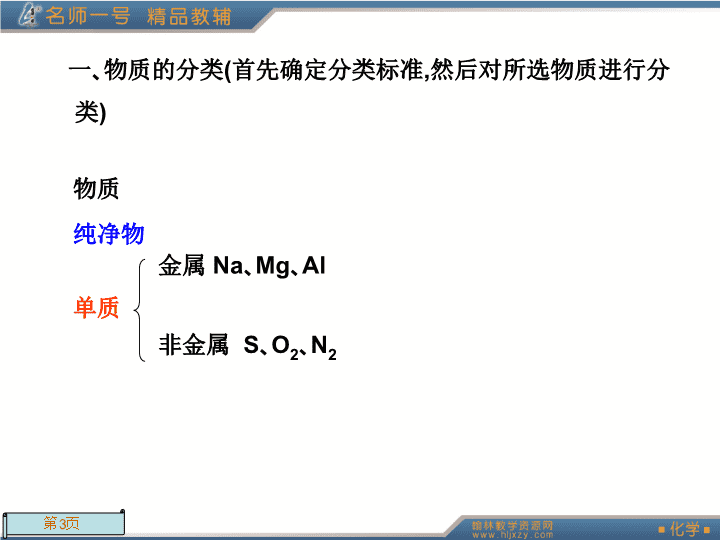
章末总结提升\n本章知识体系展现(学生用书P48)\n一、物质的分类(首先确定分类标准,然后对所选物质进行分类)物质纯净物单质金属Na、Mg、Al非金属S、O2、N2\n化合物按组成分氧化物酸性氧化物SO2、SO3、P2O5碱性氧化物Na2O、CaO、Fe2O3两性氧化物Al2O3不成盐氧化物CO、NO\n酸按酸根分含氧酸HNO3、H2SO4无氧酸HCl按电离出的H+数分一元酸HCl、HNO3二元酸H2SO4、H2SO3多元酸H3PO4\n碱按强弱分强碱NaOH、Ba(OH)2弱碱NH3·H2O、Fe(OH)3按电离出的OH-数分一元碱NaOH二元碱Ba(OH)2多元碱Fe(OH)3\n盐正盐Na2CO3酸式盐NaHCO3碱式盐Cu2(OH)2CO3按性质分电解质溶于水或熔融状态下能自身电离出自由移动的离子的化合物。酸、碱、盐是电解质非电解质\n混合物普通混合物分散系——溶液——分散质粒子直径小于1nm,可以透过滤纸和半透膜胶体——分散质粒子直径在1~100nm之间,具有介稳性、丁达尔效应、聚沉、电泳,不能透过半透膜,能透过滤纸浊液——分散质粒子直径大于100nm,不能透过滤纸和半透膜\n二、化学反应根据反应物和生成物的类别以及反应前后物质种类的多少化合反应:A+B=AB(部分为氧化还原反应)分解反应:AB=A+B(部分为氧化还原反应)置换反应:A+BC=AC+B(全为氧化还原反应)复分解反应:AB+CD=AD+CB(全为非氧化还原反应)\n根据反应中是否有离子参加(离子反应)定义:有离子参加的一类反应,主要包括复分解反应、有离子参加的置换反应\n离子方程式定义:用实际参加反应的离子符号来表示化学反应的式子书写方法写:写出反应的化学方程式拆:把易溶于水、易电离的物质拆写成离子形式删:将不参加反应的离子从化学方程式两端删去查:查化学方程式两端原子个数和电荷数是否相等意义:不仅表示了某一个化学反应,而且表示了某一类型的所有化学反应正误判断:五“看”书写原则\n实质:向着某种离子浓度减小的方向进行类型离子非氧化还原反应离子互换反应(生成气体、沉淀或弱电解质)碱性氧化物与酸反应酸性氧化物与碱反应离子氧化还原反应置换反应(金属单质或非金属单质的相对活动性)一般离子氧化还原反应(生成氧化性或还原性更弱的物质)\n根据反应中是否有电子转移氧化还原反应实质:有电子转移(得失或偏移)特征:反应前后元素的化合价有变化概念及其相互关系\n反应物氧化剂(有氧化性)得电子化合价(降低)发生(还原)反应(还原)产物同时存在同时体现数目相等同时发生同时产生还原剂(有还原性)失电子化合价(升高)发生(氧化)反应(氧化)产物生成物\n电子转移表示方法双线桥法:失去2e-得到2e-单线桥法:2e-非氧化还原反应\n专题探究(学生用书P49)\n专题一离子方程式的正误判断及设错方式纵观近几年高考试题,离子方程式的正误判断题型的再现率达100%,而且这类试题的失分率居高不下,但所考查的知识并不是无边无际。现对这类试题进行归类、分析、总结如下:设错方式1:不符合客观事实,错写反应产物如2Fe3++3S2-=Fe2S3,Fe3+有氧化性,S2-有还原性,Fe3+可将S2-氧化为S,即应写成2Fe3++S2-=2Fe2++S↓。\n设错方式2:漏写部分离子反应如Ba(OH)2溶液与H2SO4溶液反应:Ba2++SO2-4=BaSO4↓,同学们只注意了Ba2+与SO2-4的反应,而漏掉了H+与OH-的反应。设错方式3:错写反应物或产物的配比关系如Ba(OH)2溶液与H2SO4溶液反应:Ba2++OH-+H++SO2-4=BaSO4↓+H2O,应写成Ba2++2OH-+2H++SO2-4=BaSO4↓+2H2O。\n设错方式4:电荷不守恒或原子不守恒如Fe2++Cl2=Fe3++2Cl-,应写成2Fe2++Cl2=2Fe3++2Cl-。设错方式5:氧化还原反应中得失电子不守恒如2MnO-4+3H2O2+6H+=2Mn2++4O2↑+6H2O,应写成2MnO-4+5H2O2+6H+=2Mn2++5O2↑+8H2O。设错方式6:忽视了题设条件及要求如“过量”、“少量”、“等物质的量”、“适量”、“任意量”以及滴加顺序等对反应方程式或产物的影响。\n与量有关的离子方程式的书写,其关键是明确反应原理,量不同,离子方程式不同,以少(不足量的物质)定多(过量的物质),量少的定为1mol,量多的物质根据1mol量少物质的反应用量来确定,即“以少定多”原则。如:NaHCO3溶液和Ca(OH)2溶液混合,当Ca(OH)2不足时,Ca2+、OH-应完全反应,离子方程式:2HCO-3+Ca2++2OH-=CaCO3↓+2H2O+CO2-3。当Ca(OH)2过量时,HCO-3应完全反应,Ca2+、OH-有剩余,离子方程式:HCO-3+Ca2++OH-=CaCO3↓+H2O。\n例1:下列离子方程式书写正确的是()A.碳酸钡和稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2OB.金属铝溶于盐酸中:Al+2H+=Al3++H2↑C.向AlCl3溶液中加入过量氨水:Al3++3OH-=Al(OH)3↓D.少量CO2通入澄清石灰水:CO2+Ca2++2OH-=CaCO3↓+H2OD\n〔解析〕A中BaCO3与H2SO4反应生成BaSO4沉淀,正确的离子方程式为:BaCO3+2H++SO2-4=BaSO4↓+H2O+CO2↑;B中离子方程式电荷不守恒,正确的离子方程式为2Al+6H+=2Al3++3H2↑;C中NH3·H2O是弱碱不能拆成OH-,正确的离子方程式为:Al3++3NH3·H2O=3NH+4+Al(OH)3↓,只有D正确。\n专题二氧化还原反应的计算氧化还原反应比较典型的计算有:求氧化剂与还原剂的物质的量之比或质量比,计算参加反应的氧化剂或还原剂的量,确定反应前后某一元素的价态变化等,计算的关键是依据氧化剂得电子总数等于还原剂失电子总数,列出守恒关系式求解。计算公式如下:氧化剂物质的量×变价元素原子的个数×化合价的变化值=还原剂物质的量×变价元素原子的个数×化合价的变化值。\n例2:24mL0.05mol·L-1的Na2SO3溶液恰好与20mL0.02mol·L-1的K2Cr2O7(重铬酸钾)溶液完全反应。已知Na2SO3被K2Cr2O7氧化为Na2SO4,则元素Cr在还原产物中的化合价为()A.+2B.+3C.+4D.+5B〔解析〕本题为典型的氧化还原反应计算,能正确表示出氧化剂得电子总数、还原剂失电子总数是解题的关键。\n根据氧化还原反应中得失电子总数相等,判断Cr元素在还原产物里的价态。n(Na2SO3)=0.05mol·L-1×0.024L=0.0012moln(K2Cr2O7)=0.02mol·L-1×0.02L=0.0004molK2Cr2O7在反应中得电子:0.0004×2×(6-x)mol得2×(6-x)×e-失2e-\nNa2SO3在反应中失电子:0.0012×2mol。根据氧化还原反应中,氧化剂和还原剂得失电子总数相等,则有:0.0004×2×(6-x)=0.0012×2,解得x=3。