- 431.00 KB
- 2022-08-08 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
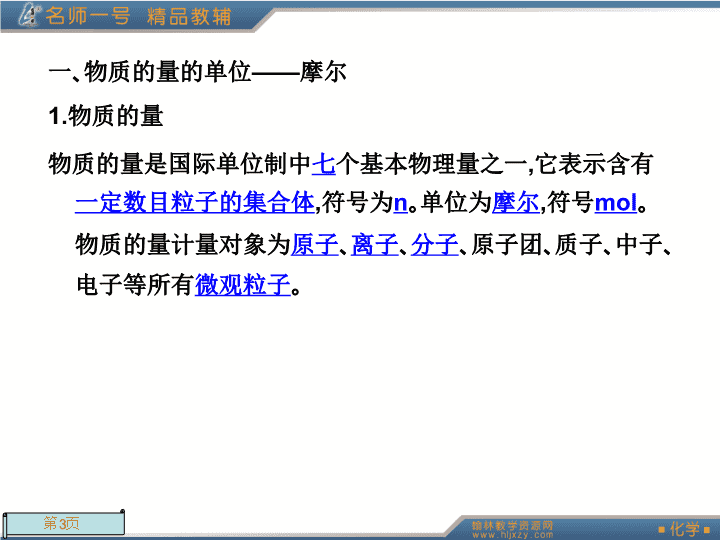
第二节化学计量在实验中的应用第1课时物质的量的单位——摩尔\n课前自主学习(学生用书P10)\n一、物质的量的单位——摩尔1.物质的量物质的量是国际单位制中七个基本物理量之一,它表示含有一定数目粒子的集合体,符号为n。单位为摩尔,符号mol。物质的量计量对象为原子、离子、分子、原子团、质子、中子、电子等所有微观粒子。\n2.摩尔、阿伏加德罗常数标准:1mol粒子集体所含的粒子数与0.012kg12C中所含的碳原子数相同,约为6.02×1023,把6.02×1023mol-1叫做阿伏加德罗常数,符号NA。3.物质的量(n)、阿伏加德罗常数(NA)与粒子数(N)的关系\n二、摩尔质量1.概念:单位物质的量的物质所具有的质量,符号M,常用单位g/mol或g·mol-1。2.物质的量(n)、质量(m)、摩尔质量(M)的关系\n诱思探究:水是我们离不开的物质,水的摩尔质量与水的质量多少有关系吗?提示:水是纯净物,水的摩尔质量是18g/mol,是一个定值,与水的质量多少无关。\n课堂深化探究(学生用书P10)\n一、物质的量及其单位——摩尔1.物质的量(1)是国际七个基本物理量之一,它表示含有一定数目粒子的集合体,符号是n,单位是mol。(2)“物质的量”四个字是一个整体,不可分割,用于计量构成物质的微观粒子(如分子、原子、离子、电子等)或微观粒子的特定组合,不能用于计量宏观物质。\n2.摩尔(1)物质的量的单位,国际七个基本单位之一,每摩尔物质含有阿伏加德罗常数个粒子,符号mol。(2)使用摩尔时必须指明物质粒子的名称或符号或化学式或符号的特定组合。如1molH表示1mol氢原子,1molH2表示1mol氢分子(或氢气),1molH+表示1mol氢离子,但如果说“1mol氢”就违反了使用准则,因为氢是元素名称,不是粒子名称,也不是粒子的符号或化学式。\n3.阿伏加德罗常数科学上把0.012kg12C所含有的碳原子数叫阿伏加德罗常数,近似值为6.02×1023mol-1,符号NA,单位mol-1。特别提示:①物质的量、阿伏加德罗常数是两个物理量,摩尔为物质的量的基本单位。②6.02×1023mol-1为阿伏加德罗常数的近似值,计算时常用6.02×1023mol-1代替阿伏加德罗常数。③阿伏加德罗常数是一个有单位的物理量,而不是一个纯数,但使用时可直接表示粒子数,如1molH2O含有的原子数为3NA。\n二、物质的质量、摩尔质量、相对分子质量(或相对原子质量)的区别与联系物质的相对分子(原子)质量物质的质量摩尔质量区别数值\n特征以一个C-12原子质量的作为标准,其他分子(或原子)的质量与它相比较所得的数值,固定不变质量数值是任意的对于给定物质,其摩尔质量数值是固定不变的单位1g或kgg·mol-1联系单位物质的量的物质所具有的质量叫摩尔质量,以g·mol-1为单位时,它在数值上等于该物质的相对分子质量或相对原子质量\n典例剖析(学生用书P11)\n知识点一阿伏加德罗常数例1下列说法中,不正确的是()A.1mol任何物质都含有6.02×1023个原子B.0.012kg12C约含有6.02×1023个碳原子C.阿伏加德罗常数的“集体”就是1molD.使用摩尔这一单位时必须指明微粒的名称\n〔解析〕构成物质的微粒除原子之外,还有分子、离子等,故A错误;0.012kg12C所含的微粒数(碳原子)即为阿伏加德罗常数,即为1molC原子,B正确;1mol任何物质所含的微粒数即为阿伏加德罗常数,所以C正确;摩尔这一单位所指的对象是微粒,而微粒种类繁多,故需要指明名称,D正确。〔答案〕A\n知识点二摩尔质量例2下列说法正确的是()A.1mol氢约含有6.02×1023个微粒B.1mol水中含有1mol氧原子和2mol氢原子C.钠的摩尔质量等于它的相对原子质量D.NaOH的摩尔质量等于40g\n〔解析〕掌握摩尔质量及其单位是解答本题的关键。A中没有具体指出是氢的什么微粒,是氢分子还是氢原子不指明就无法解答,因此是错误的;B中水是具体物质,由水分子的构成可知该说法正确;C中钠的摩尔质量以g·mol-1为单位时,在数值上等于该种原子的相对原子质量,而相对原子质量单位为1,摩尔质量的单位是g/mol,C也错误;D的单位错误,故只有B正确。〔答案〕B\n知识点三有关物质的量的计算例349gH2SO4的摩尔质量是________,其物质的量为________,1.5molH2SO4的质量是________,其中含有________molH,含有________gO。98g/mol0.5mol147g396\n〔解析〕H2SO4的摩尔质量数值上等于其相对分子质量,即为98g/mol。H2SO4的质量、摩尔质量和物质的量三者之间的关系是:n(H2SO4)=;1个H2SO4中含有2个H、4个O原子,则1molH2SO4中含有2molH、4molO;氧原子的质量、摩尔质量和物质的量三者之间的关系是:m(O)=n(O)·M(O)。\n点评〕在将物质的量应用于粒子数目的计算时,要特别注意两点:一是弄清与计算有关的是什么粒子,如分子、离子、原子、电子、质子、中子等;二是粒子所包含的种类和数目,如1个H2O中含有2个H、1个O、10个电子和10个质子,则1molH2O中就含有2molH、1molO、10mol电子和10mol质子。\n课内针对性训练(学生用书P12)\n1.下列关于摩尔的说法中,正确的是()A.摩尔是表示物质质量的单位B.摩尔是七个基本物理量之一C.摩尔是表示物质的数量的单位D.摩尔是物质的量的单位答案:D解析:本题考查物理量与单位的匹配性,明确谁是单位,谁是物理量,区别“物质的量”与“物质的质量”是两个不同的物理量。质量的常用单位是千克,物质的量的常用单位为摩尔。摩尔是一个单位,不是物理量,摩尔是“物质的量”这个物理量的单位,故D正确。\n2.下列说法正确的是()A.摩尔质量就等于物质的式量B.摩尔质量就是物质相对分子质量的6.02×1023倍C.CO2的摩尔质量是44gD.硫酸和磷酸的摩尔质量相等答案:D解析:摩尔质量的单位是g·mol-1,物质的式量的单位是1,对同一物质来说,只能说二者在数值上相等,故A、B、C均错误;硫酸与磷酸的相对分子质量相等,故其摩尔质量也相等。\n3.在下列物质中,其物质的量为0.2mol的是()A.0.2gCO2B.3.6gH2OC.3.2gO2D.7.3gHCl答案:BD\n解析:根据摩尔质量的定义式n=代入数值可解得A、B、C、D选项所列物质的物质的量分别为mol、0.2mol、0.1mol、0.2mol。\n4.相同物质的量的CO2和O2,其分子数目之比为________,原子数目之比为________,氧原子数目之比为________;质量相同的CO2和O2,其物质的量之比为________。1:13:21:18:11\n课后优化训练(学生用书P12)\n基础强化1.下列说法正确的是()A.物质的量可理解为物质的质量B.物质的量就是物质的粒子数目C.物质的量是量度物质所含微观粒子多少的一个物理量D.物质的量的单位——摩尔只适用于分子、原子和离子答案:C解析:物质的量是量度物质所含微观粒子多少的物理量,其单位为摩尔;摩尔适用于微观粒子,如分子、原子、离子、电子等。\n2.下列对于阿伏加德罗常数的理解,正确的是()A.阿伏加德罗常数是化学上常用的一个单位B.某物质含有8mol分子,也可以说该物质含有的分子数目是8NAC.通常情况下,近似值6.02×1023就是我们所说的阿伏加德罗常数D.粒子的数目越多,所含粒子的物质的量不一定越大答案:B\n解析:阿伏加德罗常数是一个物理量,其单位是mol-1,A不正确;1mol分子含有的分子数目就是NA个分子,常用近似值6.02×1023个分子来表示,B正确;阿伏加德罗常数不是一个单纯的数,C不正确;根据n=分析,粒子的数目越多,所含粒子的物质的量一定越大,D不正确。\n3.下列有关阿伏加德罗常数(NA)的说法错误的是()A.32克O2所含的原子数目为NAB.0.5molH2O含有的原子数目为1.5NAC.1molH2O含有的H2O分子数目为NAD.0.5NA个氢气分子的物质的量是0.5mol答案:A解析:32gO2的物质的量是1mol,含有氧分子的个数为NA,含有氧原子数目为2NA。\n4.下列叙述中正确的是()A.H2O的相对分子质量为18gB.两种不同物质的物质的量相等,则这两种物质的质量一定相等C.3.0molOH-的质量为51gD.铁的摩尔质量就是它的相对原子质量答案:C解析:相对分子质量的单位为1,A不正确;物质的量相同的两种物质质量不一定相等,如1molH2质量为2g,1molO2质量为32g,B不正确;根据m=n·M,可求出n(OH-)=3.0mol×17g/mol=51g,C正确;铁的摩尔质量的数值与其相对原子质量相同,D不正确。\n5.amolH2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为()A.a/4bmol-1B.b/amol-1C.a/bmol-1D.b/4amol-1答案:D\n解析:每摩尔硫酸中含有4mol氧原子。根据公式:可推出D正确。\n6.若50滴水正好是amL,则1滴水所含的分子数是()A.a×50×18×6.02×1023B.×6.02×1023C.×6.02×1023D答案:B\n解析:amL水的质量就是ag,其中所含水的物质的量为(a/18)mol,则1滴水所含的水的物质的量为,其中的水分子个数为\n7.1mol任何物质中都含有阿伏加德罗常数个粒子,其中的“粒子”是指与该物质的化学式相对应的微观粒子,判断下列说法是否正确。若不正确分析原因。(1)1molNa+中含NA个钠离子____________________(2)1molH2O含有6.02×1023个水分子____________________(3)1mol氧中含有NA个氧原子_______________________________________________________正确正确不正确,因氧是元素名称,不是微粒名称,也不是微粒的符号或化学式。\n(4)1molCO2中含有NA个氧原子__________________________________(5)1molH2O中含1molH2和1molO原子__________________________________________________________________________不正确,1molCO2中含2mol氧原子,即2NA个氧原子。不正确,因1个H2O分子含有2个H原子和1个O氧子,则1molH2O中含2molH原子和1molO原子。\n8.将下列左右两栏中相当的物理量用线连接起来A.4gNaOHa.恰好完全反应B.2molNa2CO3b.含有6.02×1023个微粒C.1molH2SO4和80gNaOHc.质量为212gD.1mol的任何物质d.物质的量是2molE.64gSe.含0.1molNa+\n答案:\n能力提升1.某气体物质的质量为6.4g,含有6.02×1022个分子,则该气体的相对分子质量是()A.64B.32C.96D.124答案:A\n解析:由mol,Mg/mol,故相对分子质量为64。\n2.铅笔芯的主要成分是石墨和黏土,这些物质按照不同的比例加以混和、压制,就可以制成铅笔芯。如果铅笔芯质量的一半成分是石墨,且用铅笔写一个字消耗的质量约为1mg。那么一个铅笔字含有的碳原子数约为()A.2.5×1020个B.2.5×1019个C.5×1019个D.5×1022个答案:B\n解析:用铅笔写一个字消耗碳的质量约为0.5×1mg,碳的物质的量为碳原子个数为6.02×1023mol-1=2.5×1019。\n3.有以下四种物质:①22g二氧化碳②10g氢气③1.204×1024个氮气分子④4℃时18mL水它们所含分子数最多的是________,所含原子数最多的是________,质量最大的是________,所含电子数最多的是________(填序号)解析:找出各种物质的物质的量,再确定其所含分子、原子、电子、质量等。②②③③\n4.12.4gNa2R含Na+0.4mol,则Na2R的摩尔质量为_______________,R的相对原子质量为________。含R的质量为1.6g的Na2R,其物质的量为________。62g·mol-1160.1mol\n解析:由Na2R的化学式知1molNa2R含2molNa+,题中有Na+0.4mol,则有0.2molg·mol-1,Mr(Na2R)=62求得Ar(R)=62-2×23=16。已知m(R)=1.6g,由得n(R)=0.1mol,则n(Na2R)=0.1mol。\n5.(1)等质量的氧气和臭氧(O3)物质的量之比为________,所含氧原子数之比为________。(2)NO和O2可发生反应:2NO+O2=2NO2,现有amolNO和bmolO2充分反应后氮原子与氧原子的个数比为________。解析:(1)氧气和臭氧都是由氧原子构成的分子,所以当二者质量相等时,原子的物质的量是相等的;(2)化学反应中原子进行了重新组合,但是原子的个数和种数没有改变。3:21:1a:(a+2b)