- 356.50 KB
- 2022-08-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
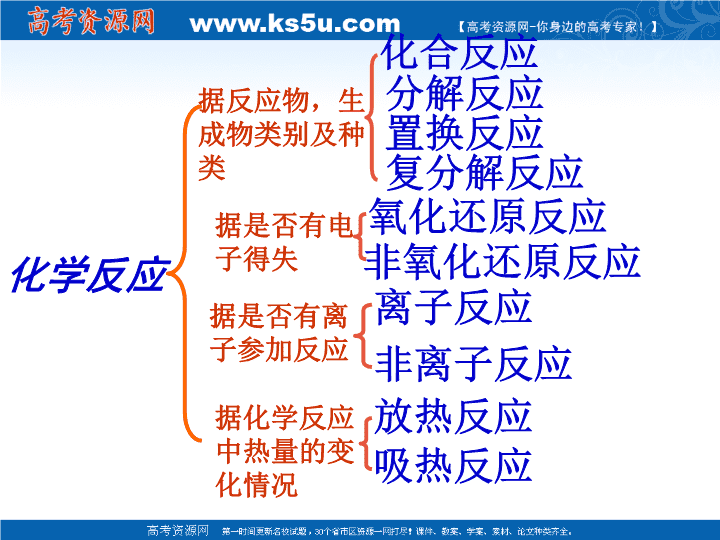
第一章复习课高一化学组\n化学反应据反应物,生成物类别及种类化合反应分解反应置换反应复分解反应据是否有电子得失氧化还原反应非氧化还原反应据是否有离子参加反应离子反应非离子反应据化学反应中热量的变化情况放热反应吸热反应\n1.四种基本反应类型与氧化还原反应的关系①有单质参加的化合反应都是氧化还原反应;②有单质生成的分解反应都是氧化还原反应;③所有的置换反应都是氧化还原反应;④所有的置换反应都是氧化还原反应;氧化还原反应化合反应分解反应置换反应复分解反应\n2.离子反应与氧化还原反应的关系氧化还原反应离子反应①有些离子反应是氧化还原反应;如:Fe+2H+==Fe2++H2↑Fe+Cu2+==Cu+Fe2+②有些离子反应不是氧化还原反应;如:OH-+H+==H2OSO42-+Ba2+==Cu+Fe2+\n练一练(1)C+CO2==2CO(2)CaCO3==CaCO3+CO2(3)2Al+6HCl==2AlCl3+3H2↑(4)2NaOH+H2SO4==Na2SO4+2H2O问题一:请从不同的角度说出以上四个反应的类型。\n问题二:用双线桥表示反应(1)和(3)。(1)C+CO2==2CO失2e-。化合价升高,被氧化,得2e-。化合价降低,被还原,(3)2Al+6HCl==2AlCl3+3H2↑失6e-。化合价升高,被氧化,得2e-。化合价降低,被还原,氧化剂:CO2还原剂:C氧化剂:HCl还原剂:Al\n总结:氧化还原反应的有关概念及关系还原剂还原性失电子价升高氧化产物氧化剂氧化性得电子价降低还原产物反应物性质本质特征反应\n问题三:反应(3),(4)是离子反应,请写出离子方程式(3)2Al+6H+==2Al3++3H2↑(4)OH-+H+==H2O题后思考:反应(3)(4)的离子方程式还能表示哪些物质间得反应?请各举一例。\n问题四:请分析反应(3)中的H+(4)中的OH-反应前后浓度有何变化变化?并说明离子反应的本质。问题五:哪些因素可以使离子浓度减少?浓度都减少生成难电离或生成气体或生成难溶物。\n离子反应定义:有离子参加的一类反应。中学主要有复分解反应和有离子参加的氧化还原反应。离子方程式定义:用实际参加反应的离子符号表示离子反应的式子。意义:不仅表示一定物质间的某各反应,而且表示所有同一类型的离子反应。本质:离子浓度的减少书写步骤:“写,拆,删,查”\n离子方程式的书写注意事项一,拆成离子形式易溶于水,易电离的物质强酸(HCl.HNO3.H2SO4)强碱(NaOH.KOH.Ba(OH)2)大多数可溶性盐二,拆成分子形式难溶性的酸碱盐。如Cu(OH)2,Fe(OH)3,BaSO4难电离物弱酸(H2CO3.CH3COOH)弱碱(NH3.H2O)水气体,如:CO2,O2,NH3单质,如:Fe,S,O2氧化物。如:SO2,Fe2O3\n练一练:把下列化学方程式改写成离子方程式:1.2FeCl2+Cl2==2FeCl32Fe2++Cl2==2Fe3++2Cl-2.Br2+SO2+2H2O==2HBr+H2SO4Br2+SO2+2H2O==4H++2Br-+SO42-3.KClO3+6HCl==3Cl2↑+KCl+3H2OClO3-+5Cl-+6H+==3Cl2↑+3H2O\n化合物的分类化合物电解质非电解质强电解质弱电解质强酸强碱大部分的盐弱酸弱碱水\n思考:1.什么是放热反应和吸热反应?在什么条件下是放热反应和吸热反应?2.燃料充分燃烧的条件?\n再见!