- 1.18 MB
- 2022-08-09 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
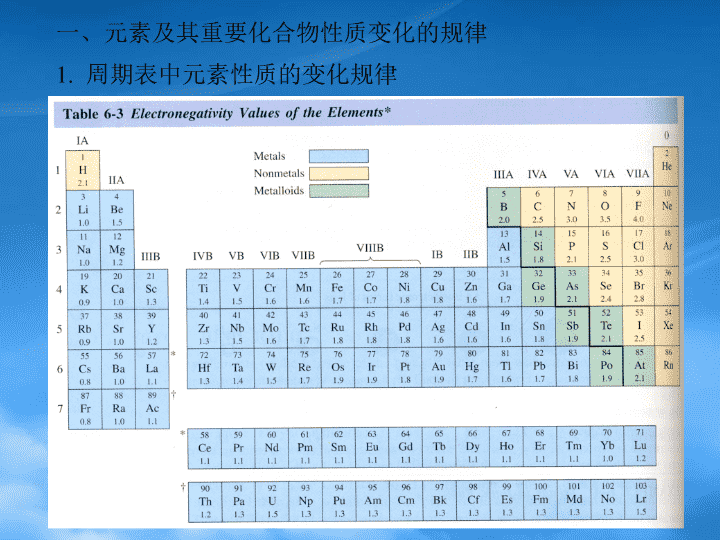
元素部分元素及其重要化合物性质变化的规律重要化合物和离子的结构重要化合物和离子的化学性质离子的分离和鉴定\n一、元素及其重要化合物性质变化的规律1.周期表中元素性质的变化规律\n主族元素化合物性质的变化规律s区金属氢氧化物的碱性强弱p区元素的氧化物、氢氧化物及含氧酸酸碱性的变化规律氧化物酸碱性的变化规律:同周期元素最高氧化态氧化物,从左到右碱性依次减弱,酸性依次增强;同族元素同氧化态氧化物碱性从上到下依次增强;有多种氧化态的元素,其氧化物的酸性依氧化态升高的顺序增强。\n3)p区元素最高氧化态水和氧化物的氧化性强弱的变化规律\n4)p区元素氢化物的酸性和氧化性的变化规律\n3.副族元素化合物性质的变化规律---酸碱性及氧化还原性Cu2+Ag+Zn2+Cd2+Hg2+NaOHCu(OH)2AgOZn(OH)2Cd(OH)2HgO过量Cu(OH)42-Zn(OH)42-Cd(OH)42-NaOH>6moldm-32浓NaOH\n二、重要化合物和离子的结构氟化氙的结构卤素含氧酸根的结构\n多卤化物I3-为线型结构O3的分子结构:中心氧原子sp2杂化,形成键和34过氧化氢二氧化硫结构:sp2杂化键和34三氧化硫结构:sp2杂化键和46\n氮分子的结构氨的结构硝酸的结构H3PO2H3PO3H3PO4的结构CO和CO2的结构硅酸盐\n含硼化合物的结构CuCl2为顺磁性,结构:dsp2杂化链状结构HgCl2:sp杂化线型分子反磁性Hg2Cl2:sp杂化线型分子反磁性配位化合物的结构\n\n三、重要化合物和离子的化学性质1.氧化还原性质\n过氧化氢的氧化还原性质\n硝酸与金属的反应:a)FeCrAl和冷浓硝酸,形成一层不溶的保护膜,阻碍反应的继续进行b)SnAsSbMoW等和浓硝酸反应生成含水的氧化物或含氧酸c)其余金属和硝酸反应都生成硝酸盐硝酸被金属还原的产物:浓硝酸(12-16moldm-3)NO2为主;6-8moldm-3硝酸NO为主;~2moldm-3硝酸N2O为主;活泼金属与很稀的硝酸(<2moldm-3)以NH4+为主;活泼金属与硝酸H2\n王水Au+HNO3+4HCl=HAuCl4+NO+2H2OSn(II)的还原性Fe3+Fe2+Hg2+Hg22-Hg氧化态间的转化Cu+Cu2+Cu2+0.153VCu+0.521VCu生成沉淀:2Cu2++4I-=2CuI+I2生成配合物:2Cu2++2H++4Cl-+Cu=2H[CuCl2]Hg(I)Hg(II)Hg2+0.92VHg22+0.797VHgHg2(NO3)+H2S=HgS+Hg+2HNO3Hg2(NO3)+2NH3=HgNH2NO3+Hg+2NH4NO3\nCr(III)与Cr(VI)的相互转化CrO42-+4H2O+3e=Cr(OH)3+4OH--0.12VCr2O72-+14H++6e=2Cr3++7H2O1.33VMn(II)Mn(VII)PbO2NaBiO3(NH4)2S2O8\nMn2+Mn(OH)2浅粉MnO(OH)2棕Fe2+Fe(OH)2白Fe(OH)2Fe(OH)3灰绿Fe(OH)3红棕Co2+Co(OH)Cl蓝Co(OH)2粉红(H2O2)Co(OH)3土褐Ni2+Ni(OH)Cl绿Ni(OH)2绿(ClO-)Ni(OH)3黑\n三、重要化合物和离子的化学性质s区元素的化合物p区元素的化合物HF酸性HF+F-=HF2-与二氧化硅的反应HF+SiO2=SiF4+2H2O卤素的含氧酸及其盐多卤化物I2+I-=I3-\n多硫化物和硫代酸盐硫酸氨及与水性质的比较硅的化合物铅的化合物BF3水解,缺电子化合物铝的化合物\nd区元素的化合物离子极化对ds区元素化合物性质的影响颜色溶解HgF2HgCl2HgBr2HgI2水解性质Hg2+与卤素及拟卤离子形成的配合物HgX42-HgNH2X\n4)常见配位化合物及配位数Cu(I)Cu(NH3)2+CuCl3-Cu(CN)43-Cu(II)配位数通常为4CuCl42-Cu(NH3)42+Cu(CN)42-Ag(I)配位数通常为2Ag(NH3)2+Ag(S2O3)23-Ag(CN)2-Zn(II)配位数为4和6ZnCl42-Zn(NH3)42+Zn(NH3)62+Cd(II)常见配位数为4Hg(II)配位数为4与卤素和类卤离子CrO42-Cr2O72-CoCl2的颜色\n四、离子的分离和鉴定Na+K+NH4+Ca2+Ba2+Al3+Sn2+Pb2+Cu2+Ag+Hg2+Mn2+Fe2+Fe3+Co2+Ni2+卤素离子S2-S2O32-SO32-SO42-CrO42-Cr2O72-\n\n原理部分一、配位化合物定义配位化合物的化学键理论1价键理论1)配位键的本质共价2)内轨型和外轨型配合物磁性3)配位离子的空间构型\n2.晶体场理论1)键本质:静电作用2)d轨道能量的分裂分裂能的大小:八面体场大于四面体场中心离子的影响配体的影响:Cl–O—H···O>O—H···N>N—H···N>O—H···Cl>O—H···S特点:是特殊的分子间作用力具有方向性和饱和性\n晶体结构1.晶格和点阵、晶胞晶系:立方四方正交单斜三斜三方六方2.金属晶体—堆积非密置层的堆积:简单立方和体心立方密堆积:立方密堆—面心立方六方密堆—六方晶胞空间利用率及配位数离子晶体CsCl负离子成简单立方堆积,正离子占据立方体间隙。NaCl负离子成面心立方堆积,正离子占据八面体体间隙。ZnS负离子成面心立方堆积,正离子占据四面体间隙。\n分子晶体共价晶体金刚石和石墨的结构\n离子极化离子的极化能力离子的变形性离子极化对键型和晶型的影响\n三、原子结构Bohr氢原子理论氢原子光谱谱线的通式:1/=RH(1/n12–1/n22)两个假设微观粒子的波粒二象性=h/p=h/mv3.近代量子力学对氢原子结构的描述:微观粒子的运动服从Shrodinger方程式,可用特定的波函数来描述它们的运动状态。电子并不存在确定的原子轨道,但电子在空间都有一定的几率分布。电子的运动状态由四个量子数(n,l,m,ms)所规定,包括电子在空间的几率密度、能量、轨道形状和空间取向、电子的自旋状态。(四个量子数的取值)\n原子轨道的图形spd轨道的径向、角度和电子云图5.多电子原子中的电子排布:轨道能量取决于主量子数和角量子数,钻穿和屏蔽效应电子排布的原则:能量最低原理、Pauli不相容原理、Hund规则6.元素周期律元素性质的周期性变化:半径电离能电子亲和能电负性\n四、氧化还原反应及电化学基础原电池电池符号电极电势与电池电动势与GT和KGT=-nF=2.303RTlgK/nF=(0.0591/n)lgK3.Nernst方程=+(0.0591/n)lgQ浓度对电极电势的影响的计算: 三类电极反应氧化还原平衡与酸碱及沉淀溶解平衡利用电极电势测定KaKbKsp元素标准电极电势图水的E-pH图\n五、沉淀溶解平衡溶度积Ksp溶解度的求算沉淀的生成:同离子效应盐效应沉淀的溶解沉淀的转化分步沉淀\n六、酸碱平衡酸碱理论:电离理论质子理论:共扼强弱:区分和拉平效应电子理论酸碱的电离平衡一元弱酸碱[H+]=(cKa)1/2适用条件二元弱酸碱H3O+主要来自于第一步电离弱酸根浓度近似等于Ka,2值\n两性物的电离[H+]=(Ka,1Ka,2)1/2混合弱酸碱的电离[H+]=(KaKw/Kb)1/2平衡的移动缓冲溶液pH=pKa+lg(CA-/CHA)\n七、化学反应速率反应速率的定义微分速率方程v=k[A]m[B]n基元反应V=k(A)a(B)b质量作用定律反应级数一级反应lg(A)=lg(A)0–kt/2.303t1/2=0.693/k零级反应(A)=(A)0–kt活化能定义\n普通化学第1-3章总结(1-3章)理想气体状态状态方程PV=nRT气体:混合气体分压定律PA=P总(nA/n总)V、T恒定P、T恒定VA=V总(nA/n总)\nLgk=-(Ea/2.303R)(1/T)+Ck=Ae-Ea/RT6.反应速率理论碰撞理论过渡状态理论7.催化作用\n普通化学第1-3章四个热力学函数:UHSG它们都是状态函数,容量性质;2)U、H、S、GU=Q–W=QvH=U+pV=Qp化学热力学Gibbs-Helmholtz方程GT=HT-TST\n普通化学第1-3章4)Hess定律-热循环\n普通化学第3章化学平衡平衡常数表达式标准平衡常数和实验平衡常数van’tHoff等温式:G=G+2.303RTlgQ平衡时,G=0G=-2.303RTlgKp\n普通化学第3章G=-2.303RTlgK+2.303RTlgQ=-2.303RTlg(K/Q)QK,G>0,不自发Q=K,G=0,平衡\n普通化学第3章化学平衡的移动:分压(浓度)、压力、温度的影响-LeChâtelier'sPrinciplelg(K2/K1)=(H/2.303RT)(1/T1-1/T2)多重平衡和偶合(连)反应\n