- 1.45 MB
- 2022-08-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
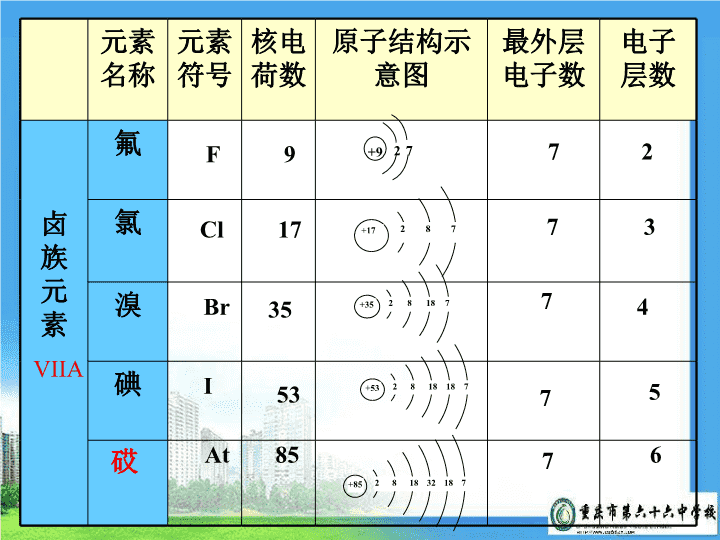
例:已知NaOH为强碱、Mg(OH)2为中强碱、Al(OH)3为两性氢氧化物,则Na、Mg、Al的金属性强弱顺序如何?金属性Na〉Mg〉Al比较元素的金属性强弱有哪些事实依据?1单质与水(酸)反应置换出氢的难易程度2最高价氧化物的水化物(氢氧化物)的碱性强弱3单质间的置换反应\n学习目的:掌握卤族元素的性质与原子结构的关系卤族元素\n元素名称元素符号核电荷数原子结构示意图最外层电子数电子层数卤族元素氟氯溴碘砹F972Cl1773Br3574I5375At8576+972+17287+3528187+532818187+85281832187VIIA\n科学探究——卤族元素的性质浏览P7的卤族元素的原子结构,并思考:卤素(ⅦA族)的原子结构有什么共同之处吗?最外层都有7个电子,化学性质相似;随着核电荷数的增加,原子的电子层数递增,原子核对最外层电子的引力逐渐减弱,得电子的能力逐渐减弱,非金属性逐渐减弱。理论分析实验验证\n卤素单质颜色状态密度熔点沸点F2淡黄绿色气体1.69g/L-219.6-188.1Cl2黄绿色气体3.214g/L-101-34.6Br2深红棕色液体3.119g/mL-7.258.78I2紫黑色固体4.93g/mL-113.5184.4卤素单质的物理性质\n卤族元素在物理性质上的规律浏览P8资料片卡中卤素单质的物理性质表,并总结规律:结论:(1)颜色——(2)状态——(3)密度——(4)熔沸点——自上而下逐渐增大(与碱金属相同)自上而下逐渐升高(与碱金属相反)浅深;气液固;\n思考:如何通过实验验证卤素化学性质的相似性和不同点?(1)与氢气的反应;(2)相互间的置换反应;阅读卤素单质与氢气反应的表格:1、与氢气的反应\n名称反应条件方程式生成氢化物的稳定性F2Cl2Br2I2冷暗处爆炸H2+F2==2HFHF很稳定光照或点燃H2+Cl2==2HClHCl稳定高温H2+Br2==2HBrHBr较不稳定高温、持H2+I22HIHI很不稳定续加热500℃光照卤素与氢气的反应点燃\n光500℃卤素单质与氢气反应规律:即:卤素单质与氢气反应剧烈程度:F2>Cl2>Br2>I2生成氢化物稳定性:HF>HCl>HBr>HIF2Cl2Br2I2与H2化合的难易程度:生成的氢化物的稳定性:越来越难逐渐减弱反应通式:X2+H2===2HX\n〖实验探究2〗实验现象化学方程式卤族单质的氧化性比较1.少量新制氯水加入盛有NaBr溶液的试管中,用力振荡后加入少量CCl4,振荡,静置。2.少量新制氯水加入盛有KI溶液的试管中,用力振荡后加入少量CCl4,振荡,静置。3.少量溴水加入盛有KI溶液的试管中,用力振荡后加入少量CCl4,振荡,静置。溶液由无色变黄色,加入CCl4后,溶液分层,上层无色,下层橙红色溶液由无色变黄色,加入CCl4后,溶液分层,上层无色,下层紫红色溶液由无色变黄色,加入CCl4后,溶液分层,上层无色,下层呈紫红色2NaBr+Cl2=Br2+2NaCl2KI+Cl2=I2+2KCl2KI+Br2=I2+2KBr从F2到I2氧化性渐弱\n2、卤素间的相互置换(1)Cl2+2Br-=====2Cl-+Br2(2)Cl2+2I-=====2Cl-+I2(3)Br2+2I-=====2Br-+I2思考:根据上述实验,排出Cl2、Br2、I2的氧化性强弱顺序及Cl-、Br-、I-的还原性强弱顺序结论:氧化性:Cl2>Br2>I2还原性:I->Br->Cl-\n在我们所学过的知识里氯气能与哪些物质反应?那么F2、Br2、I2能否与上述物质反应?能反应写出反应方程式。讨论:回忆:\n1、与金属反应2、与氢气反应3、与水反应4、与碱反应。2Na+Cl22NaCl点燃H2+Cl22HCl点燃Cl2+H2O==HCl+HClO2OH-+Cl2=ClO-+Cl-+H2O\n化学性质相似性2.卤素单质与氢气的反应:H2+X2=2HX3.卤素与水反应X2+H2OHX+HXO2F2+2H2O=4HF+O2(爆炸)F2的特殊性4.卤素单质与碱反应X2+2NaOH=NaX+NaXO+H2O1.卤素单质与活泼金属(Na等)的反应:Na+X2=2NaX\n思考1:通过上述对卤族的结构分析,结合实验,请你归纳卤族元素的化学性质?同:卤族元素由于最外层是7个电子,都可以得到电子,体现氧化性.异:卤族元素从F到I由于电子层数逐渐增多,半径逐渐增大,得电子能力逐渐减弱,非金属性逐渐减弱,氧化性逐渐减弱\nIALiNaKRbCsFr金属性增强ⅦAFClBrIAt非金属性减弱原因:同一主族的元素中,各元素的最外层电子数相同,由于从上到下电子层数增多,原子半径增大,原子核对外层电子的引力减弱,失电子能力逐渐增强,得电子能力逐渐减弱思考2:通过对碱金属、卤族两个主族元素的研究学习,请你总结元素周期表中主族元素的性质与原子结构的关系:\n总结:至此我们可以看到同一主族元素,无论是金属还是非金属在性质方面都具有一定的相似性和递变性。失电子的能力逐渐增强得电子的能力逐渐减弱还原性逐渐增强氧化性逐渐减弱金属性逐渐增强非金属性逐渐减弱