- 2.76 MB
- 2022-08-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
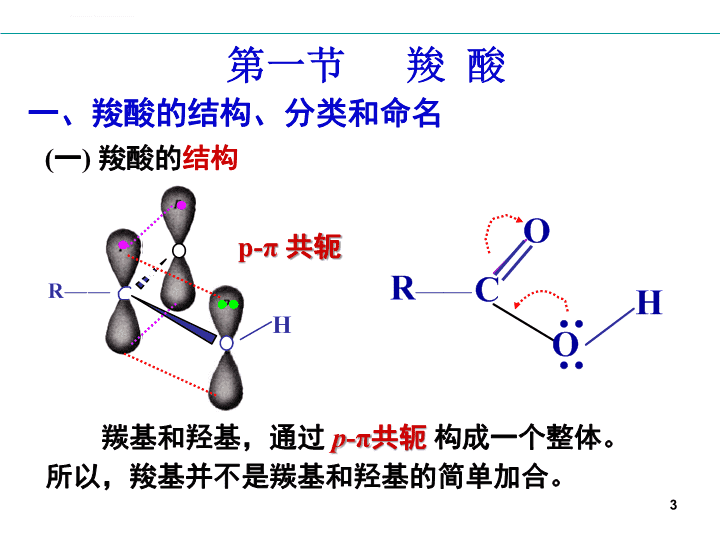
羧酸和取代羧酸第一节羧酸一、结构分类命名二、物理性质三、化学性质第二节取代羧酸一、羟基酸二、羰基酸1\n含有羧基的化合物,称为羧酸。羧酸和取代羧酸烃基上的氢原子被其它原子或基团取代的羧酸称为取代羧酸(substitutedcarboxylicacids)。RCOOHArCO2H2\n第一节羧酸一、羧酸的结构、分类和命名(一)羧酸的结构羰基和羟基,通过p-π共轭构成一个整体。所以,羧基并不是羰基和羟基的简单加合。p-π共轭3\n键长——平均化p-π共轭对结构与性质的影响:122pm143pm136pm123pm羧基C的正电性——降低,亲核反应变难α-H的活性——降低,诱导效应减弱羧羟基的酸性——增强,极性增强4\n羧酸根负离子的p-π共轭127pm127pm负电荷,均分在两个氧原子上;增强了羧酸根负离子的稳定性;有利于H+的离去。键长完全平均化。5\n(二)羧酸的分类6\n(三)羧酸的命名常见的羧酸多用俗名。HCOOH甲酸(蚁酸Formicacid)CH3COOH乙酸(醋酸Aceticacid)CH3CH2CH2CO2H丁酸(酪酸Butyricacid)HOOC-COOH乙二酸(草酸Oxalicacid)HO2CCH2CH2CO2H丁二酸(琥珀酸Succinicacid)C6H5CH=CHCO2H肉桂酸(Cinnamicacid)7\n系统命名法与醛相似。羧基C永远为C-1;对于简单的羧酸,也常用α、β、γ等希腊字母表示取代基的位次。54321gba3-甲基戊酸β-甲基戊酸4321gba2-甲基-4-溴丁酸α-甲基-γ-溴丁酸8\n2-甲基-3-丁烯酸3-硝基-4-氯苯甲酸邻苯二甲酸(酞酸)反-1,4-环己基二甲酸α-萘甲酸1-萘甲酸9\nCH3CH3-C-CO2HC2H5-CO2HCO2HClClCOOHCH2H—C—CO2HCH—OHCH2CO2H2,2-二甲基丁酸环丙基甲酸2,4-二氯苯甲酸12453-羧基-4-羟基己二酸(不讲)10\n己二酸3-羧甲基11\n二、羧酸的物理性质1.性状:常温下,1~9C饱和一元酸为具有强烈气味的液体;高级脂肪酸为无味无臭蜡状固体;二元酸和芳香酸是结晶固体。2.溶解性:低级脂肪酸易溶于水,但随相对分子质量的增加水溶度降低:甲、乙、丙、丁酸与水互溶,己酸0.96%,辛酸0.08%。高级一元酸不溶于水,但能溶于乙醇、乙醚、氯仿等有机溶剂。多元酸的水溶性大于相同碳数的一元酸。芳酸的水溶性极微。12\n与相对分子质量相近的其它类型有机化合物相比,羧酸有特别高的沸点。MW60605856Bp/℃117.982.356.5-6.9形成双分子氢键缔合体13\n三、羧酸的化学性质3.α-H的反应1.酸性2.亲核取代14\n(一)羧酸的酸性与成盐Ka:10-4~10-5p-π共轭,增强了羧羟基的极性,增强了其酸性。p-π共轭,增强了羧酸根负离子的稳定性,有利于H+的离去。15\n酸性比较(pKa):酸性强弱,主要影响因素电子效应、立体效应和溶剂化效应。16\n1、脂肪酸就电子效应而言,吸电子基使酸性增强,供电子基使酸性减弱。Gw:withdrawinggroup吸电子基增强酸性Gr:releasinggroup供电子基减弱酸性吸增供减17\npKa3.774.761.68pKa2.622.872.903.164.76pKa2.864.064.5218\n19pKa4.354.173.42(1)2、芳香酸\n20CH2=CH—CH=CH—CH=CH——NO2d-d-d-d+d+d+其吸电子共轭效应通过共轭体系,交替传递到终端。\n21CH3-是供电子基,主要发生供电子共轭效应,其酸性小于苯甲酸。NO2-是吸电子基,主要发生吸电子共轭效应,其酸性大于苯甲酸。\n22(2)HCOOHC6H5COOHCH3COOHpKa3.774.174.76苯环大π键与羧基构成共轭体系,主要发生供电子共轭效应(+C),电子云向羧基偏移,减弱了羧羟基的极性。同一基团的若干种作用相反时,其主要作用决定最终结果。\n23HCOOHC6H5COOHCH3COOHpKa3.774.174.76在苯甲酸分子中,羧基与sp2杂化的碳原子相连;而在乙酸中,与sp3杂化的碳原子相连。前者的S成分多,吸电子能力强,增强了羧羟基的极性,使其酸性较强。\n24(3)pKa4.173.892.21邻位基团的存在,产生空间位阻;使羧基与苯环的共平面性减少,即羧基碳氧双键上π电子不能与苯环上π电子很好的共轭;从而使苯基的供电子共轭效应减弱,使羧羟基的极性增强,其酸性大于苯甲酸。邻位效应:邻位基团对活性中心的影响。\npKa4.173.892.21影响因素多,其作用一致或相反;主要因素决定最终结果。25\nKa15.9×10-21.6×10-36.8×10-5Ka24.0×10-51.4×10-62.3×10-63、二元酸酸性与两个羧基的相对距离有关。低级二元羧酸的酸性,相对于同碳原子数的一元羧酸的酸性,强一些。26\n练习:比较酸性强弱pKa3.774.174.76HCOOHC6H5-COOHCH3COOH(1)(2)pKa4.762.661.240.2327\n羧酸能与碱中和生成羧酸盐和水。利用羧酸与NaHCO3反应放出CO2,可以鉴别、分离苯酚和羧酸。4、成盐与无机酸相比,RCOOH仍为弱酸:28\n氨苄青霉素(氨苄西林)COONa羧酸的碱金属盐——易溶于水应用:1.区别和分离酚与羧酸2.羧酸盐在制药上的应用提示:酸溶酚溶溶不溶\n(二)生成羧酸衍生物羧羟基被其它原子或原子团取代后,生成的化合物,称为羧酸衍生物(derivativesofcarboxylicacid)。酰基离去基团酰卤(Acylhalide)酸酐(Anhydride)酯(Ester)酰胺(Amide)30\n1、酰卤的生成酰卤具有高度反应活性,广泛应用于药物合成中。苯甲酰氯31\n2、酸酐的生成羧酸(除甲酸外)在脱水剂(乙酰氯、乙酐、P2O5)作用下或加热,分子间失去一分子水,生成酸酐(acidanhydride)。甲酸与脱水剂共热,分解为一氧化碳和水:酐键32\n马来酸马来酸酐五、六元环的酸酐,可通过加热相应二元羧酸得到。33\n3、酯(ester)的生成羧酸与醇在酸催化下加热反应生成酯和水,称为酯化反应(esterification)。同样条件下,酯水解又可生成羧酸和醇。所以,酯化反应是可逆反应。苯甲酸甲酯(85-95%)乙酸乙酯酯键34\n通常,伯醇、仲醇与羧酸的酯化反应,按酸脱羟基醇脱氢的方式生成酯。35\n36四面体中间体羧酸和醇的结构对酯化难易的影响很大。通常,羧酸或醇分子中,烃基的空间位阻加大,都会使酯化反应速度变慢。活性顺序:对醇:CH3OH>RCH2OH>R2CHOH>R3COH对酸:HCO2H>CH3CO2H>RCH2CO2H>R2CHCO2H>R3CCO2H\n叔醇的酯化反应经实验证实是按照烷氧断裂的方式进行的:即:\n4、酰胺的生成羧酸与氨(或胺)反应首先形成铵盐,然后加热脱水得到酰胺(amide)。酰胺键38\n(三)脱羧反应和脱水反应羧酸失去羧基,放出CO2的反应,称为脱羧反应。几乎所有羧酸或其盐类在强烈的条件下都可脱羧:若α-C上,连有吸电子基,则易脱羧。丙二酸乙酸应用:体内脂肪酸和氨基酸的脱羧是在脱羧酶化下进行的39\n无水羧酸钠与碱石灰共热,则羧酸盐失去CO2生成烃。仅限于低级脂肪酸盐及芳香族羧酸盐。例如若羧酸的α-碳原子上连有强吸电子基团,加热即可顺利地脱羧。\n二元羧酸受热后,由于两个羧基的位置不同而发生不同的反应,有的脱羧,有的脱水,有的同时脱水脱羧。丁二酸、戊二酸分子内脱水脱水生成酸酐。在Ba(OH)2存在下,己二酸、庚二酸受热脱水脱羧形成环酮。草酸和丙二酸易脱羧:200℃\n(四)氧化还原反应羧酸不易被还原。在强还原剂(如LiAlH4)作用下,羧酸直接还原为伯醇,分子中所含碳碳双键一般不受影响。甲酸中的甲酰基具有醛的性质,容易氧化,其它酸不易氧化。\n(五)α-H的卤代少量P少量P在工业上,可控制反应条件,用于制备一氯乙酸及衍生物,例:少量P(过量)\n四、重要的羧酸1.甲酸(蚁酸)(1)甲酸酸性>其它饱和一元酸(2)甲酸能被托伦试剂和费林试剂氧化,也易被高锰酸钾氧化而使高锰酸钾褪色。利用这些性质定性鉴别甲酸。(3)甲酸与浓硫酸共热分解生成CO和H2O,这是实验室制备少量CO的方法之一。2.乙酸3.丙烯酸\n4.乙二酸(草酸)(1)制备(2)化学性质①易脱羧:②具有还原性,易被KMnO4氧化。5H2C2O4+2KMnO4+3H2SO4=K2SO4+2MnSO4+10CO2+8H2O此反应用于标定KMnO4的浓度。③能与多种金属离子形成络合物。在纺织、印染、服装工业中广泛用于除铁迹。\n第二节取代羧酸烃基上的氢,被取代后的产物称为取代羧酸。取代羧酸羧酸衍生物46\n一、羟基酸命名:系统命名法,更常用俗名。羟基酸分子中具有羧基和羟基两种官能团。(一)分类与命名分类:醇酸(α,β,γ,δ…);酚酸IUPAC:2-羟基丙酸2-羟基丁二酸俗名:乳酸(Lacticacid)苹果酸(Malicacid)47\n2,3-二羟基丁二酸3-羧基-3-羟基戊二酸IUPAC:2-羟基苯甲酸水杨酸(salicylicacid)3,4,5-三羟基苯甲酸没食子酸(gallicacid)IUPAC:俗名:酒石酸(Tartaricacid)柠檬酸枸橼酸(Citricacid)俗名:48\n(二)羟基酸的物理性质醇酸:一般是粘稠状液体或晶体。由于分子中的羟基和羧基都能与水形成分子间氢键,因此醇酸比相应的羧酸或醇更易溶于水。酚酸:都为晶体,大多微溶于水。羟基酸的熔点比相同碳原子数的羧酸高。49\n(三)羟基酸的化学性质共性:具有羟基和羧基各自的典型性质。羟基:氧化,卤代,脱水,成酯酚羟基:与FeCl3显色羧基:酸性,成盐,成酯特性:因羟基和羧基的相对位置不同,而有所不同。相互影响:受热脱水,易氧化,等50\n1.羟基酸的酸性pKa4.883.834.51羟基的吸电子诱导效应,一般使醇酸酸性比相应的羧酸强。羟基越靠近羧基,其酸性就越强。醇酸:51\n52pKa2.984.204.57酚酸:与邻位效应、诱导效应、共轭效应等有关\n53羧羰基氧与邻位羟基氢,形成分子内氢键;使羧羰基氧上的电子,向邻位羟基氢偏移;导致羧羟基的极性增强,使羧基氢更容易离去。羧基负离子,仍与邻位羟基氢形成氢键;使体系更稳定,也有利于羧基氢的离去。\n54对位:主要表现为+C效应,使酸性减弱。\n2.醇酸的氧化反应受羧基吸电子效应的影响,醇酸中的醇羟基,比醇分子中的羟基,更容易被氧化。55\n3.醇酸的脱水反应(热稳定性差,易脱水)脱水方式因羟基和羧基的相对位置不同而异。(1)α-醇酸的脱水:受热后,两分子间的羟基和羧基交叉脱水,生成较稳定的六元环交酯。α-羟基丙酸丙交酯56\n(2)β-醇酸的脱水:由于β-羟基和羧基的共同影响,α-H很活泼;受热时容易与β-羟基脱水,生成α,β-不饱和羧酸。57\n(3)γ、δ-醇酸的脱水:γ-醇酸的羟基和羧基,在室温下可自动脱水,生成稳定的五元环内酯。58\nδ-醇酸发生分子内的脱水反应,生成六元环内酯,条件强烈些。δ-戊内酯易开环,常温即可水解,生成δ-戊醇酸。59\n★应用①内酯在酸、碱存在下发生水解反应,在碱存在下,则生成稳定的羟基酸盐。②γ—羟基丁酸钠具有麻醉作用,但不影响基础代谢和呼吸,故经常将它用于呼吸功能不全的患者手术时的麻醉剂。\n4.酚酸的脱羧反应o-或p-羟基苯甲酸,加热至熔点以上时,易脱羧。61\n生物体内的羟基酸1.乳酸存在于酸牛奶、肌肉等中,具有很强的吸湿性;工业上作除钙剂(钙盐不溶于水);食品工业中作增酸剂;钙盐可补钙.2.酒石酸存在于多种水果中.可用作酸味剂,其锑钾盐有抗血吸虫作用.3.柠檬酸存在于多种植物的果实中及动物组织与体液中,为无色晶体.可用于食品工业的调味品(有酸味)也用于制药业.\n4.水杨酸水杨酸及其衍生物有杀菌防腐、镇痛解热和抗风湿作用,乙酰水杨酸就是熟知的解热镇痛药阿司匹林.阿司匹灵有解热、镇痛作用,能抑制血小板凝聚,防止血栓的形成.5.苹果酸存在于植物的未成熟的果实及叶子中,用于制药和食品工业.\n64二、羰基酸羰基酸:同时具有羧基和羰基两种官能团的化合物。分为醛酸和酮酸。(一)酮酸的命名以羧酸为母体,酮基为取代基;其位次用阿拉伯数字或希腊字母表示;酮基也可称为氧代。乙醛酸α-丙酮酸2-氧代丙酸\nβ-丁酮酸3-氧代丁酸CH3COCH2CH2COOHγ-戊酮酸4-氧代戊酸丁酮二酸草酰乙酸α-戊酮二酸2-氧代戊二酸65\n酮酸除了具有酮的通性和羧酸的通性外,α-酮酸和β-酮酸还具有一些特殊的性质。(二)酮酸的化学性质1.酸性酮酸的酸性强于相应的醇酸,更强于相应的羧酸。pKa2.493.513.86pKa4.514.8866\n2.脱羧反应α-酮酸在稀硫酸作用下,受热脱羧,生成少一个碳原子的醛。β-酮酸更易脱羧,通常只能在低温下保存。由于β-酮酸脱羧产物是酮,故称为酮式分解。67\n由于羧基受羰基的影响;也由于形成六元环的分子内氢键,而使脱羧更容易:68\n酸式分解:β-酮酸与浓碱共热,分解为两分子羧酸盐。问题:完成下列反应αβα’β’γ’69\nβ-羟基丁酸、β-丁酮酸和丙酮,三者在医学上称为酮体。β-羟基丁酸β-丁酮酸丙酮血中正常分布:~70%~30%微量血中酮体正常参考值:3~50mg/L酮血症:>3000mg/L70\n用化学方法区分下列各组化合物:思考题1.甲酸、乙酸、草酸2.乙醇、乙醛、乙酸3.丙醛、丙酮、正丙醇、异丙醇、正丙醚、丙酸解:1.甲酸与Tollens试剂作用出现银镜,草酸受热放出CO2.2.乙醛与Tollens试剂作用出现银镜,乙酸与Na2CO3放出CO2.3.丙醛丙酮正丙醚正丙醇异丙醇丙酸Na2CO3×××××Na×××NaOH/I2×羰基试剂×Tollens试剂×\n1.羧酸的结构羰基与羟基通过p-π共轭构成整体2.羧酸的命名俗名;系统命名(似醛)3.羧酸的性质酸性;生成羧酸衍生物;脱羧4.羟基酸酸性;氧化;脱水;酚酸脱羧5.酮酸酸性;脱羧本章要点Byebye!72\n乙酸乙酯的制备\n一、实验目的1、熟悉和掌握酯化反应的特点。2、掌握酯的制备方法。\n二、实验原理在浓硫酸催化下,乙酸和乙醇生成乙酸乙酯:羧酸酯可由羧酸和醇在催化剂存在下直接酯化来进行制备,酸催化的直接酯化和实验室制备羧酸酯是最重要的方法,常用的催化剂有硫酸、氯化氢和对甲磺酸等。一般采用加入过量的乙酸,以便使乙醇转化完全,避免由于乙醇和水及乙酸乙酯形成二元或三元恒沸物给分离带来困难。\n三、主要仪器与试剂仪器:培养皿,烧杯,圆底烧瓶,空气冷凝管,球形冷凝器。试剂:1.5mL浓硫酸,4.6mL乙醇,2.9mL冰醋酸,饱和碳酸钠,饱和氯化钙及饱和氯化钠水溶液,无水硫酸钠\n乙酸乙酯的制备反应装置图\n四、实验流程和装置冰醋酸,乙醇浓H2SO4回流水浴加热蒸馏水浴加热粗乙酸乙酯饱和碳酸钠有机相洗涤①饱和NaCl②饱和CaCl22干燥无水Na2SO4蒸馏7378C乙酸乙酯\n五、实验步骤25mL2.9mL冰醋酸4.6mL乙醇慢慢加入1.5mL浓硫酸振摇循环水回流30min粗乙酸乙酯循环水\n粗乙酸乙酯饱和碳酸钠水溶液不在产生气泡有机相2mL饱和食盐水洗涤2mL饱和氯化钙洗涤两次有机相无水MgSO4干燥初步纯化的乙酸乙酯五、实验步骤\n六、实验关键及注意事项1、控制反应温度在120—125℃,控制浓硫酸滴加速度。2、洗涤时注意放气,有机层用饱和NaCl洗涤后,尽量将水相分干净。3、干燥后的粗产品进行蒸馏,收集65—71℃馏分。\n七、思考题1、酯化反应有什么特点,本实验如何创造条件使酯化反应尽量向生成物方向进行?2、本实验有哪些可能副反应?3、如果采用醋酸过量是否可以,为什么?\n阿司匹林的制备\n实验目的1.了解酰化反应及乙酰化物的制备方法。2.掌握减压过滤、重结晶等基本操作。\n实验原理阿司匹林(学名乙酰水杨酸)为白色针状或片状晶体,能溶解于温水之中,口服后在肠内开始分解为水杨酸、有退热止痛作用。通常由水杨酸和醋酐在浓硫酸①催化下酰化制取乙酰水杨酸。水杨酸具有酚羟基,能与三氯化铁试剂呈现颜色反应,此性质可作为阿司匹林的纯度检验。\n器材与药品1.器材锥形瓶(100mL,干燥),量筒(10mL,100mL,干燥),100℃温度计,减压过滤装置,大烧杯,铁台,铁圈,试管,水浴锅。2.药品浓硫酸,固体水杨酸,醋酐,三氯化铁溶液。\n实验方法一、乙酰水杨酸制备在100mL干燥的锥形瓶里加入2.0g水杨酸②和4.0mL醋酐③,摇匀。向混合物中加入3滴浓硫酸,充分振摇。在水浴中加热,水杨酸立即溶解,使瓶内温度保持在70℃左右(或热水浴80℃左右),维持20min,且不时加以振摇。稍微冷却后,加入50mL蒸馏水,并用冰水冷却15min,直至白色晶体完全析出。抽滤,并用少许冷的蒸馏水洗涤,抽干,即得水杨酸粗品。\n将粗产品放入100mL烧杯中,加入50mL饱和碳酸钠溶液并不断搅拌,直至无二氧化碳气泡产生为止。减压过滤,除去不溶性杂质。滤液倒入洁净的烧杯中,在搅拌下加入30mL盐酸溶液,阿司匹林即呈结晶析出。将烧杯置于冰-水浴中充分冷却后,减压过滤。用少量冷水洗涤滤饼两次,压紧抽干,称量粗产品在一支试管中放入少许乙酰水杨酸,加水溶解,滴入1滴三氯化铁溶液。结果如何?用水杨酸重做此实验,结果如何?\n注意事项①水杨酸形成分子内氢键,阻碍酚羟基酰化作用。水杨酸与酸酐直接作用须加热至150~160℃才能生成乙酰水杨酸,如果加入浓硫酸(或磷酸),氢键被破坏,酰化作用可在较低温度下进行,同时副产物大大减少。②水杨酸应当是完全干燥的,可在烘箱中105℃下干燥1小时。③醋酸酐应重新蒸馏,收集139~140℃馏分。④重结晶时不宜长时间加热,因为在此条件下乙酰水杨酸容易水解。⑤加入乙醇的量应恰好使沉淀溶解。若乙醇过量则很难析出结晶。\n思考题1.进行酰化反应时所用的水杨酸和玻璃器材都必须是干燥的,为什么?2.本实验能否用稀硫酸作催化剂?为什么?3.乙酰水杨酸重结晶时,应当注意什么?为什么?