- 1.02 MB
- 2022-08-10 发布
- 1、本文档由用户上传,淘文库整理发布,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,请立即联系网站客服。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细阅读内容确认后进行付费下载。
- 网站客服QQ:403074932
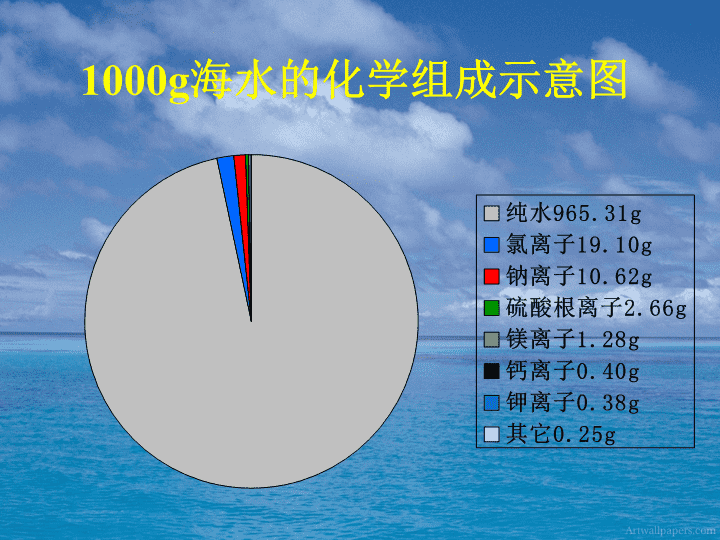
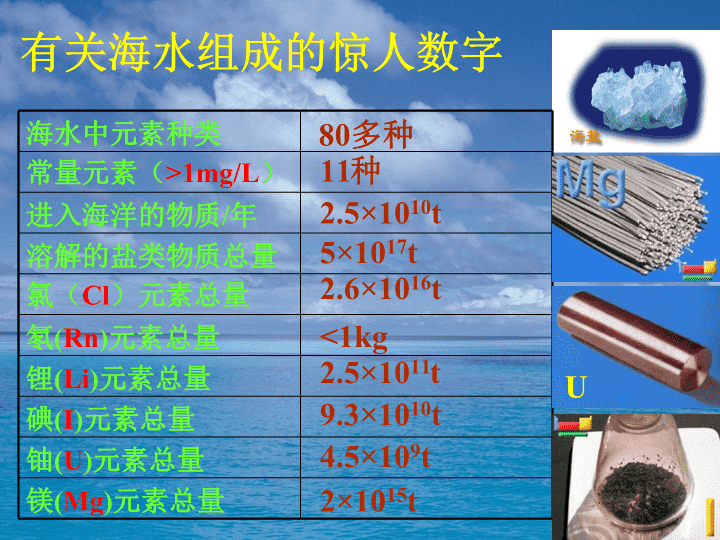
普通高中课程标准实验教科书化学1(必修)第三章第四节海水中的化学元素制作:文登第一中学鞠章英\n1000g海水的化学组成示意图\n有关海水组成的惊人数字海水中元素种类常量元素(>1mg/L)进入海洋的物质/年溶解的盐类物质总量氯(Cl)元素总量氡(Rn)元素总量锂(Li)元素总量碘(I)元素总量铀(U)元素总量镁(Mg)元素总量80多种11种2.5×1010t5×1017t2.6×1016t<1kg2.5×1011t9.3×1010t4.5×109t2×1015tU\n氯碱工业简介盐酸漂白剂2NaCl+2H2O===2NaOH+Cl2↑+H2↑直流电原理:原料:产品:用途:\n海水提镁[交流讨论]1、简述海水提镁的基本方法和工业流程。2、海水提镁要用到海滩上的贝壳。那么,贝壳在生产流程中起什么作用?其主要成分发生了怎样的化学变化?3、从海水中的镁离子到金属镁,经历了哪些化学变化?4、在用上述方法提镁的过程中,采取了哪些措施来提高经济效益?这对你有什么启示?go\n海水加碱过滤Mg(OH)2通电Mg加HCl浓缩MgCl2返回贝壳起到提供碱-消石灰的作用。主要成分发生的化学变化有:CaCO3======CaO+CO2↑CaO+H2O=Ca(OH)2高温返回\n经历的化学变化有:Mg2++2OH-=Mg(OH)2↓Mg(OH)2+2HCl=MgCl2+2H2OMgCl2====Mg+Cl2↑通电返回\n(1)就地取材-利用海滩上的贝壳(2)节约原料-循环利用氯元素启示:一个真实的化学工业流程所考虑的问题远比我们想象的复杂。它不仅考虑化学反应,还要考虑经济效益、环境保护等问题。\n镁的主要化学性质-还原性[思考]由镁引起的火灾能否用泡沫灭火器灭火?点燃2Mg+CO2===2MgO+C⑴与酸反应置换氢:⑵与氧气反应:⑶与CO2反应:Mg+2H+-=Mg2++H2↑点燃2Mg+O2===2MgO\n溴和碘的溶解性溴水CCl4振荡CCl4层水层碘水振荡CCl4水层CCl4层\n溴和碘在不同溶剂中的颜色比较(溶质稀→浓)溶剂溶质水酒精四氯化碳(比水重)溴碘溶剂溶质水黄→橙橙→橙红橙→橙红黄→褐褐→棕褐紫→深紫\nI2的特性淀粉溶液碘水升华碘使淀粉变蓝\n氯、溴、碘的原子结构ClBrI最外层最子数相同性质相似—都有氧化性\nNaBr溶液氯水CCl4溶液、振荡水层CCl4层KI溶液溴水CCl4溶液、振荡水层CCl4层KI溶液氯水CCl4溶液、振荡水层CCl4层氯溴碘单质氧化性强弱比较建议方案\nCl-、Br-、I-离子的检验方案\n